毕赤酵母糖基化对布鲁菌P39抗原诱导巨噬细胞吞噬的影响
刘思阳 王岩 付玉芹 胡祥坤 王茗宇 卢天成 王秀然
(吉林农业大学生命科学学院 生物反应器与药物开发教育部工程研究中心,长春130118)
布鲁菌病是全球性人畜共患传染病,可引发家畜(猪、羊和牛)发热、流产及死亡,对农牧经济造成重大的损失并严重威胁人类的健康[1-2]。Rev.1、S19等减毒菌株是目前可用于控制动物布氏杆菌病的有效疫苗之一,但减毒疫苗存在一定的风险,安全性差[3]。布鲁菌抗原在激活宿主免疫时,特别是天然免疫的水平较低,不能形成稳定的免疫保护,因此提高蛋白免疫保护水平成为布鲁菌亚单位疫苗的热点[4]。Denoel等[5]研究表明胞间质结合蛋白(P39)作为T细胞免疫布鲁菌抗原可诱导Th1导向型的免疫反应,具有较高的免疫原性,因此P39成为很有前景的亚单位候选抗原。
近年来通过糖基化修饰改变蛋白质的生物学活性,提高蛋白免疫保护水平在疫苗领域备受关注,已有部分疫苗应用于临床[6-8]。有研究表明,通过糖基化修饰后的蛋白可激活宿主TLR4受体系统,提高宿主细胞天然免疫水平,从而提高抗原的免疫保护作用[9]。
本研究选取可进行糖基化修饰的毕赤酵母表达系统[10],对布鲁菌优势抗原蛋白P39进行分泌表达,探究其修饰后对巨噬细胞吞噬的影响。为进一步研究糖基化影响蛋白免疫原性的机理,开发新型糖基化布鲁菌亚单位疫苗提供理论和实验依据。
1 材料与方法
1.1 材料
大肠杆菌Escherichia coliTOP10株购自全式金生物公司(北京,中国)毕赤酵母P. pastoris GS115由山东大学微生物实验室惠赠(山东,中国)、pPICZαA真核表达载体购自Invitrogen公司(长春,中国)、布鲁菌(B.melitensis16M)DNA由军事医学科学院军事兽医研究所提供。
ExTaq DNA 聚合酶、T4 DNA ligase、EcoR I、NotI、SacI、DNA marker 均为TaKaRa公司产品(长春,中国),Zeocin 为Invitrogen公司产品(长春,中国);Protein Find Anti-His Mouse Monoclonal Antibody、Protein Find Goat Anti-Mouse IgG(H+L),HRP Conjugate购自全式金公司(北京,中国)。PNGaseF糖苷酶购自NEB公司(上海,中国);PVDF膜、滤纸购自promega公司(上海,中国),引物合成及基因测序由上海华大基因有限公司完成(上海,中国)。
1.2 方法
1.2.1 毕赤酵母真核表达载体pPICZαA-P39 的构建根据GenBank公布的Brucella melitensis16M(GenBank Accession ID:WP:087932960)序列,应用DMAMAN及primer 5.0基因分析软件,设计扩增P39基因序列,以布鲁菌基因组为模板进行PCR扩增。上游引物序列gaattc(EcoR I)ATGGCACCTGTTGCCAATGC,下游引物序列gcggccg(NotI)TTTTGCGGCTTCAACCGCC。将胶回收的 PCR 扩增产物P39基因与pPICZα-A 质粒用EcoRI、NotI进行双酶切,将酶切后的P39基因片段用 T4DNA 连接酶连接pPICZα-A 载体上,热激法转化大肠杆菌 TOP 10 感受态细胞中。经双酶切鉴定正确后送上海华大基因有限公司测序。
1.2.2 重组蛋白P39的诱导表达 挑取生长在Zeocin抗性YPD平板上的阳性单菌落,接种于5 mL的BMGY液体培养基中,在50 mL三角瓶中培养,28℃、250 r/min摇床培养16-20 h,至OD600值约为2.0-4.0,此时酵母菌处于对数生长期。离心收集菌液,6 000 r/min,4℃离心,收集沉淀,重悬于5 mL的BMMY液体培养基,转入50 mL的BMMY液体培养基中,250 mL三角瓶继续震荡培养。每隔24 h加入1%的甲醇进行诱导表达。同时电转化空载体pPICZαA的GS115菌株作为阴性对照。培养96 h后收集样品,10 000 r/min,4℃离心2 min,取上清进行SDS-PAGE分析蛋白的表达情况。
1.2.3 重组蛋白P39的纯化 将收集好的上清液进行真空冻干,10 mmol/L,pH 7.4的磷酸盐溶液(PBS)透析48 h,0.22 μm无菌过滤器过滤,利用Sephacryl S-100蛋白层析纯化柱纯化,20 mmol/L NaCl洗脱蛋白,每管3 mL,Nanodrop在280 nm处检测吸光值,SDS-PAGE鉴定各层析成分。
1.2.4 蛋白P39免疫印迹实验(Westen blot)鉴定 通过 Western blotting 检验纯化后的重组目的蛋白。SDS-PAGE后100 V恒压转膜55 min。用5%脱脂奶粉室温封闭2 h,TBST漂洗3次,加入1∶1 000 稀释的抗his标签鼠单克隆抗体,37℃孵育45 min,TBST 漂洗3次后,加入1∶1 000稀释的HRP标记的羊抗鼠IgG抗体,室温孵育45 min,TBST漂洗3次后用DAB显色试剂盒进行显色(购自sigma公司),观察目的条带并记录结果。
1.2.5 发酵条件对蛋白表达量的影响
1.2.5.1 pH值对重组蛋白P39表达量的影响 取阳性重组菌以1%的接种量分别接入pH值分别为3.0、5.0、6.0、8.0的200 mL BMGY培养基中,盐浓度0.05M,28℃摇床培养,至OD600值为0.6-0.8时,1%甲醇诱导72 h。
1.2.5.2 磷酸盐浓度对重组蛋白P39表达量的影响 取阳性重组菌以1%的接种量分别接入磷酸盐浓度分别为0.02 mol/L、0.05 mol/L、0.1 mol/L和0.2 mol/L的BMGY培养基进行培养,pH 6.0,OD600值为0.6-0.8时,1%甲醇诱导72 h。
1.2.5.3 甲醇浓度对重组蛋白P39表达量的影响 取阳性重组菌以1%的接种量BMGY培养基中,28℃摇床培养,盐浓度0.05 mol/L,pH 6.0,OD600值为0.6-0.8时,分别以0.5%、1%、2%和3%不同浓度的甲醇诱导72 h。
1.2.5.4 诱导时间对重组蛋白P39表达量的影响 取阳性重组菌以1%的接种量BMGY培养基中,28℃摇床培养,盐浓度0.05 mol/L,pH 6.0,OD600值为0.6-0.8时,以1%浓度的甲醇分别诱导24 h、48 h、72 h和 96 h。
1.2.5.5 NanoDrop检测蛋白浓度 以100 μg/mL牛血清白蛋白作为对照,对目的蛋白进行蛋白浓度标定。
1.2.6 酵母分泌表达的P39蛋白糖基化鉴定 将纯化后10 μg的真核蛋白加入1 μL糖蛋白变性缓冲液,总体积10 μL。100℃变性10 min,加入2 μL的glycobuffer,10% NP-40和1 μL的PNGaseF糖苷酶,37℃,孵育1 h。500 MHz核磁共振氢谱检测重组P39蛋白糖基化修饰水平。
1.2.7 巨噬细胞RAW264.7吞噬荧光抗原实验 将FITC与真核蛋白及原核蛋白进行混合反应,在4℃避光反应18 h后收集样品。复苏RAW264.7巨噬细胞后将其以105个每孔接种于24孔板中,加入FITC标记的真核蛋白和原核蛋白,PBS作为空白对照组,荧光显微镜观察巨噬细胞吞噬抗原蛋白情况,分别记录4 h、6 h不同时间巨噬细胞吞噬蛋白情况。
2 结果
2.1 构建真核表达载体pPICZαA-P39
DNA核酸电泳显示成功构建pPICZαA-P39真核表达载体,电转化后挑选出的阳性菌株。条带大小与理论的片段大小一致为1 206 bp,如图1所示。
2.2 真核P39抗原表达纯化与Western blot鉴定
甲醇诱导阳性转化子表达,SDS-PAGE检测P39蛋白的表达,目的条带在45 kD处,如图2。目的蛋白条带与理论值大小一致,纯化后的蛋白纯度较好,高效液相色谱检测纯化蛋白纯度,纯度可达93.77%,如图3和图4所示。经Western blot免疫印迹法检测确定该蛋白为P39蛋白,特异性良好,如图5所示。

图1 真核表达载体pPICZαA-P39的构建

图2 SDS-PAGE分析重组蛋白在毕赤酵母中的表达

图3 纯化后重组蛋白P39

图4 高效液相色谱(HPLC)检测纯化蛋白纯度

图5 重组蛋白P39 western blot鉴定
2.3 真核P39抗原发酵条件的优化
2.3.1 pH值对重组蛋白P39表达量的影响 由图6-A可以看出,蛋白得率随pH的升高先增高后降低,当pH至为6时,蛋白的得率最高,实验表明该重组蛋白在酸性或弱碱性的条件下表达条件较好,所以,最佳的发酵pH 6左右,最高得率为3.86mg/mL。

图6 不同因素对P39蛋白表达量的影响
2.3.2 盐浓度对重组蛋白P39表达量的影响 由图6-B可见,随磷酸钾浓度的升高蛋白得率降低,在磷酸钾浓度为0.05 mol/L时,蛋白得率最高,过高的盐浓度可能会抑制蛋白的表达,所以,最佳的磷酸钾浓度为0.05 mol/L,最高得率为3.64 mg/mL。
2.3.3 甲醇浓度对重组蛋白P39表达量的影响 由图6-C可见,随甲醇诱导浓度的增加蛋白得率先增加后减少,在甲醇浓度1%时,蛋白得率最高,低浓度和高浓度的甲醇对蛋白的表达都有不利影响,最佳的甲醇诱导浓度1%,最高得率为4.96 mg/mL。
2.3.4 诱导时间对重组蛋白P39表达量的影响 由图6-D可见,随诱导时间的增加,蛋白得率出现先增加后下降的趋势,过长时间的诱导不利于目的蛋白的表达,实验表明,诱导72 h的条件下,长时间的诱导可能导致蛋白降解,所以,72 h蛋白得率最高,最高得率为5.05 mg/mL。
2.4 酵母分泌表达的P39蛋白糖基化鉴定
本研究对酵母表达的 P39蛋白和利用PNGaseF糖苷酶酶解的 P39蛋白利用核磁共振氢谱进行了糖基化修饰分析,结果(图7-C)表明,重组蛋白图谱在3.6-3.8 ppm处出现寡糖H信号,说明在纯化后的重组蛋白上存在糖信号,重组后的 P39蛋白在毕赤酵母中发生糖基化修饰。同时利用PNGaseF糖苷酶酶解蛋白N-糖链后的重组 P39蛋白糖信号未消失,P39 蛋白存在潜在的糖基化修饰位点,但酶解后糖信号仍然存在,说明蛋白的糖基化形式不是理论上N-糖修饰类型,毕赤酵母表达系统对蛋白的糖基化修饰主要表现为N-糖修饰和 O-糖修饰两种类型,综合上述结果表明该重组 P39蛋白的糖基化形式可能是O-糖基化修饰[11-12]。

图7 一维核磁共振氢谱(1H NMR)分析蛋白糖基化
2.5 巨噬细胞RAW264.7吞噬荧光蛋白
荧光显微镜观察实验结果显示,两种蛋白在 2 h开始出现荧光,荧光强度随时间呈现增强趋势,真核蛋白出现荧光效果早于原核蛋白,在 6 h时荧光现象明显,PBS空白对照组未见明显荧光细胞。根据图8显示,巨噬细胞吞噬真核蛋白的荧光强度明显优于吞噬原核蛋白。说明糖修饰对巨噬细胞的吞噬作用具有一定的影响,可增强蛋白的免疫原性[13]。
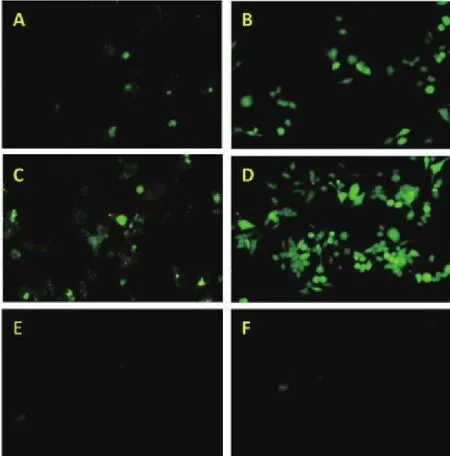
图8 检测巨噬细胞吞噬荧光蛋白情况
3 讨论
布鲁菌进入宿主细胞之后,可被宿主免疫系统分解,同时释放细胞质结合蛋白,这些蛋白质分子继续发挥免疫刺激与侵染的作用[14]。P39蛋白是布鲁菌优势抗原,其蛋白可以有效地诱导机体产生特异性免疫应答,而且P39基因在多个不同种型布鲁菌中高度保守,该成分可以在不同的布鲁菌中形成交叉保护作用,用于制备的新型布病疫苗具有较大优势[15-16]。近年许多研究表明,糖基化对蛋白的结构和活性有很大的影响,消除N-糖基化位点可延长IFN-α/ Fc融合蛋白的半衰期[17],糖链长短的变化及不同糖型的修饰都会影响蛋白的生物活性[18-19],本课题组发现甘露六糖修饰后的布鲁菌 AHCY蛋白的免疫性得到大幅度的提升[20],说明糖修饰会改变蛋白的生物功能,这为开发安全有效的布鲁氏菌亚单位疫苗提供了可能。
本实验中,为获得大量 P39抗原,选择具有分泌优势的毕赤酵母表达系统,并在酵母体内对 P39抗原蛋白进行天然的糖基化修饰。结果发现,糖基化后的 P39蛋白更容易被巨噬细胞捕获,与原核表达的 P39蛋白相比,其结合巨噬细胞的效率更好,也更有可能高效的激活巨噬细胞。重组后的 P39蛋白显示出优于原核 P39蛋白的免疫原性,这可能是由于糖链的存在及其结构引发的改变,在 P39蛋白的理论 N-端糖基化位点并为发生修饰作用,说明糖基化的修饰可能存在随机性,或是由于蛋白空间结构折叠后掩盖其理论的糖基化位点,使其潜在的糖基化位点未进行修饰。随着基因工程的发展,已经实现了在分子水平对酵母糖基化系统进行改造,从而更有利于生产人源糖蛋白药物及亚单位疫苗的开发[21-22]。
4 结论
本研究成功在毕赤酵母中分泌表达 P39抗原,优化发酵条件产量可达 5.05 g/L,通过核磁共振氢谱结果表明 P39抗原发生糖基化修饰,糖基化修饰后的 P39抗原被巨噬细胞捕获的程度明显高于原核蛋白,说明糖基化修饰作用会在一定程度上影响蛋白的免疫原性。