盐酸苄丝肼对脂多糖所致人脐静脉内皮细胞炎症的影响及其机制研究
杨 薇,王绍达,秦淑杰,吴 纲,何书英
(中国药科大学生命科学与技术学院,南京 210009)
动脉粥样硬化(atherosclerosis,AS)是一种严重危害人类健康的心血管常见疾病,可诱发脑血管病、冠心病和血栓栓塞性疾病等缺血性心脑血管病[1]。目前认为,动脉粥样硬化的发生是由于细胞因子和血管细胞间的相互作用,在各种危险因子的作用下,血管内皮细胞损伤致使多种生长调节因子、细胞因子和血管活性物质的表达、激活紊乱[2],并改变平滑肌细胞基因的表达致使其异常增殖,从而引起血管腔狭窄和痉挛,使血管局部产生的一种过度的慢性炎性增生反应。在这个过程中,大量的炎性细胞因子参与其中,对AS的发生和发展起到了至关重要的作用[3],如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、血清样淀粉蛋白P(serum amyloid P,SAP)、单核细胞趋化蛋白1(momocyte chemotacticprotein-1,MCP-1)等。
MAPK和NF-κB信号通路是介导炎症反应相关通路中最常见的两条通路,其关键蛋白被磷酸化激活后可导致通路中的相应蛋白发生核转位,从而调控下游基因的转录活性。在AS病变的早期,NF-κB激活内皮细胞分泌MCP-1和IL-8,介导单核细胞和淋巴细胞向管壁运动,促进炎症的发生和内皮细胞的损伤[4]。由此可见,抑制促炎性细胞因子的合成及其相关信号通路关键蛋白的表达是控制AS的有效手段之一。
盐酸苄丝肼(benserazide hydrochloride)是外周脱羧酶抑制药,与左旋多巴联合应用制成复方制剂多巴丝肼[5],在临床上常用于帕金森病的治疗。本实验室前期动物实验研究表明,盐酸苄丝肼可显著降低ApoE-/-小鼠主动脉根、主动脉弓的动脉斑块面积,并可显著下调与AS相关的炎症因子的表达(结果待发表)。故本研究通过脂多糖(lipopolysaccharides,LPS)诱导人脐静脉内皮细胞建立体外炎症模型,以进一步评估盐酸苄丝肼的体外抗炎活性,并探究盐酸苄丝肼抗动脉粥样硬化的相关机制。
1 材 料
1.1 试 剂
高糖DMEM培养基、胰蛋白酶、青霉素链霉素双抗(美国Gibco公司);胎牛血清(以色列Biological Industries公司);盐酸苄丝肼(美国Alfa Aesar公司,CAS:14919-77-8,AR:98%,批号:C10006404)、LPS(美国Sigma公司);四甲基偶氮唑盐(合肥Biosharp公司);RIPA细胞裂解液、BCA蛋白定量试剂盒(上海碧云天生物技术有限公司);ECL检测液试剂盒(博士德生物工程有限公司);核蛋白和胞浆蛋白提取试剂盒(江苏凯基生物技术股份有限公司);人MCP-1 ELISA检测试剂盒(武汉六合生物技术有限公司);人TNF-α ELISA检测试剂盒(深圳达科为生物技术有限公司);Trizol溶液(美国Invitrogen公司);反转录合成一体试剂盒(5×ALL-In-One RT MasterMix)、快速EvaGreen荧光定量PCR预混试剂盒(EvaGreen 2×qPCR MasterMix)、96孔qPCR板(加拿大ABM公司);PCR引物(通用生物系统有限公司);GAPDH抗体(美国Abways公司);HRP标记山羊抗兔IgG(H+L)(麦约尔生物技术有限公司)。抗SAP抗体、抗IκBα抗体、抗p-IκBα(phospho S36)抗体、抗p38抗体(英国Abcam公司);p-p38 MAPK(Thr180/Tyr182)抗体(美国Affinity Biosciences公司);兔抗NFκB p65抗体、兔抗p-NFκB p65(Thr254)抗体(北京博奥森生物技术有限公司);抗AKT抗体、抗p-AKT(Ser473)抗体(美国CST公司);Lamin b1抗体(美国Signalway抗体公司)。
1.2 仪 器
TGL-20M高速台式冷冻离心机(湖南湘仪实验仪器开发有限公司);Synergy 2型微孔板分析仪(美国Bio-Tek公司);化学发光成像系统、MyCyclerTMThermal Cycler System(美国Bio-Rad公司);480Ⅱ型Real-Time qPCR仪(瑞士Roche公司)。
1.3 细胞株
人脐静脉内皮细胞株(HUVECs)由中国药科大学生命科学与技术学院徐寒梅教授实验室提供。
2 方 法
2.1 药物配制
盐酸苄丝肼性质极不稳定,对光照、温度、溶剂的pH变化很敏感,故本实验采用生理盐水作为溶剂,配制初始浓度为1×10-7moL/L的盐酸苄丝肼溶液,在配药过程中避光处理,并采用0.22 μm微孔滤器对药物进行过滤,于超净台中配制完成后在容器表面包裹锡箔纸并置于4 ℃避光保存。
2.2 细胞培养
采用含有10%胎牛血清(FBS)的高糖DMEM培养基,加入0.5%青霉素链霉素双抗溶液,培养条件:37 ℃、5% CO2的细胞培养箱,传代周期为2~3 d[6]。
2.3 人脐静脉内皮细胞(HUVECs)急性炎症模型的建立
将HUVECs以每孔2×105个细胞的密度接种于无菌6孔板中,待细胞生长至80%细胞密度时,将细胞分为空白组(PBS+0.5% FBS DMEM培养基)和模型组、模型组[LPS(300、500、700、900 μg/mL)+0.5% FBS DMEM培养基],每组设置3个复孔,培养24 h。取上清液,离心,并将离心后的细胞上清液转移到新的EP管中,于-20 ℃冰箱保存,并用试剂盒检测不同实验组中TNF-α水平的变化情况。
2.4 MTT测定盐酸苄丝肼的细胞毒性
将HUVECs按每孔1×103个细胞的密度接种于96孔培养板,培养24 h后,将细胞分为空白组(0.5% FBS DMEM培养基)、给药组(0.5% FBS DMEM培养基+1×10-6、1×10-7、1×10-8、1×10-9、1×10-10、1×10-11、1×10-12mol/L盐酸苄丝肼),每组设置6个复孔。孵育24 h后,每孔加入5 mg/mL MTT溶液20 μL,37 ℃孵育4 h后,弃去细胞培养液,每孔加入DMSO 150 μL,溶解结晶,于水平摇床振荡混匀10 min后于490 nm处测定各孔吸收度。
2.5 Western blot和ELISA测定HUVECs细胞中相关炎症因子的表达水平
将HUVECs以每孔2×105个细胞的密度接种于无菌6孔板中,待细胞生长至80%细胞密度时,将细胞分为空白组(PBS+0.5% FBS DMEM培养基)、模型组[LPS(500 μg/mL)+0.5% FBS DMEM培养基],给药组[LPS(500 μg/mL)+盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)+0.5% FBS DMEM培养基],每组设置3个复孔,培养24 h。取上清液,离心,并将离心后的细胞上清液转移到新的EP管中,于-20 ℃冰箱保存,并用试剂盒检测不同实验组中TNF-α和MCP-1水平的变化情况。余下的各组细胞用胰酶消化后,4 ℃离心收集细胞沉淀,用RIPA裂解液裂解细胞提取蛋白,并用Western blot测定不同实验组中SAP蛋白的表达水平。
2.6 qPCR测定HUVECs细胞中相关炎症因子mRNA的表达水平
将HUVECs以每孔2×105个细胞的密度接种于无菌6孔板中,细胞培养和分组同“2.5”项,每组设置3个复孔。培养24 h后,取出孔板,弃去上清液,用冷0.01 mol/L PBS洗涤2遍,每管加入Trizol 1 mL,混匀,静置10 min后,加入氯仿200 μL,剧烈混匀15 s,室温静置5 min。4 ℃,12 000 r/min离心15 min。取上层水相(约500 μL)置于另一EP管中,加异丙醇500 μL,混匀,-20 ℃放置30 min。4 ℃,12 000 r/min离心15 min。弃去上清液,加入预冷75%乙醇(DEPC水配制)1 mL,4 ℃,12 000 r/min离心10 min。弃去上清液,置于超净台室温干燥3 min,待乙醇挥发后加入DEPC水20 μL溶解RNA,用Synergy 2型微孔板分析仪测定RNA浓度,按照反转录合成一体试剂盒说明书将各组分RNA反转录成cDNA,保存于-20 ℃。快速EvaGreen荧光定量PCR预混试剂盒说明书,在96孔qPCR板中依次加入各试剂,每组设置4个复孔,使用Real-Time qPCR仪检测,反应条件设置为:95 ℃、10 min(预变性);95 ℃、15 s(变性);60 ℃、60 s(退火/延伸);扩增40个循环。得出各组分的Ct,采用2-ΔΔCt法计算。
2.7 Western blot测定HUVECs细胞信号通路中关键蛋白的表达水平
将HUVECs以每孔2×105个细胞的密度接种于无菌6孔板中,细胞培养和分组同上,每组设置3个复孔。培养24 h后,取出孔板,弃去上清液,用冷0.01 mol/L PBS洗涤2遍,胰酶消化后4 ℃离心收集细胞沉淀,再用冷0.01 mol/L PBS洗涤沉淀2遍,每管加入RIPA裂解液(含广谱蛋白酶抑制剂和磷酸酶抑制剂)150 μL于冰上裂解细胞30 min,4 ℃离心,将上清液转移到新的EP管中,即为细胞总蛋白,BCA法测定蛋白浓度并定量,经10%或12% SDS-PAGE电泳分离蛋白,半干转法将蛋白电转移到PVDF膜上,室温下5%脱脂奶粉封闭膜2 h,与GAPDH、IκBα、p-IκBα(phospho S36)、p38、p-p38 MAPK(Thr180/Tyr182)、NFκB p65、p-NFκB p65(Thr254)、AKT、p-AKT抗体湿盒内4 ℃孵育过夜。第2天,室温下TBST洗涤(10 min×4),室温山羊抗兔二抗避光孵育1.5 h,TBST洗涤(10 min×3),ECL化学发光法显影,Bio-Rad成像系统拍照,并用Image-J进行条带灰度分析。
2.8 核蛋白和胞浆蛋白提取
细胞处理及分组同上,培养24 h后,取出孔板,弃去上清液,用冷0.01 mol/L PBS洗涤2遍,胰酶消化后4 ℃,1 500 r/min离心3 min收集细胞沉淀,再用冷0.01 mol/L PBS洗涤沉淀2遍;用移液枪尽可能弃去上清液,勿留残液,估计细胞压积(离心后的紧实细胞体积,约50~100 μL),使用试剂盒提取核蛋白以及胞浆蛋白,BCA蛋白定量后分装并保存于-80 ℃,避免反复冻融。
2.9 统计学分析

3 结 果
3.1 LPS诱导HUVECs炎症模型的建立
为了确定构建HUVECs炎症模型所需的LPS剂量,将细胞分为空白组和模型组(分别加入300、500、700、900 μg/mL LPS),共同孵育24 h后吸取细胞上清液,通过ELISA法检测细胞上清液中TNF-α水平的变化。如图1所示,与空白组相比,当LPS质量浓度在300~500 μg/mL之间时,TNF-α的表达量随着LPS质量浓度的升高而升高,当LPS质量浓度在500~900 μg/mL之间时,TNF-α的表达量随着LPS浓度的升高反而出现下降的趋势。综合数据分析结果,与空白组相比,所有加入LPS的模型组均能刺激细胞分泌更多的TNF-α,当LPS质量浓度为500 μg/mL时,细胞分泌的TNF-α最多,且与空白组相比有显著性差异(P<0.05),因此,最终选用500 μg/mL的LPS为本实验后续造模浓度。
3.2 不同浓度盐酸苄丝肼对HUVECs的细胞毒性
不同浓度盐酸苄丝肼(1×10-6、1×10-7、1×10-8、1×10-9、1×10-10、1×10-11、1×10-12mol/L)作用HUVECs 24 h后,结果如图2所示,盐酸苄丝肼浓度为1×10-7mol/L组与空白组相比有显著性差异(P<0.05),而1×10-12mol/L组有极显著性差异(P<0.01),除此之外,其余浓度对HUVECs 的生长均没有显著影响,因此结合数据分析结果所呈现的不同浓度盐酸苄丝肼对HUVECs生长影响的稳定性,选用1×10-9、1×10-10、1×10-11mol/L 3个浓度作为后续实验的盐酸苄丝肼给药浓度。

*P<0.05vsmodel group (LPS-treated group)


*P<0.05,**P<0.01vscontrol group
3.3 盐酸苄丝肼对LPS诱导的HUVECs细胞中SAP、TNF-α和MCP-1的蛋白和mRNA表达的影响
在LPS(500 μg/mL)/LPS+盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)作用HUVECs 24 h后,取细胞上清液,用ELISA检测TNF-α和MCP-1的表达水平,余下的细胞提取总蛋白后用Western blot检测SAP的表达水平,同时,用Trizol试剂提取细胞RNA,通过qPCR检测细胞SAP、TNF-α和MCP-1 mRNA的表达水平。如图3-A所示,与空白组相比,模型组的SAP、TNF-α、MCP-1的表达水平显著升高(P<0.01);而与模型组相比,给药组使SAP、TNF-α、MCP-1的表达水平均出现下降的趋势。当盐酸苄丝肼浓度为1×10-9mol/L时,与模型组相比,SAP、TNF-α减少的量最多且有极显著性差异(P<0.01),MCP-1则无明显差异;当盐酸苄丝肼浓度为1×10-10mol/L时,与模型组相比,SAP(P<0.01)、TNF-α(P<0.05)和MCP-1(P<0.05)均具有显著性差异;当盐酸苄丝肼浓度为1×10-11mol/L时,与模型组相比,仅有MCP-1出现极显著性差异(P<0.01),而SAP和TNF-α则无明显差异。与此同时,盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)对于SAP和TNF-α表达的抑制作用具有相似的浓度依赖性。如图3-B所示,模型组的SAP(P<0.001)、TNF-α(P<0.05)和MCP-1(P<0.001)mRNA的表达量相较于空白组均出现了明显的升高趋势,且具有显著性差异;加入盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)作用后均使SAP、TNF-α和MCP-1 mRNA的表达量明显下降,且与模型组相比具有极显著性差异(P<0.001)。除TNF-α外,给药组SAP和MCP-1 mRNA的下降趋势与其蛋白下降趋势相似。图3的结果表明,盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)能下调 SAP、TNF-α和MCP-1蛋白及mRNA的表达。


A:Protein level of SAP,TNF-α and MCP-1 in different groups measured by Western blot and ELISA;B:mRNA level of SAP,TNF-α and MCP-1 in different groups measured by qPCR
#P<0.05,##P<0.01,###P<0.001vscontrol group;*P<0.05,**P<0.01,***P<0.001vsmodel group(LPS-treated group)
3.4 盐酸苄丝肼对LPS诱导的HUVECs细胞信号通路中关键蛋白表达的影响
如图4所示,在LPS的刺激下,除了IκBα(如图4-C),p65、p38、AKT及其磷酸化蛋白p-p65、p-p38、p-AKT和p-IκBα的表达量有了明显的上升趋势,且均具有显著性差异(P<0.01/P<0.001/P<0.05)。在不同浓度的盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)作用下,p65/p-p65、IκBα/p-IκBα、AKT/p-AKT和p-p38表达水平都受到了不同程度的抑制,且均具有显著性差异(P<0.01/P<0.001/P<0.05)。当盐酸苄丝肼浓度为1×10-11mol/L时,相较于模型组,虽然对p38的表达有抑制作用而无显著性差异,但盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)的这种抑制作用表现出了浓度依赖性(如图4-B)。除此之外,盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)对p-p65和AKT的表达也表现出了浓度依赖性的抑制作用(如图4-A、D)。信号通路关键蛋白的磷酸化水平在一定程度上可以反映出该条通路的激活程度以及信号转导的情况,图4所有数据表明,盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)在抑制非磷酸化蛋白p65、p38、IκBα和AKT的表达的同时也能显著抑制其对应的磷酸化蛋白p-p65、p-p38、p-IκBα和p-AKT的表达,说明盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)能抑制AKT/NF-κB通路及p38 MAPK部分通路的激活。


A:Protein level of p65 and p-p65;B:Protein level of p38 and p-p38;C:Protein level of IκBα and p-IκBα;D:Protein level of AKT and p-AKT
#P<0.05,##P<0.01,###P<0.001vscontrol group;*P<0.05,**P<0.01,***P<0.001vsmodel group(LPS-treated group)
3.5 盐酸苄丝肼对LPS诱导的HUVECs细胞信号通路中p65、p38和IκBα核转位的影响
在LPS(500 μg/mL)/LPS+盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)作用HUVECs 24 h后,用核蛋白和胞浆蛋白提取试剂盒分别提取不同实验组的核蛋白及其对应的胞浆蛋白,BCA定量后用Western blot检测细胞核内和胞浆内p65、p38以及IκBα的分布情况。如图5所示,正常情况下,p65、p38及IκBα主要存在于细胞质中;在LPS的刺激下,细胞迅速做出应答,这些因子被迅速激活并转位入核,从而激活与该信号通路相关的基因的大量表达,但加入盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)后,p65、p38及IκBα入核显著减少,且与模型组相比具有极显著性差异(P<0.01/P<0.001,图5-A),由此说明,盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)能明显抑制 p65、p38及IκBα的核转位。
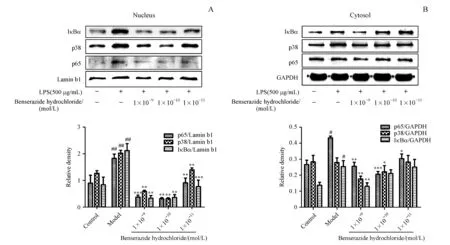
A:Distribution of p65,p38 and IκBα in nucleus;B:Distribution of p65,p38 and IκBα in cytoplasm
#P<0.05,##P<0.01,###P<0.001vscontrol group;*P<0.05,**P<0.01,***P<0.001vsmodel group (LPS-treated group)
4 讨 论
LPS是革兰阴性菌细胞壁的主要组成成分之一,当它进入机体时,会诱导免疫细胞的激活,导致促炎性细胞因子的释放,是诱发炎症反应的最主要的病原分子之一[7]。本实验室前期动物实验研究已经表明,盐酸苄丝肼可显著降低ApoE-/-小鼠主动脉根、主动脉弓的动脉斑块面积,肝脏SAP的表达及其在动脉内膜上的沉积,并可显著下调相关炎症因子的表达,初步显示出盐酸苄丝肼具有良好的抗动脉粥样硬化的潜力(结果待发表)。在此基础上,本研究采用LPS刺激人脐静脉内皮细胞建立体外炎症模型,以进一步评估盐酸苄丝肼的体外抗炎活性,并探索其发挥作用的潜在机制。
炎症贯穿于AS发生和发展的整个过程,在这个过程中,血管内皮细胞、平滑肌细胞以及巨噬细胞都会持续分泌大量的促炎性细胞因子,加重受损部位的炎症反应从而加速AS的发展进程,因此检测药物作用后炎症因子的表达水平变化对评估其抗炎活性有一定意义。综合Western blot、ELISA以及qPCR的检测结果,可以看出,正常的HUVECs细胞只分泌少量的炎症因子,但在LPS的刺激下SAP、TNF-α和MCP-1的表达量迅速上升,而不同浓度盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)对SAP、TNF-α和MCP-1的蛋白及mRNA的表达水平均具有显著抑制作用,说明盐酸苄丝肼具有良好的体外抗炎活性。
MAPK和NF-κB信号通路是炎症及炎症相关疾病(如动脉粥样硬化)中发挥主要作用的两条信号通路,已得到广泛研究。EI Bekay等[8]的研究发现,p38 MAPK被激活后,可通过磷酸化或促炎细胞因子(如TNF-α、ICAM-1)而活化NF-κB。同样NF-κB被激活后,也可能通过其促炎细胞因子产物反过来激活p38 MAPK,NF-κB与p38 MAPK之间形成的相互激活网络可以调控多种炎症介质的基因转录活性,促进AS的发展进程[9]。因此,本实验在探索盐酸苄丝肼抗炎抗动脉粥样硬化的分子机制时,首先针对p38 MAPK和NF-κB这两条信号通路进行研究。综合Western blot测定的盐酸苄丝肼对LPS诱导的HUVECs细胞信号通路中关键蛋白表达的影响的所有结果,可以看出,盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)对p65、p38、IκBα和AKT的非磷酸化蛋白水平及其对应的磷酸化蛋白水平(即p-p65、p-p38、p-IκBα和p-AKT)均具有明显的抑制作用,说明盐酸苄丝肼能抑制AKT/NF-κB通路及p38 MAPK部分通路的激活。
信号通路被逐级激活后,通常会促使该通路中的蛋白发生核转位,从而调控该通路下游蛋白的基因的转录活性。Western blot检测到的细胞核内以及胞浆内p65、p38和IκBα的分布情况显示,细胞在正常状态下核内仅分布极少量的p65、p38和IκBα,但在LPS的刺激下,这些因子被迅速激活并转位进入细胞核中,而盐酸苄丝肼(1×10-9、1×10-10、1×10-11mol/L)能显著抑制p65、p38、IκBα的核转位。
综上所述,盐酸苄丝肼可能通过抑制AKT/NF-κB通路及p38 MAPK部分通路的激活和核转位来抑制由其介导的LPS所致HUVECs细胞中相关促炎性细胞因子的表达,从而起到抗动脉粥样硬化的作用。

