评价国产利福平胶囊与参比制剂体外溶出一致性研究
张锦琳,袁耀佐*,张 娅,赵述强,赵 恂,张 玫
(1江苏省食品药品监督检验研究院,南京 210019;2中国药科大学药物化学教研室,南京 210009)
利福平(rifampicin)为半合成广谱抗生素类药物,已列入我国《国家基本药物目录》。该药口服吸收良好,属于BCSⅡ类的药物,是WHO推荐的一线抗结核药[1]。目前《中华人民共和国药典》2015版(简称ChP2015)、《美国药典》第40版(简称USP40)、《英国药典》2015(简称BP2015)、《日本药典》第17版(简称JP17)、《欧洲药典》9.0版(简称EP9.0)等[2-6]均收载该品种。1967年,利福平胶囊由赛诺菲公司在意大利首先生产并上市,1974年底,国内多个企业先后仿制并投入生产。我国拟定了一系列仿制药一致性评价研究计划,努力使仿制药质量与原研药一致[7],为了考察国产利福平仿制药质量与原研制剂在质量上是否一致,本研究以日本第一三共株式会社与美国赛诺菲-安万特公司生产的利福平胶囊为参比制剂(原国家食品药品监督管理总局公布的第7批参比制剂为美国橙皮书收载的赛诺菲-安万特的产品),对国产利福平胶囊与参比制剂的含量及有关物质进行考察,同时采用溶出度试验对两者的体外溶出行为一致性进行评价。
1 材 料
1.1 药品与试剂
利福平对照品(中国生物制品检定研究院,批号:130496-201403);利福平胶囊[第一三共株式会社,批号:HQB0191(0.15 g)和HQA0192(0.15 g);赛诺菲-安万特公司,批号:3130153(0.15 g)和3130149(0.3 g),两家产品原料均为利福平Ⅱ型;A公司,批号:150501;B公司,批号:150303;C公司,批号:150502;D公司,批号:1505161;E公司,批号:S150604;A、B、C、D、E公司产品均为0.15 g,且原料均为利福平Ⅰ型];纯化水(美国Millipore公司);甲醇、乙腈为色谱纯;混合纤维素滤膜(0.45 μm,上海摩速科学器材有限公司);超高相对分子质量聚四氟乙烯滤膜(10 μm,德国ProSense公司);其余试剂均为市售分析纯。
1.2 仪 器
HPLC色谱仪、UV-2550紫外分光光度计(日本岛津公司);708-DS溶出仪(美国Agilent公司);AT7smart溶出仪(瑞士Sotax公司)。
2 方法与结果
2.1 含量测定与有关物质检查
比较了USP40[3]、JP17[5]和ChP2015[2]中利福平胶囊含量测定与有关物质检查方法及限度可知,USP40和JP17的色谱条件基本一致,但与ChP2015的色谱条件差别较大,而ChP2015的限度较为严格。综合3个国家药典的限度,拟定了最严格的限度作为标准。参照ChP2015的色谱条件,取第一三共株式会社、赛诺菲-安万特公司及另5个国内厂家的利福平胶囊进行测定,结果见表1。含量和有关物质测定结果均符合质量标准的规定,但国产制剂的杂质特别是醌式利福平的含量远小于进口制剂,其他单个杂质和其他各杂质总和与进口制剂相当。
Table1 Content and related substances of 9 batch rifampicin capsules (n=2)
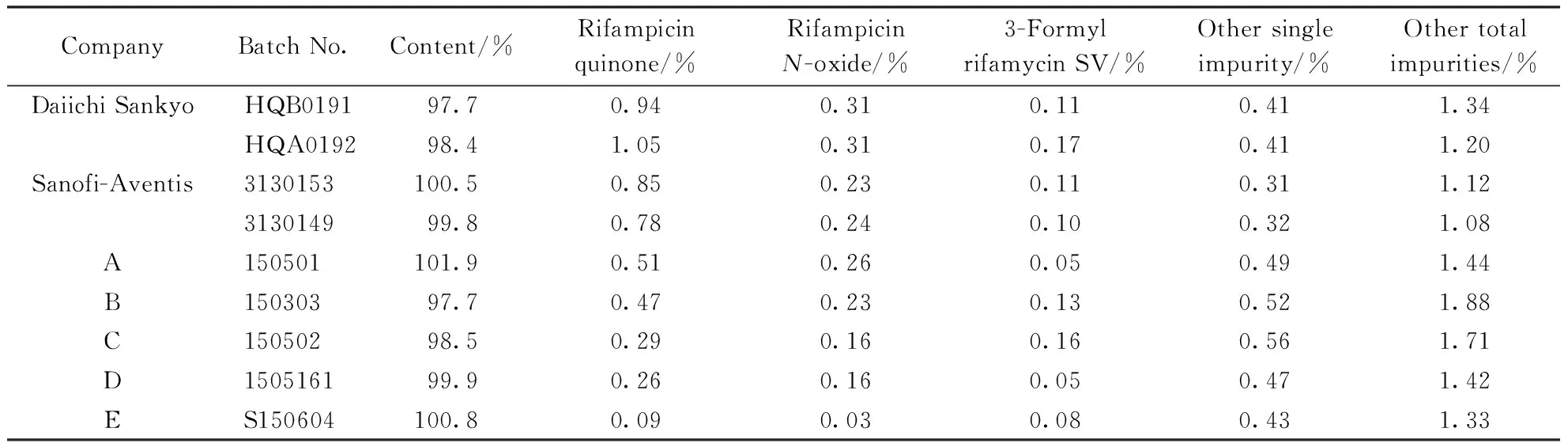
CompanyBatch No.Content/%Rifampicin quinone/%RifampicinN-oxide/%3-Formyl rifamycin SV/%Other single impurity/%Other total impurities/%Daiichi SankyoHQB019197.70.940.310.110.411.34HQA019298.41.050.310.170.411.20Sanofi-Aventis3130153100.50.850.230.110.311.12313014999.80.780.240.100.321.08A150501101.90.510.260.050.491.44B15030397.70.470.230.130.521.88C15050298.50.290.160.160.561.71D150516199.90.260.160.050.471.42ES150604100.80.090.030.080.431.33
2.2 溶出试验预试方案的建立
通过对比日本《医疗用医药品质量情报集》(简称日本橙皮书)和美国FDA溶出数据库中的方法,对溶出装置、溶出介质、溶出转速、取样方式、不同品牌溶出仪等进行了考察,建立了以桨法加沉降篮为溶出装置,以pH 1.2盐酸溶液、pH 4.0磷酸盐缓冲液、pH 6.8磷酸盐缓冲液和纯水为溶出介质(日本橙皮书的介质配制方法),以75 r/min为转速,自动取样的溶出试验方案。
2.2.1 溶出装置的选择 根据各国药典以及日本橙皮书和美国FDA溶出数据库中的方法可知既有选择篮法的,也有选择桨法的,日本橙皮书中明确规定桨法使用沉降篮,因此以D公司(批号:1505161)的样品,在pH 4.0磷酸盐缓冲液中对这3种溶出装置分别进行了比较,结果见表2。
Table2 Dissolution of rifampicin capsules with different apparatus (n=6)
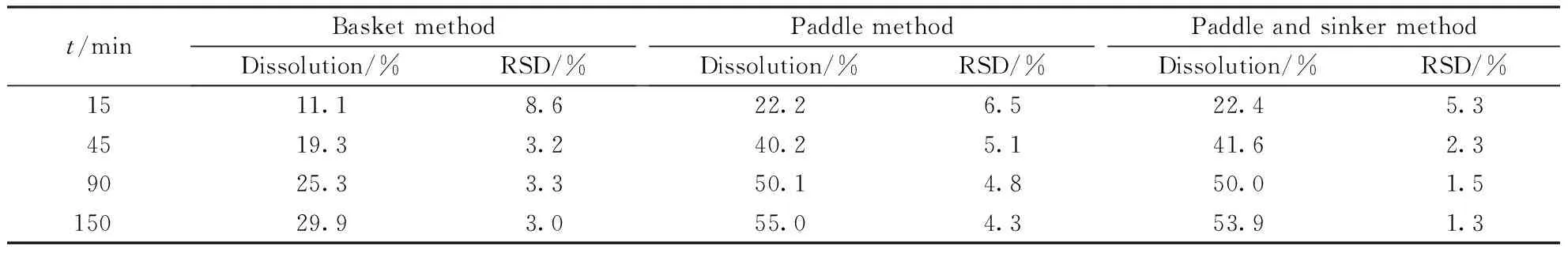
t/minBasket methodDissolution/%RSD/%Paddle method Dissolution/%RSD/%Paddle and sinker methodDissolution/%RSD/%1511.18.622.26.522.45.34519.33.240.25.141.62.39025.33.350.14.850.01.515029.93.055.04.353.91.3
上述结果表明,利福平胶囊在转篮中的释放速率和溶出量均远小于桨法,而桨法和桨法加沉降篮两种装置之间的区别不大,但桨法加沉降篮的稳定性更好,不容易受到胶囊投药位置等外界因素的影响,因此最终选择了桨法加沉降篮的溶出装置。pH 4.0磷酸盐缓冲液是在所选4种溶出介质中释放最慢的,因此选择该介质作为溶出装置的考察介质。
2.2.2 溶出介质的选择 采用了利福平胶囊在日本橙皮书中使用的4种溶出介质,分别是pH 1.2盐酸溶液、pH 4.0磷酸盐缓冲液、pH 6.8磷酸盐缓冲液和纯水,这4种溶出介质具有较强区分能力。
2.2.3 溶出转速的选择 根据各国药典、日本橙皮书和美国FDA溶出数据库中的方法比较可知,50、75、100均有使用,因此以C公司(批号:150502)为样品,在pH 4.0磷酸盐缓冲液中对3种转速进行了比较,结果见表3。
Table3 Dissolution of rifampicin capsules with different agitation speeds (n=6)
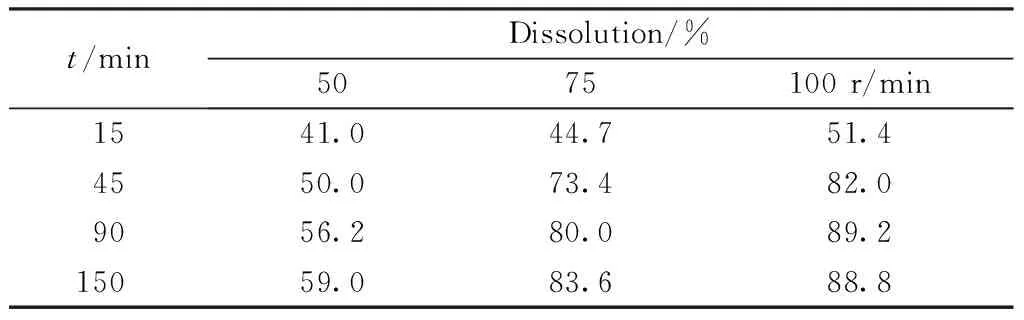
t/minDissolution/%5075 100 r/min1541.044.751.44550.073.482.09056.280.089.215059.083.688.8
上述结果表明,75 r/min较50 r/min溶出量和溶出速率明显增多变快,而100 r/min较75 r/min溶出量和溶出速率略有增多。由于桨法一般采用的转速为50~75 r/min,因此最终选择了转速为75 r/min。
2.2.4 取样方式的选择 为了考察不同材质滤膜和溶出仪系统对样品是否会有吸附,研究了在Sotax公司溶出仪上分别以D公司(批号:1505161)(n=6)为样品,在pH 4.0磷酸盐缓冲液中,分别考察手动取样和自动取样的区别,结果见表4。
2.3 溶出度方法学验证及溶出曲线测定基本方案的确立
对“2.2”项中建立的溶出度试验方法,进行专属性、线性范围、回收率、稳定性、重复性等方法学验证,并最终确立了本次溶出曲线测定的基本方案:溶出装置为桨法加沉降篮;溶出介质为pH 1.2盐酸溶液、pH 4.0磷酸盐缓冲液、pH 6.8磷酸盐缓冲液和纯水;介质体积900 mL、转速为75 r/min;取样方式为自动取样;检测波长为333 nm;在pH 1.2盐酸溶液中取样时间点(min)为5、10、15、20、30、45、60;在pH 4.0磷酸盐缓冲液中取样时间点(min)为:10、20、30、45、60、120、180、240、300、360;在纯水中取样时间点(min)为10、20、30、45、60、120、180、240、300、360;在pH 6.8磷酸盐缓冲液中取样时间点(min)为:5、10、15、20、30、45、60、90、120。
Table4 Dissolution of rifampicin capsules with different sampling method (n=6)
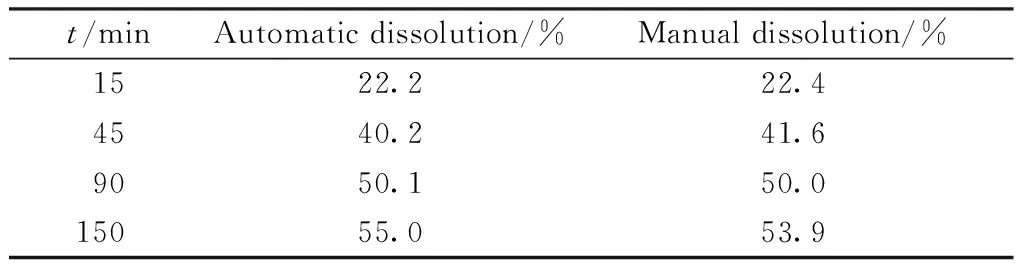
t/minAutomatic dissolution/%Manual dissolution/%1522.222.44540.241.69050.150.015055.053.9
2.3.1 专属性试验 分别用选取的4种介质及4种介质制成的供试品溶液在300~500 nm波长范围进行扫描,结果显示在pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和纯水中333 nm和473 nm均为最大吸收波长和次大吸收波长,在pH 1.2盐酸溶液中336 nm和471 nm分别为最大吸收波长和次大吸收波长,各空白介质和空白辅料在该区间扫描谱图显示300~500 nm的范围内,无干扰吸收。
2.3.2 线性范围 经回归分析333 nm波长时在0.003 36~0.042 04 mg/mL的范围内有良好的线性关系,pH 1.2盐酸溶液中回归方程为:y=26.767 0x-0.009 4,r=0.999 4;pH 4.0磷酸盐缓冲液中回归方程为:y=30.451 1x-0.014 9,r=0.999 9;pH 6.8磷酸盐缓冲液中回归方程为:y=31.645 1x+0.004 6,r=0.999 9;纯水中回归方程为:y=32.018 7x-0.002 1,r=0.999 9。
2.3.3 回收率试验 精密称取利福平对照品适量(按最大溶出量的50%、80%、100%加入),按规定为150 mg处方比例加入相应的混合辅料,置100 mL量瓶中,乙腈溶解定容,滤过,取续滤液3 mL,置200 mL量瓶中,分别加pH 1.2盐酸溶液、pH 4.0磷酸盐缓冲液、pH 6.8磷酸盐缓冲液、纯水稀释至刻度,在333 nm测定吸收度,计算回收率,每个浓度各制备3份。结果pH 1.2盐酸溶液、pH 4.0磷酸盐缓冲液、pH 6.8磷酸盐缓冲液和纯水中的回收率(%)分别为97.8、102.2、102.4和98.3,RSD(%)分别为1.0、0.8、0.5和1.2。
2.3.4 溶液稳定性试验 取上述4种介质配制的供试品溶液,分别于不同时间点测定吸收度,计算含量结果。在4种介质中,稳定性由大到小依次为pH 6.8磷酸盐缓冲液、纯水(pH 6.1)、pH 4.0磷酸盐缓冲液≈pH 1.2盐酸溶液,从稳定性数据来看,在pH 1.2盐酸溶液中质中取样时间不建议超过1 h,在pH 4.0磷酸盐缓冲液中取样时间不建议超过2 h。
2.3.5 重复性试验 称取利福平胶囊粉末,分别采用上述4种溶出介质,各自配制6份样品,在333 nm测定6份样品的含量,RSD为1.2%,结果可知该测定方法的重复性良好。
2.3.6 不同品牌溶出仪对溶出度结果的影响 分别选用Agient公司和Sotax公司的溶出仪,取第一三共株式会社(批号HQB0191)的样品,分别以pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和纯水作为溶出介质,依法测定各时间点下平均累积溶出度,每种介质中测试6片。结果表明,两种品牌仪器的测定结果基本一致(结果略)。
2.4 国产利福平胶囊与参比制剂溶出曲线的考察
2.4.1 第一三共株式会社参比制剂的考察 取批号为HQB0191和HQA0192的样品,按“2.3”项方法进行试验,计算平均累计溶出度及RSD,见图1和图2,并比较两批号之间的相似性。结果显示,产品批内均一性良好,样品在各溶出介质中,除了第1个取样点的RSD较大以外(10%~15%),其余取样点的RSD均小于5%。在pH 1.2盐酸溶液中15 min内累积溶出量均大于85%,在其余3种介质中采用f2因子法对2批样品的溶出曲线进行比较,结果表明,第一三共株式会社的2批利福平胶囊在不同的溶出介质中的溶出曲线的f2因子均大于50。两批产品间溶出曲线相似,可知,第一三共株式会社产品的批间稳定性基本可行。
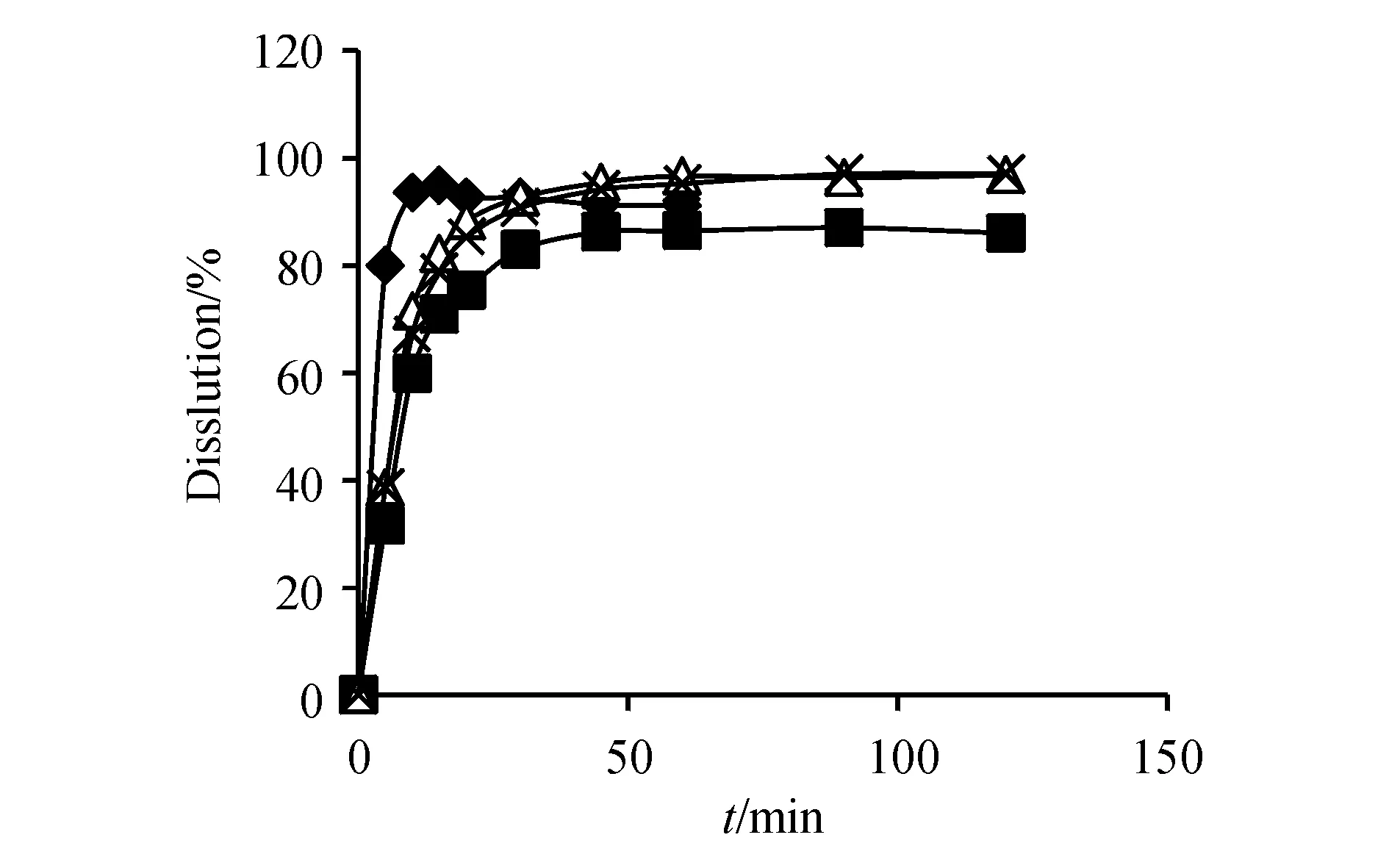
Figure1 Dissolution curves of rifampicin capsules(Batch No.HQA0191)(n=12)
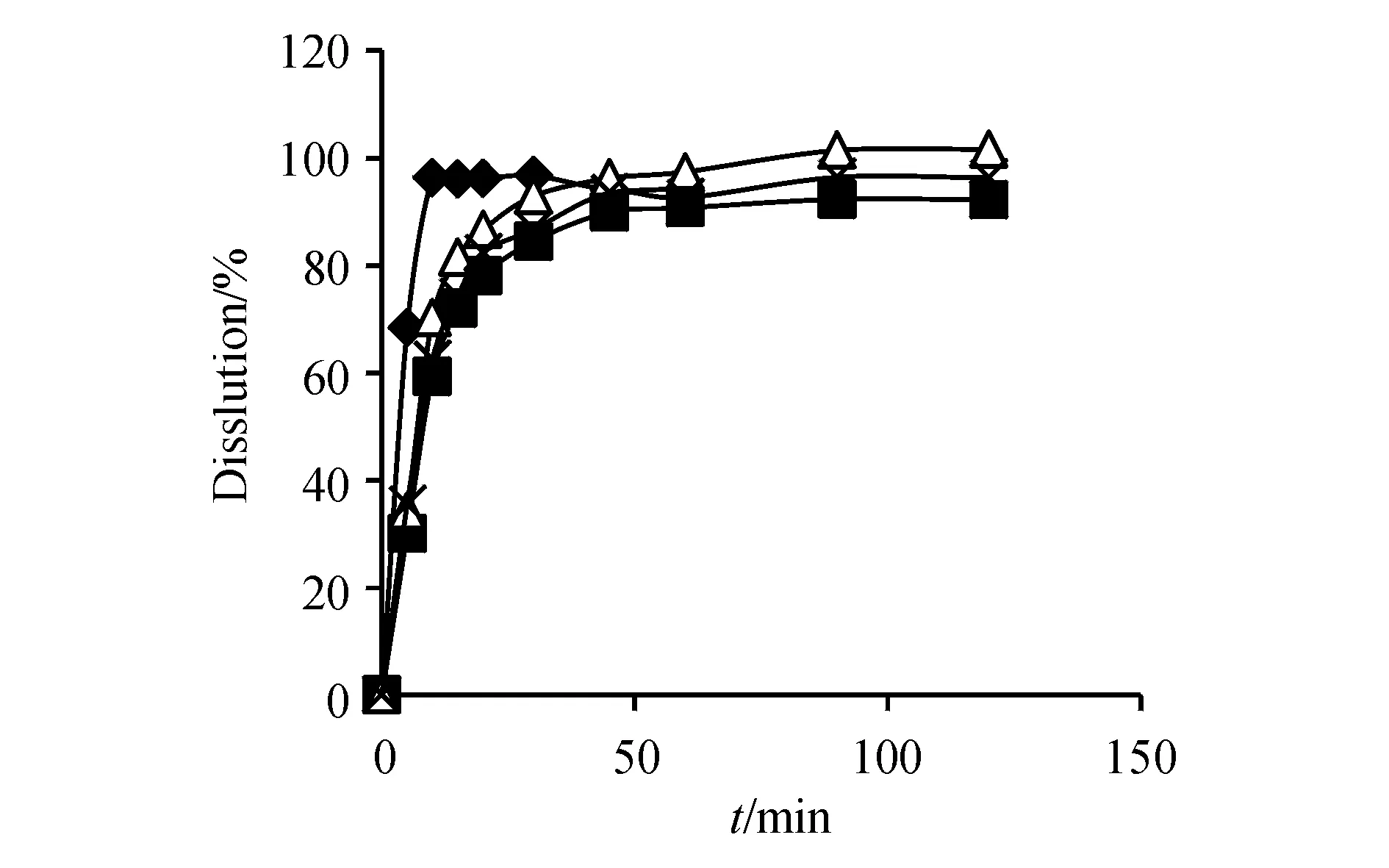
Figure2 Dissolution curves of rifampicin capsules(Batch No.HQA0192)(n=6)
2.4.2 赛诺菲-安万特公司参比制剂的考察 取批号为3130153(150 mg)和批号为3130149(300 mg)赛诺菲-安万特的样品,按“2.3”项方法进行试验,计算平均累计溶出度及RSD,结果见图3和图4。结果显示赛诺菲-安万特的产品批内均一性相比第一三共株式会社略差,尤其是300 mg规格的产品,在纯水和pH 4.0磷酸盐缓冲液两种较难溶解的介质中的RSD较大,且溶出速率较150 mg规格慢。
2.4.3 国产利福平胶囊与参比制剂溶出曲线一致性的比较 取A、B、C、D、E公司共征集到的5批国产利福平胶囊样品按“2.3”项的方法进行试验,计算各时间点的累积溶出度,溶出曲线见图5~9。并比较其与“2.4.1”项和“2.4.2”项中参比制剂的相似性,结果见表6和表7。结果显示,第一三共株式会社的产品(HQB0191)与赛诺菲-安万特的产品(3130153)的溶出行为不相似,国产利福平胶囊与两家进口制剂的溶出行为也均不相似。
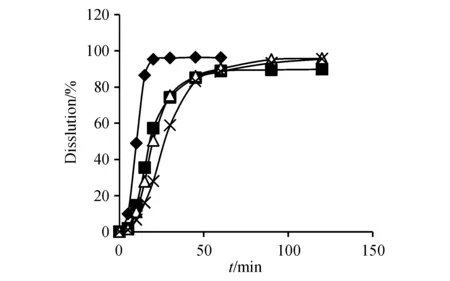
Figure3 Dissolution curves of rifampicin capsules (Batch No.3130153)(n=6)
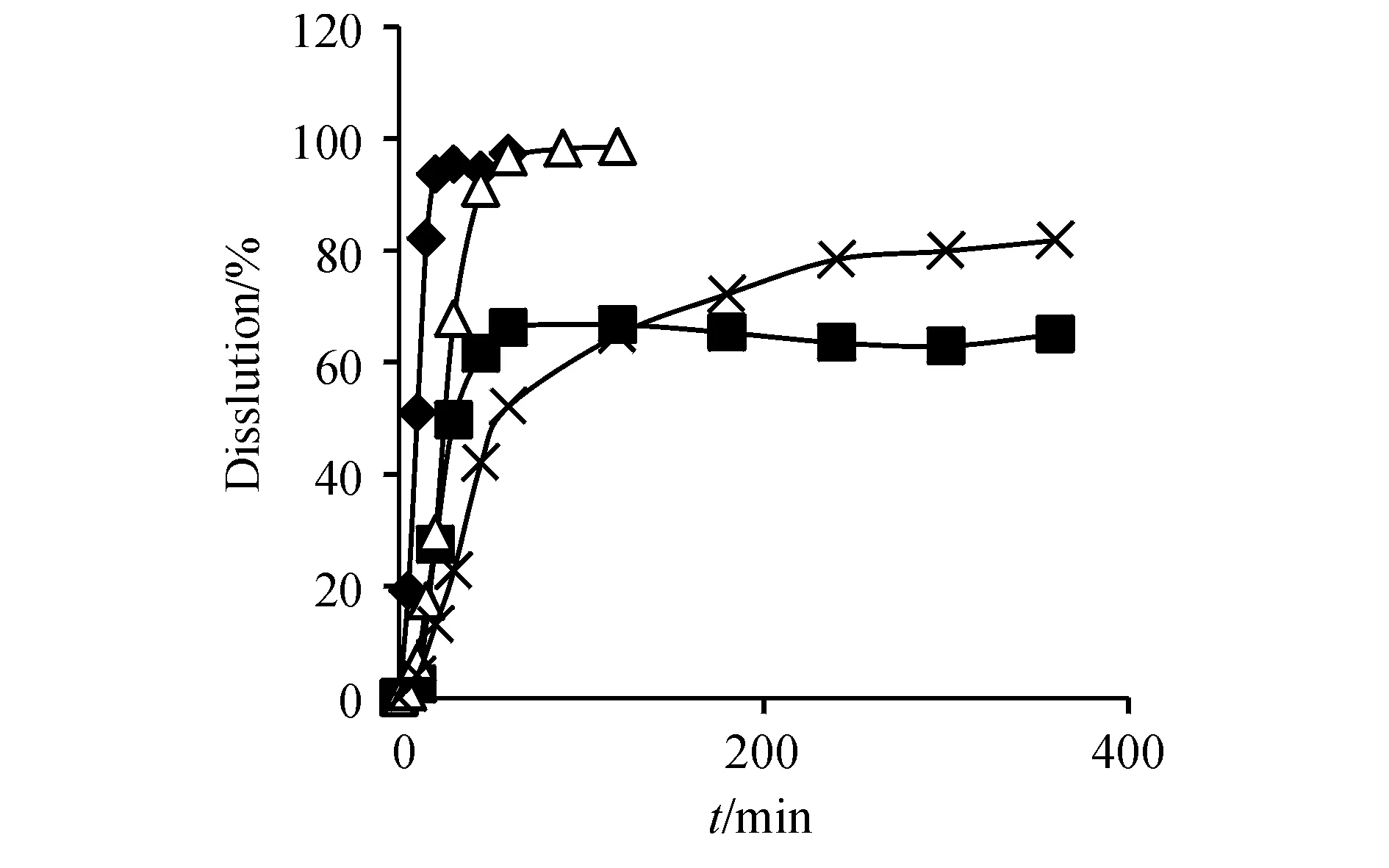
Figure4 Dissolution curves of rifampicin capsules (Batch No.3130149)(n=6)
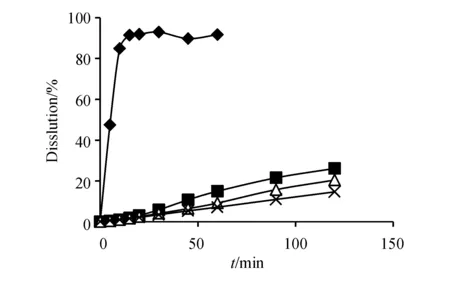
Figure5 Dissolution curves of rifampicin capsules (Company A)in four mediums (n=6)
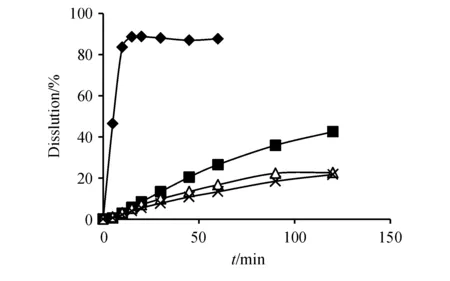
Figure6 Dissolution curves of rifampicin capsules (Company B)in four mediums (n=6)

Figure7 Dissolution curves of rifampicin capsules (Company C) in four mediums (n=6)

Figure8 Dissolution curves of rifampicin capsules (Company D) in four mediums (n=6)
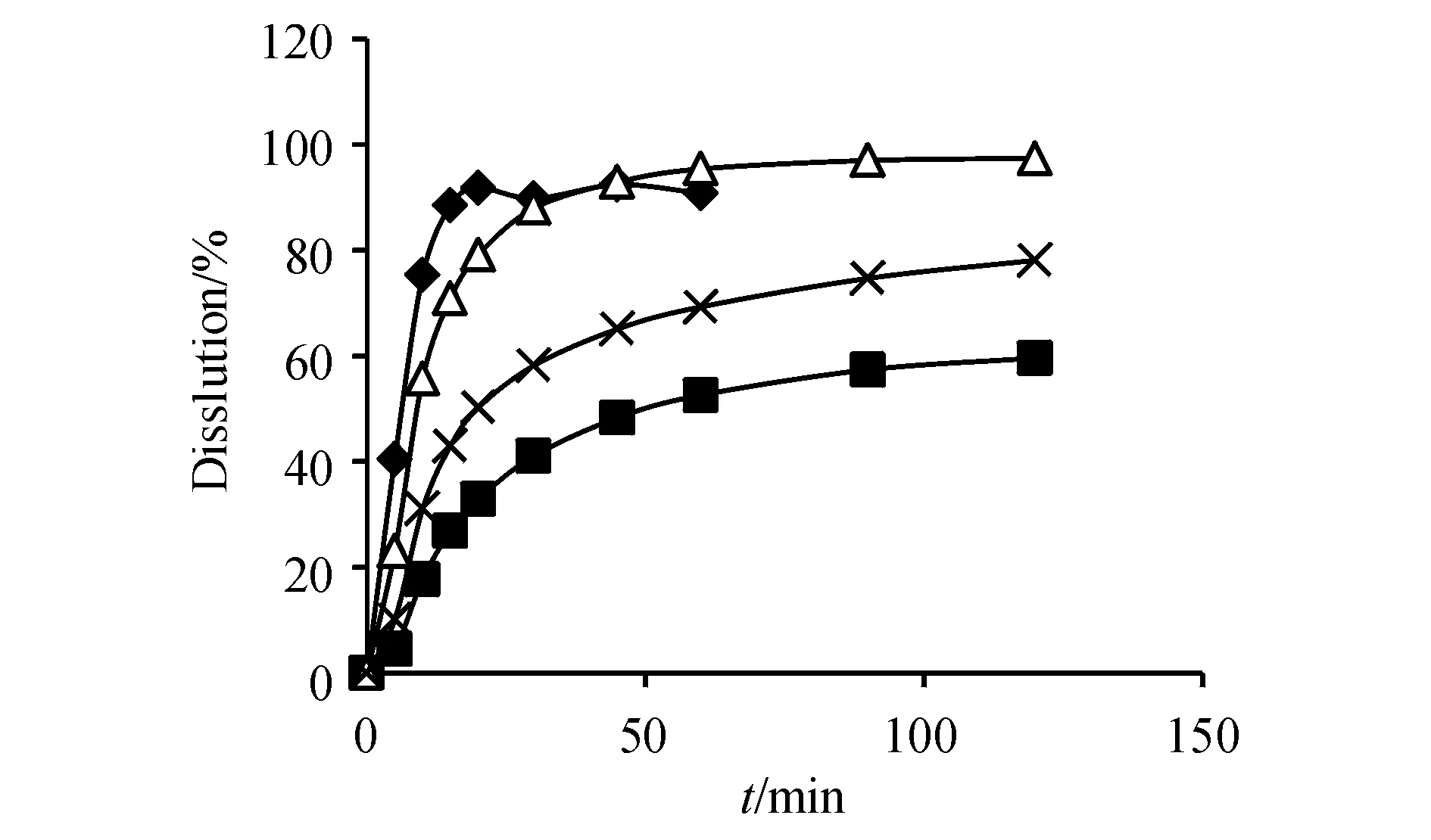
Figure9 Dissolution curves of rifampicin capsules(Company E) in four mediums (n=6)
2.5 利福平不同晶型制剂溶出曲线的差异
作为参比制剂的两家国外利福平胶囊的原料晶型均为Ⅱ型,国产利福平胶囊的原料晶型均为Ⅰ型,委托上海复星星泰医药科技有限公司分别以利福平Ⅰ型和Ⅱ型原料药(粒径相同),采用相同的处方和工艺生产了两批批号分别为1509090(Ⅰ型)和1510088(Ⅱ型)的利福平胶囊,用以考察利福平不同晶型制剂溶出曲线的差异,计算各时间点的累积溶出度,将两种晶型溶出曲线进行相似性比较,f2因子均小于50,说明在原料药粒径、处方和工艺均一致的情况下,利福平Ⅰ型胶囊和利福平Ⅱ型胶囊的溶出行为不相似。两种晶型的原料的溶解度相似,均具有pH依赖性,在4种介质中溶出行为不相似可能是由于利福平本身具有很差的润湿性[8]。
Table6 Comparison of similarity between domestic imitation preparations and preparation produced by Daiichi Sankyo (Batch No.HQB0191)

GroupCumulative dissolution in 15 min/%pH 1.2 HClf2pH 4.0 PBSpH 6.8 PBSWaterHQB0191 vs 3130153>85242115HQB0191 vs 150501>858718HQB0191 vs 150303>851097HQB0191 vs 150502>8521429HQB0191 vs 1505161>85163437HQB0191 vs S150604>85181634
*time point:5,15,45 min
Table7Comparison of similarity between domestic imitation preparations and the preparation produced by Sanofi-Aventis(Batch No.3130153)
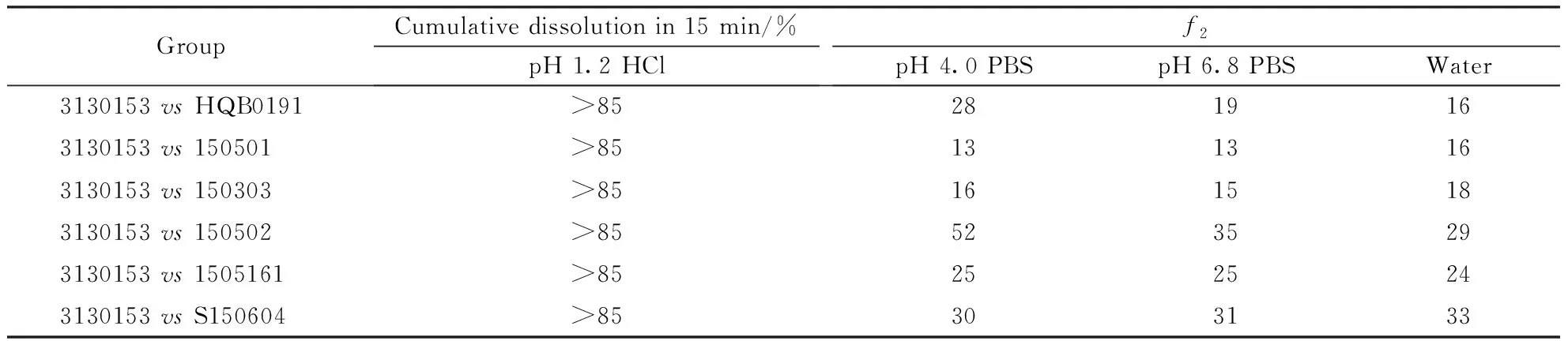
GroupCumulative dissolution in 15 min/%pH 1.2 HClf2pH 4.0 PBSpH 6.8 PBSWater3130153 vs HQB0191>852819163130153 vs 150501>851313163130153 vs 150303>851615183130153 vs 150502>855235293130153 vs 1505161>852525243130153 vs S150604>85303133
*time point:10,20,45 min
3 结论与讨论
本实验建立了利福平溶出曲线测定的方法,其中装置、介质、转速等参数的设置合理,紫外分光光度测定法准确可行,能很好地区分利福平胶囊的体外溶出行为。
经考察发现,日本第一三共株式会社和赛诺菲-安万特生产的利福平胶囊含量和有关物质均相当;第一三共株式会社产品的批内一致性良好,批间一致性也稳定;赛诺菲-安万特产品的批内一致性略差,由于未购买到两个不同批号,因此批间一致性未进行考察,在后续研究中将继续进行,由于原国家食品药品监督管理总局公布的第七批参比制剂为美国橙皮书收载的赛诺菲-安万特的利福平胶囊,因此赛诺菲-安万特的产品将会是利福平胶囊生产企业研究的重点。
本研究对国产利福平胶囊与国外参比制剂的相似性进行了比较。本试验选择5,15,45 min 3个取样时间与第一三共株式会社进行比较,而选择10,20,45 min 3个取样时间与赛诺菲-安万特进行比较,是因为赛诺菲-安万特的产品比第一三共株式会社的产品释放速度慢,选择不同的时间点进行比较较合理。结果显示,国产征集到的5家利福平胶囊,其中2家为原料直接灌装工艺,到截止时间点除了在pH 1.2盐酸溶液中可以达到85%以外,在其他3种介质中均只能达到10%~30%,另外3家产品到截止时间点在pH 1.2盐酸溶液、纯水、pH 6.8磷酸盐缓冲液中均可以达到85%以上,在pH 4.0磷酸盐缓冲液中释放量在50%~77%。通过计算f2因子发现,第一三共株式会社的产品与赛诺菲-安万特的产品的溶出曲线不相似,国产仿制制剂与两家进口制剂的溶出曲线也均不相似。进一步调研发现,国产利福平制剂采用的原料与国外原研制剂采用的原料为不同晶型,国产制剂为Ⅰ型,国外制剂为Ⅱ型。因此本研究对不同晶型的利福平胶囊的溶出度进行考察,结果显示不同晶型的溶出曲线并不相似。所以,采用原研制剂作为参比制剂从理论上不合适,本品采用溶出行为相似判断进行生物利用度豁免的可行性极小,因此建议采用生物等效性实验进行本品仿制药一致性评价。

