三维肿瘤球模型应用于肿瘤耐药机制研究进展
郭雷雷,徐郁蕊,张 蕾,董怡文,林舒婷,宁兴海*,刘潇璇**
(1中国药科大学天然药物活性组分与药效国家重点实验室,南京210009;2中国药科大学药物科学研究院高端药物制剂与材料研究中心,南京 210009;3南京大学现代工程与应用科学学院,南京 210093)
人体细胞为维持正常的新陈代谢和活性功能,需要周围环境提供足够的氧气和养分。但实体肿瘤具有与正常组织不同的结构特征[1-2],导致肿瘤细胞形态、分化、细胞与基质间的相互作用,以及细胞与细胞间的相互作用发生了极大的变化,与正常细胞存在显著差异(图1)。例如,实体肿瘤内细胞增殖快于血管生成,加上肿瘤血管组织的特殊结构[3]和血液流动的不规则性,导致实体肿瘤内部缺乏足够的养分和氧气[4]。另外,肿瘤组织的一些其他特性,比如,缺少有效的淋巴管和血管、肿瘤组织内压(IFP)较高[5]、细胞外基质致密[6],都导致了实体瘤内部物质交换的降低,所以使细胞无法进行正常的新陈代谢。由于体内实体肿瘤具有上述的基本特征,传统的二维肿瘤细胞培养模型不能很好地模拟这些实体瘤内部的微环境和细胞之间的相互作用,所以培养的细胞与体内的肿瘤细胞所处的微环境和状态都存在极大的差异(表1)。
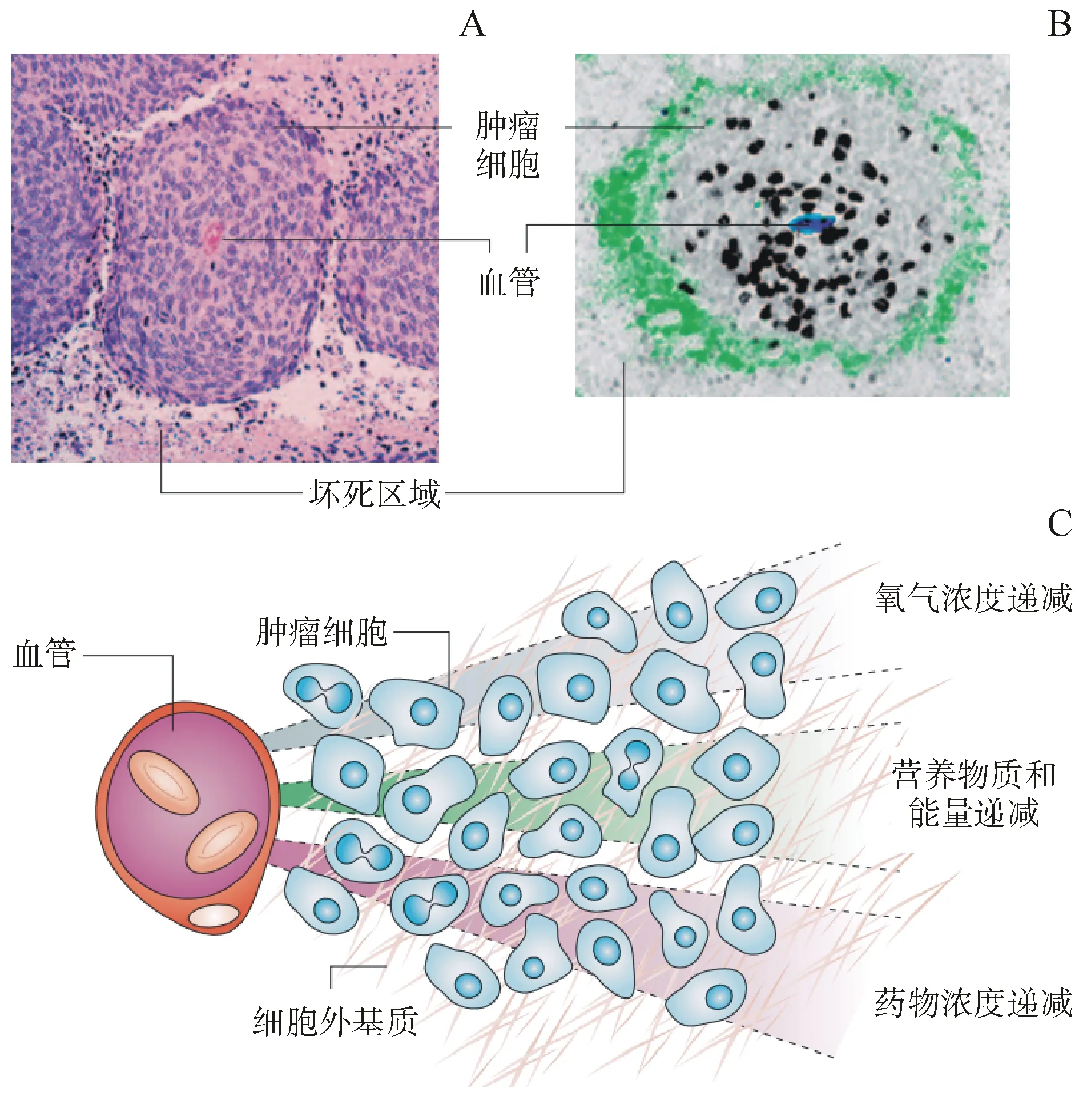
图1体内实体肿瘤生理特征
宫颈癌(A)和结肠癌(B)瘤内以血管为中心的周围不同状态肿瘤细胞的切片染色;(C)体内实体肿瘤内氧气浓度、营养物质、能量和药物浓度梯度分布示意图
表1 二维肿瘤细胞、三维肿瘤球和体内实体瘤主要特征比较
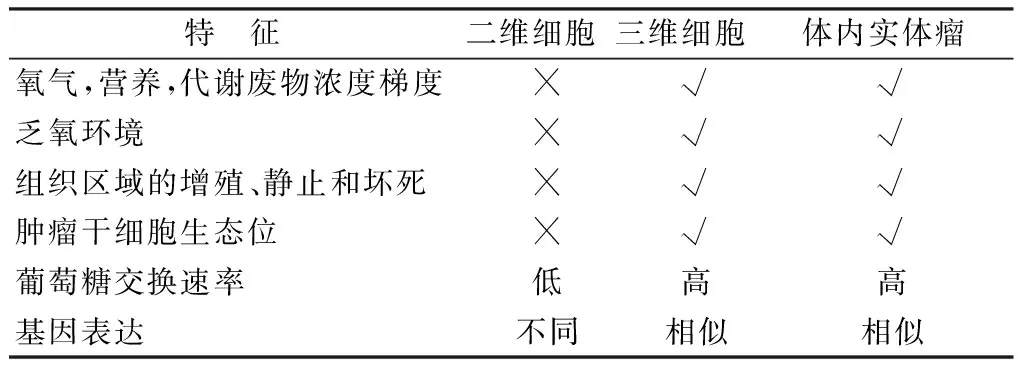
特 征二维细胞三维细胞体内实体瘤氧气,营养,代谢废物浓度梯度✕√√乏氧环境✕√√组织区域的增殖、静止和坏死✕√√肿瘤干细胞生态位✕√√葡萄糖交换速率低高高基因表达不同相似相似
“√”代表存在,“×”代表不存在
因此,采用在三维条件下培养的肿瘤球(tumor spheroids)模型来真实地模拟体内实体瘤细胞得到了越来越多的关注[7-8]。三维肿瘤球具有与体内实体瘤相似的增殖曲线、细胞异质性、信号通路和基因表达特性,能形成与体内实体瘤相似的梯度生理环境,近年来被广泛用于肿瘤细胞形态、肿瘤微环境、肿瘤干细胞富集、药物筛选评价等方面的研究,特别是在耐药机制研究中得到了极大的关注[7,9]。
肿瘤耐药是影响肿瘤治疗的主要原因之一[10],鉴于三维肿瘤球与体内实体瘤的相似性,利用三维肿瘤球探讨肿瘤耐药产生的机制,以及开发克服耐药机制的方法,对临床抗肿瘤治疗意义重大。与二维细胞相比,三维肿瘤球细胞具有更加耐药的特性,已有研究对其耐药产生的机制进行了大量探讨[11-13]。本文从三维肿瘤球的结构特征出发,探讨三维肿瘤球中细胞间以及细胞外的微环境对三维肿瘤球的耐药机制的影响,期望可以为更进一步研究肿瘤细胞增殖、分化、耐药机制及临床药物筛选提供更好的研究方法。
1 三维肿瘤球的结构特征
三维肿瘤球直观反映了细胞间以及细胞与胞外基质间的相互作用,是肿瘤研究中最好的体外模型之一,因此,近年来开发出许多三维肿瘤球的培养方法,如液体覆盖培养法(liquid overlay cultures)、悬滴培养法(hanging drop cultures)、旋转瓶培养法(spinner flask culture)、NASA生物反应器法(NASA bioreactor)以及微阵列技术(micro-/nano-technology)等[14-15]。这些培养方法操作简便、可重复性强,但也各具优缺点。例如,液体覆盖法和悬滴培养法可以制备单个肿瘤球,且肿瘤球培养成功率较高,但总的肿瘤球产量不高。旋转瓶法和生物反应器法可以制备大量的肿瘤球,但肿瘤球大小不匀且培养时间较长。
由于细胞本身内在特性和培养方式不同,形成的三维肿瘤球形态也不相同(图2),但当肿瘤球直径大于500 μm时,它们均具有以下基本结构特性[8,16]。第一,肿瘤球产生梯度微环境,其内部的氧气、营养物质、新陈代谢废物和可溶性因子(细胞因子,生长因子和趋化因子)等物质的扩散受阻,将引起肿瘤球从外到内梯度升高的乏氧环境和代谢废物堆积。内部的乏氧环境进一步促进无氧糖酵解产物乳酸的堆积,导致肿瘤球具有从外到内pH梯度降低的特征。第二,肿瘤球内产生异质细胞群体,由于新陈代谢废物堆积和梯度微环境,在三维肿瘤球中细胞状态也呈梯度变化,中心是坏死的细胞群,中间层是静止期的细胞群,最外层是高增殖和易迁移的细胞群。第三,肿瘤球内细胞形态发生改变,细胞不再贴壁或悬浮生长,而是与其他肿瘤细胞紧密接触,此时细胞外基质和细胞微绒毛等肿瘤固有结构出现[17]。三维肿瘤球的以上基本特征和结构特性使得三维肿瘤球细胞对药物不敏感,产生耐药性。
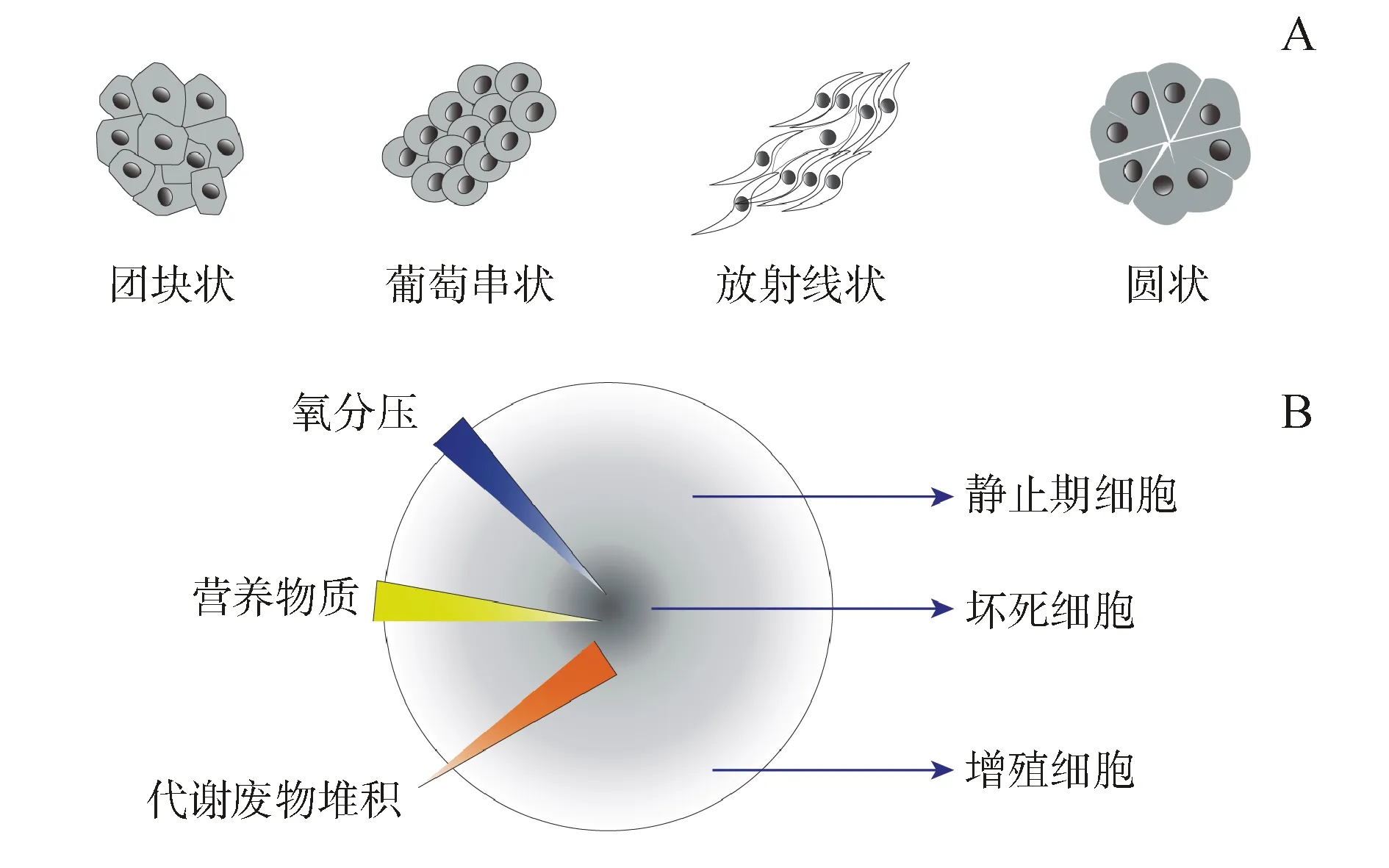
图2 三维肿瘤球的形态特征和基本结构特性
A:不同形态的肿瘤球;B:肿瘤球内梯度的理化特性及其内部细胞的异质性
2 三维肿瘤球的耐药机制
三维培养的肿瘤球具有体内实体肿瘤组织的特点:细胞与细胞、细胞与胞外基质之间的联系增加;细胞异质性增加;可以模拟体内实体肿瘤微环境。研究表明,这些肿瘤球的特性致使肿瘤细胞的耐药性增加,药物的IC50增加(表2)。这种耐药现象称为多细胞耐药(multicellular resistance MCR)[18],这种耐药的机制可以分为两类,包括细胞之间“接触效应”导致的耐药和模拟肿瘤微环境导致的耐药。
表2 A549细胞在二维和三维培养条件下对不同药物IC50(μmol/L)的比较

药物IC50/(μmol/L)二维三维MCR指数顺铂3.0±0.581±1527阿霉素0.2±0.17±135依托泊苷3.2±0.3521±80163长春新碱0.008±0.00153±66 625
MCR指数是指三维细胞IC50/二维细胞IC50
2.1 细胞之间的“接触效应”
在三维培养条件下的细胞,即使肿瘤球体积很小(包含25~50个细胞)也表现出与二维细胞相比更加耐药的现象[19]。Bates等[20]用单抗23C6(抗整合素)阻碍LIM 1863结肠癌细胞之间的接触,与不加单抗培养成的三维肿瘤球相比,抗肿瘤药物可以明显提高加单抗培养的三维肿瘤球细胞的凋亡,结果说明,三维条件下细胞与细胞之间的相互接触提高了细胞存活能力,这种现象即为细胞接触介导的耐药(cell adhesion-mediated drug resistance,CAM-DR)[21]。这种耐药产生的原因主要有两点:(1)细胞间连接增加,提高了细胞之间相互作用,进而增加细胞耐药性;(2)细胞形态改变导致相关基因表达和染色体组压缩程度改变,进而提高细胞自我修复能力(图3)。

图3 细胞之间“接触效应”对耐药的影响[19]
2.1.1 三维肿瘤球增加细胞间连接和交流 Durand 等[22]发现三维肿瘤球提高了肿瘤细胞对药物的耐受,并认为是由于受损肿瘤细胞周围的肿瘤细胞可以通过细胞间连接,向受损细胞传递大量生物活性分子(修复酶、RNA、蛋白复合物等),进而提高肿瘤细胞对药物或辐射等损害的耐受性。事实上三维培养的细胞之间存在更加紧密的缝隙连接(gap junctions)、紧密连接(tight junctions)和细胞桥粒(desmosomes)[23],这些细胞间连接增加了三维肿瘤球内部细胞的交流。例如,Bai等[24]分别检测了在三维和二维培养条件下,人肉瘤细胞HOSS1中细胞间隙连接蛋白(Cx26,Cx43和Cx45)的表达水平。免疫荧光染色结果显示相比于二维细胞,在三维肿瘤球细胞中这些蛋白更加丰富。同时,RT-PCR和Western blot实验同样证实了这一结果,表明在三维培养条件下细胞间交流变得更加频繁,相互影响更大。
另外,研究表明三维肿瘤球细胞中E-钙黏蛋白(E-cadherin)表达量通常比二维细胞中多[15]。E-钙黏蛋白是钙离子依赖的细胞之间增强黏附的生物大分子,其表达量多少与细胞间连接紧密程度密切相关。而E-钙黏蛋白表达增加会使p27Kip1蛋白的表达量上调,p27Kip1蛋白又是细胞周期依赖激酶的抑制蛋白,它的增加被证实可以抑制细胞周期进行,使更多细胞停留在G0/G1期,提高肿瘤细胞的耐药性[25]。所以在三维肿瘤球中,肿瘤细胞间紧密连接促使E-钙黏蛋白表达增加,进一步诱导了p27Kip1蛋白的上调,最终促进三维肿瘤球细胞耐药性提高。
2.1.2 三维肿瘤球诱导细胞形态改变 三维环境中培养的细胞不仅具有特征性的生理和生物信号,影响细胞迁移、黏附、增殖等功能,而且每一个细胞及细胞核的形态与二维培养的细胞相比也会发生明显改变,一般由二维培养时的不规则形变为球形。细胞形态在DNA复制、基因表达、细胞分化、DNA压缩程度与修复能力中扮演重要角色。Folkman等[26]使用不同浓度的聚甲基丙烯酸羟乙酯(poly HEMA)来逐步降低细胞的黏附性,致使细胞形态梯度变化,poly HEMA浓度最低的一组细胞可形成肿瘤球。进一步对每个浓度梯度下细胞DNA复制进行对比,结果发现细胞形态不同,其DNA复制速度和基因表达量均不相同。
同时,细胞形态直接影响细胞对药物的敏感性。例如在对V79细胞进行电离辐射时发现,尽管大的肿瘤球(20~50个细胞)和小的肿瘤球(3~8个细胞)相比,细胞之间的交流频率不同,但肿瘤细胞都呈现出球形的形态,且均表现出相同的电离辐射耐受性。进一步地通过吖啶橙染色、核酸沉淀和中性滤膜洗脱等实验表明在三维肿瘤球细胞中DNA的构象发生明显改变,但具体的分子机制还有待进一步研究[27]。
2.2 微环境影响
2.2.1 三维肿瘤球的乏氧环境 与正常组织中氧含量相比,三维肿瘤球中存在乏氧环境,而肿瘤细胞在乏氧状态下也表现出较高的耐药性。研究表明乏氧环境引起的耐药机制体现在多个方面。第一,乏氧区域细胞增殖较慢,导致肿瘤细胞对周期依赖性药物的敏感度降低[28];第二,肿瘤乏氧环境与抑癌蛋白p53的缺失密切相关,p53的缺失降低了细胞凋亡、增加了血管生成和侵袭[29];第三,乏氧下调一些抗肿瘤药物的靶点如DNA拓扑异构酶Ⅱ的表达,进而使得靶向拓扑异构酶Ⅱ的药物如依托泊苷的抗肿瘤活性降低[30];第四,乏氧可以诱导自噬的产生,增强肿瘤细胞在压力下的生存能力[31];第五,乏氧将诱导HIF-1α应激蛋白的表达,从而激活其下游与细胞耐药相关的一系列蛋白,如上调抗凋亡蛋白Bcl-2、外排泵蛋白(P-gp)、血管细胞生长因子(VEGF),下调细胞周期蛋白D-1(cyclin D1)等[32]。其中,最重要的是抗凋亡蛋白Bcl-2的调节,它能抑制线粒体释放细胞色素C诱导的细胞凋亡通路。研究表明肿瘤球细胞的乏氧会使Bcl-2蛋白家族上调,从而减少细胞凋亡。例如,Kim等[33]用U251神经胶质瘤细胞和U87星形胶质瘤细胞研究肿瘤球细胞在乏氧环境下对药物耐受性的影响。结果显示,在三维培养条件下,肿瘤细胞可以产生不同程度的耐药现象,肿瘤细胞中与凋亡相关的蛋白表达水平发生很大的改变,例如,与细胞程序性死亡相关的蛋白激酶Caspase-3活性降低,而抗凋亡蛋白Bcl-2和生存素(survivin)表达水平显著上调。
除上述机制外,Qin等[34]研究维莫非尼(vemurafenib)治疗黑色素瘤时发现,三维肿瘤球细胞和乏氧条件下培养的二维细胞,均比正常氧含量下的二维细胞更加耐药。结果显示,在三维肿瘤球细胞和乏氧二维细胞中磷酸化的丝氨酸/苏氨酸激酶(p-Akt)表达上调,HGF/c-Met通路中两个蛋白:肝细胞生成因子(HGF)、细胞间质-上皮转换因子(c-Met)表达也同时上调。当加入抗HGF单抗(anti-HGF antibodies)阻断HGF激活HGF/Met通路后,p-Akt的表达水平随之降低,表明Akt的磷酸化是由激活HGF/MET通路引起。进一步地联合HGF/Met通路激活抑制剂MSC2156119J给药后,可以显著增强维莫非尼对三维肿瘤球细胞和乏氧二维细胞的杀伤效果,表明乏氧致使HGF/MET通路激活,进而诱导肿瘤细胞产生耐药性。
2.2.2 三维肿瘤球的弱酸环境 三维肿瘤球内部由于缺乏养分和氧气,无法为肿瘤细胞提供生命活动所需的能量。因此,肿瘤细胞将上调丙酮酸激酶(M2-PK)表达,通过无氧糖酵解(glycolysis)的方式产生维持细胞生命活动的ATP。糖的无氧酵解在肿瘤细胞中产生大量乳酸(lactate)[35],进而激活V-ATP酶、Na+/H+质子交换泵、单羧酸转运蛋白和碳酸酐酶9,排出过多的H质子[36],在肿瘤细胞的周围产生弱酸性的环境(pH约6.5~7.1)。相比于肿瘤细胞外部的弱酸环境,细胞内依然保持弱碱性生理微环境(pH约7.4),这种肿瘤微环境的独特性质被称作“颠倒的pH梯度(reversed pH gradient)”[37]。
肿瘤弱酸性的微环境致使细胞膜内叶(inner leaflet)磷脂之间的相互作用改变,细胞膜刚性增加[38],造成抗肿瘤药物在肿瘤细胞中的摄取量减少。另外,肿瘤细胞膜两侧梯度的pH环境促进肿瘤细胞P-糖蛋白与抗肿瘤药物的相互结合,增加药物的外排[39]。还有研究表明,即使药物分子通过细胞膜,但细胞内酸性细胞器如溶酶体和内涵体与细胞质pH相差较大,导致大部分弱碱性的抗肿瘤药物停留在这些酸性细胞器内,无法到达作用部位(细胞核),进而提高肿瘤细胞的耐药[40-41]。为了克服肿瘤微酸环境产生的耐药性,Luciani等[42]首先采用细胞质子泵抑制剂(proton pump inhibitors PPI)奥美拉唑、埃索美拉唑或泮托拉唑抑制肿瘤细胞的微酸环境,然后再检测抗肿瘤药物对细胞的毒性。结果表明,经过PPI处理的细胞对顺铂、氟尿嘧啶和长春新碱具有较高的敏感性,药物的IC50降低99%,进一步证明微酸环境在肿瘤细胞耐药机制中扮演重要作用。
2.2.3 三维肿瘤球中静止期细胞增加 随着肿瘤的发展,肿瘤细胞突变(tumor mutations)和基因组重排(genomics rearrangements)会逐渐增加,这些改变往往会引发肿瘤细胞的耐药性。三维肿瘤球内细胞是高度异质性的。例如,Pettersson等[43]对肿瘤球进行检测时发现氚标记的胸苷标记指数(tritiated thymidine labelling index)从外围到内部迅速降低,在肿瘤球175 μm深处标记值接近于0,说明三维肿瘤球从外到内,处于静止期的肿瘤细胞逐渐增多。而处于静止期的肿瘤细胞通常比分裂期细胞对药物更加耐受,因此,三维肿瘤球细胞对抗肿瘤药物展现出较强的耐药性。Beaumont等[44]使用二维和三维肿瘤模型,考察细胞周期对临床抗肿瘤药物毒性的影响,他们分别用MEK抑制剂U0126和选择性BRAF抑制剂PLX4032对细胞进行预处理,这两种抑制剂均能阻滞肿瘤细胞在G1期[45]。然后观察预处理细胞对硼替佐米和替莫唑胺的细胞存活率,结果显示U0126和PLX4032均能提高细胞对药物的耐受性。进一步用乏氧和饥饿条件处理细胞,模拟生理条件下诱导的G1期阻滞,结果同样提高了细胞对抗肿瘤药物的耐受性。同时,他们在检测给药后三维肿瘤球细胞周期的变化时,发现在给药后期,只有肿瘤球内部的G1期细胞存活较多,进一步证明静止期细胞具有较强的耐药性。
细胞周期进程中有两个重要的周期检查点(G1后期和即将进入M期前)控制着细胞凋亡的开始[46]。当细胞周期进行到检查点时,细胞不但可以进入周期下一阶段,而且当细胞受到损伤时也可以进入凋亡程序。影响细胞周期的两个重要蛋白是细胞周期依赖蛋白(cyclin-dependent kinases,CDK)和细胞周期素(cyclins),而它们的抑制剂(CDK inhibitors或CKIs)被认为实际调控着周期进程。该抑制剂有两大家族p21家族(包括p21Cip1/Waf1,p27Kip1和p57Kip2)和INK4家族(包括p15INK4b,p16INK4a,p18INK4c和p19INK4d),它们表达量的上升均使细胞周期发生阻滞[47]。其中,p27Kip1和p21Cip1/Waf1蛋白在肿瘤细胞耐药机制中扮演着重要角色。研究表明[25,48],p27Kip1和p21Cip1/Waf1蛋白在三维培养的细胞中表达量是二维细胞的15倍,即表明三维培养的肿瘤细胞中有更多的细胞被阻滞在G0/G1期。而且,当进一步地使用siRNA降低p27Kip1表达量后,三维肿瘤球细胞之间的黏附随之降低,增殖能力增强,对药物的敏感性也增强,表明p27Kip1导致的细胞周期G1期阻滞是三维肿瘤球细胞耐药的重要因素之一。
2.2.4 三维肿瘤球的细胞外基质(extracellular matrix,ECM) 不同于二维细胞,三维培养的肿瘤球细胞之间可以产生ECM,而且不同种类的肿瘤细胞产生ECM的量及其组成有很大差别,产生的ECM在肿瘤细胞的迁徙及其对药物的敏感性方面起着重要作用。Bai等[24]证实了与ECM组成密切相关的蛋白(COL1A1、LOX、FN1、SNED1、ITGB1和LAMA4)在三维细胞中的表达水平明显高于二维细胞。而且,一些与ECM相关的蛋白如SNED1已被报道与细胞的耐药密切相关[49]。
此外,有研究表明,由整合素和钙黏素介导的细胞与ECM的相互作用可以激活Raf/MEK/ERK和PI3K/Akt通路,导致肿瘤细胞耐药增加[15]。再者,Sethi等[50]在研究非小细胞肺癌细胞的耐药时发现,当细胞在纤链蛋白fibronectin (Fn)、层粘连蛋白laminin (Ln)、胶原Ⅳ(collagen IV)或固生蛋白(tenascin)等ECM上黏附生长时,肿瘤细胞的增长数量明显增加[50]。当给予肿瘤细胞相同浓度抗肿瘤药物依托泊苷时,ECM黏附的细胞凋亡率比没有ECM黏附的细胞凋亡率低80%。但是如果将ECM换成聚L-赖氨酸时,ECM抑制凋亡的效果就不存在。进一步对ECM抑制凋亡的机制探讨发现,整合素β1单抗P5D2(阻断ECM与整合素β1的结合)可以阻止ECM介导的凋亡保护。另外,进一步的研究发现,tyrphostin-25(一种蛋白酪氨酸激酶PTK抑制剂)同样可以阻止ECM对凋亡的保护作用,但没有阻碍细胞与ECM的黏附。以上研究表明,ECM介导的细胞耐药,是通过激活整合素β1进而激活PTK通路,进而增加肿瘤细胞的耐药,进一步揭示了ECM在肿瘤细胞耐药中发挥重要作用。
3 结语与展望
三维肿瘤球模型能够将肿瘤细胞、细胞外基质以及其他生物分子整合在一起,真实地模拟肿瘤生长和进展的微环境,最大程度地维持肿瘤细胞的活性功能,更有利于肿瘤学特别是肿瘤耐药机制方面的研究。因此,本文通过分析三维肿瘤球的结构特征,有效地从三维肿瘤球形态及微环境两个方面系统总结三维肿瘤球产生耐药的原因,具有极大的研究意义和临床价值。然而,揭示肿瘤细胞耐药机制后,需要开发新的技术和手段克服肿瘤细胞耐药,提高对肿瘤的治疗效果,这些将是下一阶段肿瘤治疗研究的主要方向之一。另外,现阶段的三维肿瘤球培养技术仍存在无法保证每个肿瘤球的大小、所包含细胞数量、紧密度等指标完全相同[51],缺乏参考标准和产出数量有限等问题,所以完善培养方法和建立评价标准亦是今后需要攻克的一个难题。最后,随着三维肿瘤球技术的进步发展,肿瘤球的组成将越来越复杂,需要生物、化学、工程等多种学科共同协作开发出更先进的三维肿瘤模型,促进新型临床医学的快速发展。

