不同产地脱脂乳木果仁总酚含量测定及其生物活性
李 达,马聪玉,吕青林,柳文媛,冯 锋,2,4,张 杰,4*
(1中国药科大学中药学院,南京 210009;2江苏食品药品职业技术学院,淮安 223003;3中国药科大学药物分析教研室,南京 210009;4中国药科大学生物材料重点实验室,南京 210009)
乳木果仁系山榄科(Sapotaceae)植物乳油木(VitellariaparadoxaC.F.Gaertn)果实(乳木果)的果仁,只能在非洲大陆生长,主产于马里至苏丹、乌干达等国家间的亚撒哈拉地区[1]。作为“药食两用”植物,乳木果是当地重要的食品来源之一,同时也用于治疗晒伤、皮疹、风湿、痢疾、荨麻疹、胃肠道感染和溃疡等疾病[2-3]。现代植物化学研究表明,乳木果仁中主要有三萜、挥发油、甾体和酚类等化学成分[1-2,4];现代药理研究表明,乳木果仁具有抗炎、抗菌和抗氧化等作用[2-3,5-6]。乳木果仁中使用最为广泛的是其中提取的乳木果油,常应用于皮肤护理产品和化妆品配方成分[6]。
酚类化合物广泛存在于人们日常饮食中,具有清除体内自由基、抗菌消炎、抗肿瘤、抗过敏、抗病毒等方面的生物活性[7]。此外,已普遍认为人体内的过量自由基与多种疾病的发生有着密切的关系,因此寻找天然抗氧化剂已成为国内外学者研究的热点。而目前尚未有关于各产地脱脂乳木果仁的总酚含量及相关药理活性的研究报道,故本实验测定了26个不同产地脱脂乳木果仁的总酚含量及抗氧化、细胞毒和EBV-EA抑制等生物活性,并探讨了TPC与抗氧化、细胞毒和EBV-EA抑制活性间的相关性,为其药用潜力的进一步开发提供参考。
1 材 料
1.1 试药与试剂
乳木果样品由世界农林研究中心(ICRAF)的Eliot T.Masters博士于2006年5月至7月间在非洲7个国家26个地区的成熟乳油木树上收集并鉴定,其中科特迪瓦产地1个样品(S1)、加纳产地1个样品(S2)、尼日利亚产地11个样品(S3~S13)、喀麦隆产地2个样品(S14~S15)、乍得产地8个样品(S16~S23)、苏丹产地2个样品(S24~S25)、乌干达产地1个样品(S26);福林试剂、氯化铁、过硫化钾(K2S2O8)(上海阿拉丁有限公司);6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)、DPPH、ABTS、2,4,6-三吡啶基三嗪(TPTZ)(上海源叶生物科技有限公司);12-O-十四酰基佛波醇-13-乙酸酯(TPA)(美国ChemSyn实验室);正丁酸(日本Nacalai Tesque公司);顺铂(Cisplatin)(日本Wako Pure化学试剂公司);MTT(日本西格玛奥德里奇公司);96孔板、75 cm2细胞培养瓶、胎牛血清(FBS)、鼻咽癌患者的阳性血清、辣根过氧化物酶、羊抗人免疫球蛋白A抗体、RPMI-1640培养基(美国Invitrogen公司);细胞培养瓶(美国BD公司);所有其他的试药与试剂均为分析纯(南京化学试剂公司)。
1.2 仪 器
CAX-370型离心机(日本Tomy Seiko公司);RE-2000型旋转蒸发仪(上海亚荣生化仪器厂);BS124S型分析天平(北京赛多利斯科学仪器有限公司);JM-A5002型电子天平(诸暨超泽衡器设备有限公司);酶标仪(美国BioTek公司);XD-202型倒置显微镜(南京江南永新光学有限公司)。
1.3 细胞株
人白血病细胞HL60、肺肿瘤细胞A549、乳腺肿瘤细胞SK-BR-3和淋巴瘤细胞Raji购自日本Riken细胞库。细胞均在37 ℃、5% CO2的培养箱中培养,其中HL60,SK-BR-3和Raji细胞在含10% FBS、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640培养基中生长;A549细胞在含10% FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基中生长。细胞实验操作在生物安全柜中进行。
2 方 法
2.1 样品制备
各产地(图1[8])脱脂乳木果仁(5.0 g)用甲醇100 mL 60 ℃加热回流提取3次,每次3 h。合并提取液用离心机以5 000 r/min离心10 min,取上清液减压浓缩,得到不同产地脱脂乳木果仁甲醇浸膏。
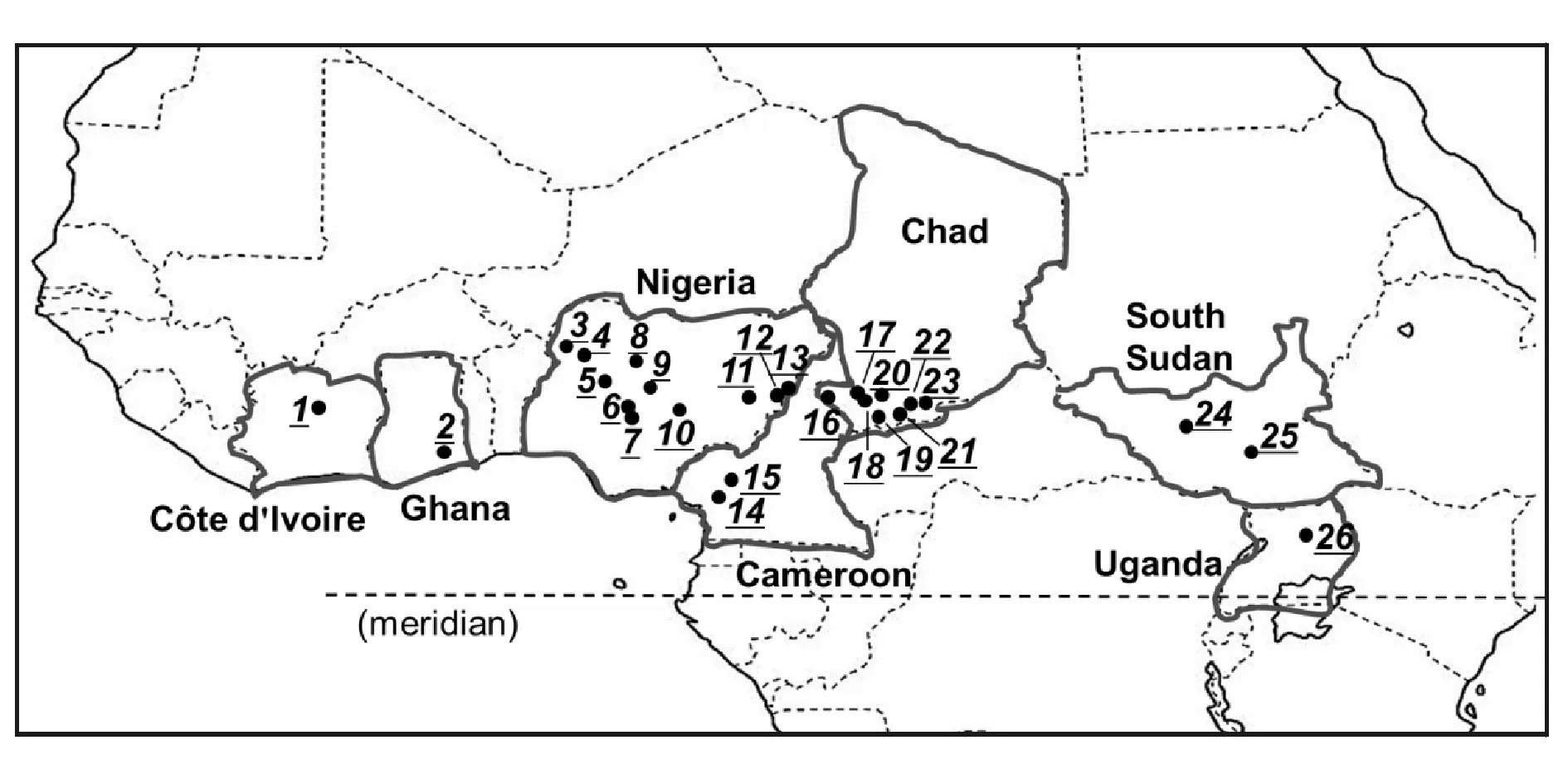
Figure1 Map of Africa showing the sites (·) of twenty-six defattedVitellariaparadoxakernels
2.2 总酚含量测定
总酚含量测定采用福林-西奥卡特(Folin-Ciocalteu)法,没食子酸(GAE)作标准品[9-10]。
照“2.1”项下样品制备方法,取各产地脱脂乳木果仁提取物浸膏,甲醇重新溶解后,用0.45 μm滤膜滤过,取续滤液,干燥,精密称定,均配制成10 mg/mL 样品溶液。准确移取样品溶液0.1 mL,加入Folin-Ciocalteu试剂1 mL混合。5 min后,加入碳酸钠溶液(0.29 g/mL)2 mL,蒸馏水定容至10 mL。室温、避光处放置1 h,在760 nm处测得吸收度。没食子酸标准品用甲醇溶解,配成0.05 mg/mL的标准溶液,准确量取上述标准液0.00、0.02、0.04、0.06、0.08、0.10 mL,照样品测定方法,以没食子酸浓度为横坐标,吸收度为纵坐标,绘制标准曲线,样品干浸膏的总酚含量以没食子酸计(mg/g),每次3组平行实验。
2.3 抗氧化活性测定
2.3.1 DPPH自由基清除实验[11]照“2.2项”下样品溶液配制方法,各产地脱脂乳木果仁提取物均用无水乙醇溶剂配成50、25、12.5、6.25、3.125 μg/mL的样品溶液(根据不同样品测定结果可上调样品溶液质量浓度至200、100 μg/mL;或下调样品溶液浓度至1.56、0.78 μg/mL);15 mmol/L DPPH溶液0.2 mL与空白溶剂0.8 mL混合后,初始吸收度(A)在0.8~1.0处最佳。实验中,将不同浓度的样品溶液0.8 mL加至15 mmol/L DPPH溶液0.2 mL中,反应混合液于25 ℃、避光处放置30 min,转移至比色皿内,于酶标仪517 nm处测定其吸收度。每次3组平行实验,抗氧化活性测定结果以半数抑制浓度(IC50)表示,以水溶性维生素E(Trolox)作为对照品。清除率(%)=(Acontrol-Asample)/(Acontrol-Ablank)×100。
2.3.2 ABTS自由基清除实验[12]ABTS工作母液配制:将ABTS(7.0 mmol/L)与K2S2O8(2.45 mmol/L)溶液等体积混合,配制成ABTS工作母液;母液在室温、避光处放置16 h,工作母液稀释后,在734 nm处的初始吸收度为0.7±0.05时使用。
照“2.2项”下样品溶液配制方法,各产地脱脂乳木果仁提取物均用pH 7.4的磷酸缓冲盐溶液(PBS)配成200 μg/mL的样品溶液。于96孔板中将样品溶液10 μL加至ABTS工作液200 μL中,30 min后在734 nm处测定其吸收度。Trolox标准品用PBS溶解,配成625、312.5、156.25、78.125、39.062 5 μmol/L不同浓度标准溶液,照样品测定方法,以Trolox浓度为横坐标,清除率为纵坐标,绘制标准曲线,每次3组平行实验计算样品的ABTS清除率,抗氧化活性测定结果以Trolox计(mmol/g)。计算公式同“2.3.1”项。
2.3.3 铁离子还原法(FRAP)[13]FRAP工作母液配制:将TPTZ(10 mmol/L)、FeCl3(2 mmol/L)溶液和醋酸盐缓冲液(pH 3.6)以10∶1∶1的体积比混合,配成FRAP工作液,在室温、避光处放置,现配现用。
照“2.2项”下样品溶液配制方法,各产地脱脂乳木果仁提取物均用pH 7.4的磷酸缓冲盐溶液(PBS)配成500 μg/mL的样品溶液。于96孔板中将样品溶液5 μL加至工作液180 μL中,30 min 后在593 nm处测定其吸收度。Trolox标准品用PBS溶解,配成1 250、625、312.5、156.25、78.125 μmol/L不同浓度标准溶液,照样品测定方法,以Trolox浓度为横坐标,吸收度为纵坐标,绘制标准曲线,每次3组平行实验计算样品的抗氧化能力,抗氧化活性测定结果以Trolox计(mmol/g)。
2.4 细胞毒活性测定
细胞毒活性评价采用MTT法[14]。细胞HL60,A549和SK-BR-3以每孔3×103个细胞的密度接种在含10% FBS及双抗培养基100 μL的96孔板中,于37 ℃、5% CO2的培养箱中培养24 h,待70%~80%细胞贴壁后弃掉培养基,并设置空白组、样品组和阳性对照组。其中,空白组只加入纯培养基100 μL;样品组则加入样品质量浓度分别为200、100、50、25、12.5 μg/mL的含药培养基100 μL(根据不同样品测定结果可上调样品溶液质量浓度至400 μg/mL;或下调样品溶液质量浓度至6.25、3.125 μg/mL);阳性对照组加入含阳性药Cisplatin的培养基100 μL,质量浓度分别为20、10、5、2.5、1.25 μg/mL(根据不同细胞测定结果可下调样品溶液质量浓度至0.625、0.312 5 μg/mL),每组均设置3个平行孔。于培养箱中继续培养48 h,然后弃掉培养基,避光条件下加入5 mg/mL MTT溶液15 μL,继续避光孵育3 h后,弃掉每孔溶液,加入DMSO 100 μL,于570 nm下测量吸收度。细胞存活率(%)=(Asample/Ablank)×100。
2.5 EBV-EA抑制活性测定
使用Raji细胞测定样品对EBV-EA的抑制作用[15-16],细胞在含10% FBS及双抗的RPMI-1640培养基的75 cm2细胞培养瓶中培养,于37 ℃、5% CO2的培养箱中培养。将指数生长期的Raji细胞,调整细胞密度约为每毫升1×106个细胞,取l mL置于试管中,并设置空白组、样品组和阳性对照组。其中,空白组只加入纯培养基1 mL;样品组则加入含4 mmol/L正丁酸、32 mmol/L TPA和不同浓度待测样品(100、10和1 μg/mL)的培养基1 mL;阳性对照组为加入含4 mmol/L正丁酸、32 mmol/L TPA的培养基1 mL。培养48 h后,细胞悬浮液进行离心(1 000 r/min,离心10 min),除去上清液,收获细胞,使用间接免疫酶法检测Raji细胞中的EBV-EA的表达情况,每次3组平行实验。
间接免疫酶法具体实验步骤:①收获细胞时,利用残存培养液,制成浓稠的细胞悬液;②取1滴细胞悬液均匀涂布载玻片小圆穴内,制成细胞涂片,晾干;随后将涂片用冷丙酮在4 ℃冰箱固定,晾干;用PBS洗3次,再次晾干;③滴加鼻咽癌患者的阳性血清(一抗)于小孔内,放入湿盒,于37 ℃、5% CO2的培养箱中孵育40 min,取出,PBS洗3次,晾干;滴加辣根过氧化物酶标记的羊抗人免疫球蛋白A抗体(二抗),于37 ℃、5% CO2的培养箱中孵育40 min,取出,PBS洗3次,晾干;④将涂片放入酶染色底物溶液中显色,避光8~10 min,取出涂片,蒸馏水洗1次,晾干,于倒置显微镜下计数500个细胞中阳性细胞数,计算阳性细胞率。阳性细胞率采用卡方检验,进而计算出相应的抑制率。
2.6 数据分析
实验数据计算与分析由SPSS 19.0软件完成;组间差异性比较采用单因素方差分析(One-Way ANOVA)中的Tukey算法,P<0.05即表示有统计学意义差异。相关性分析评价采用皮尔森相关系数值(Pearson Correlation)。
3 结果与讨论
3.1 总酚含量
如表1所示,各产地脱脂乳木果仁均总酚含量平均值为107.6 mg/g(以没食子酸计),其中尼日利亚产地的S12样品具有最高的总酚含量(265.7 mg/g),S13样品具有最低的总酚含量(25.8 mg/g),且差异性分析结果显示,各产地脱脂乳木果仁总酚含量有显著性差异性(P<0.05)。基于酚类物质具有较多良好的生物活性[7],下文将讨论总酚含量与抗氧化 (DPPH、ABTS和FRAP)、细胞毒和EBV-EA抑制等活性之间的相关关系。
3.2 抗氧化活性
如表1所示,各产地脱脂乳木果仁甲醇提取物均表现出不同程度的抗氧化活性(DPPH:IC503.4~54.9 μg/mL,ABTS:0.17~4.09 mmol/g,FRAP:0.11~1.93 mmol/g,以Trolox计)。其中,样品S4,S5,S8,S9,S12和S19表现出较高的DPPH 自由基清除活性(IC503.4~9.9 μg/mL),较对照品Trolox(IC506.9 μg/mL)具有更强或几乎相等的抗氧化活性;同时,这6个样品在ABTS和FRAP方法测定下也具有较强的抗氧化活性,抗氧化范围分别为2.07~4.09 mmol/g和0.60~1.93 mmol/g。结合课题组前期对脱脂乳木果仁甲醇提取物主要单体化合物的活性研究[6]发现,没食子酸、儿茶素、表儿茶素、槲皮素和芦丁等化合物具有显著的抗氧化活性,因此,脱脂乳木果仁中的酚类成分(黄酮和酚酸)是抗氧化的主要活性成分。
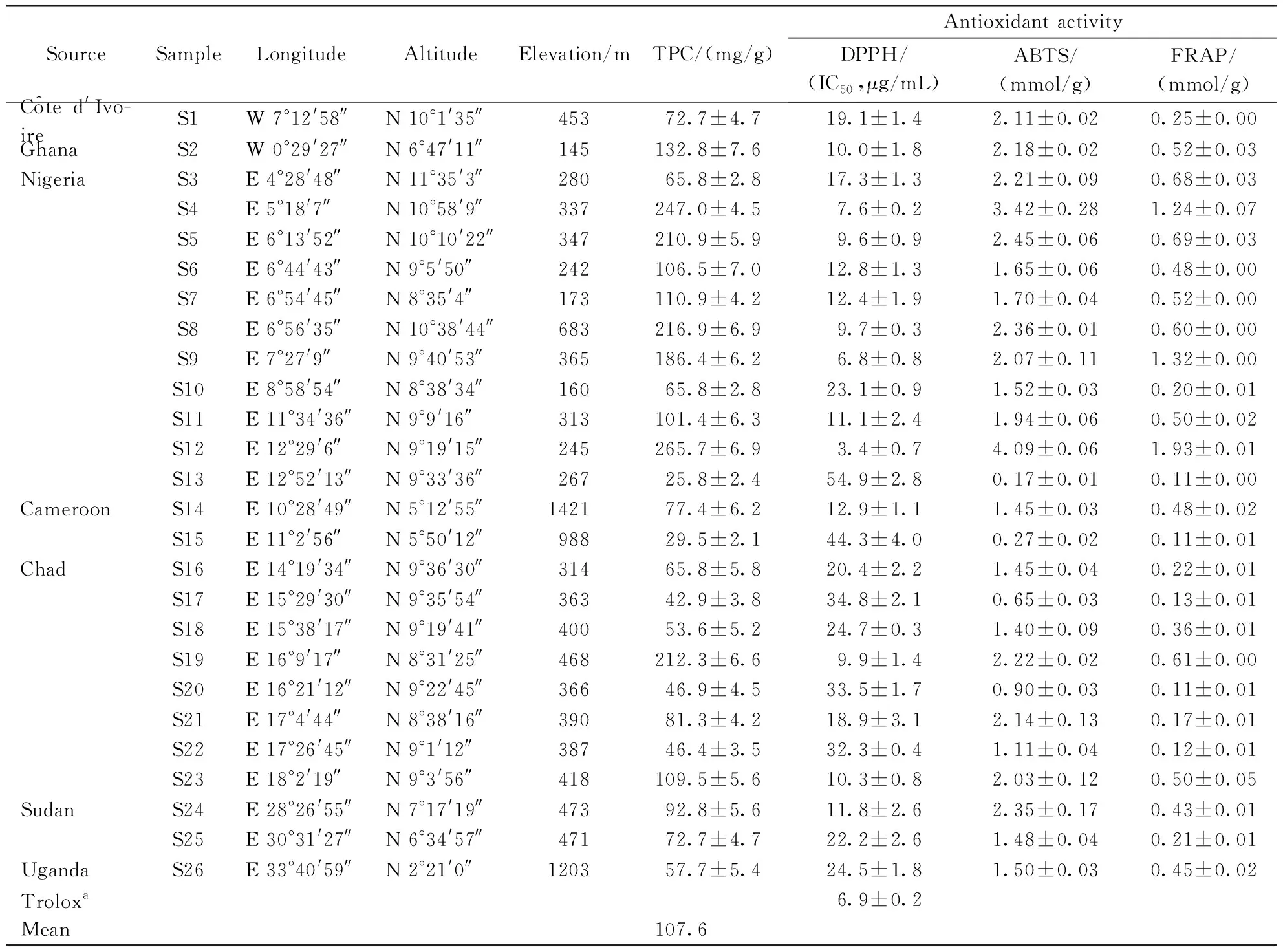
SourceSampleLongitudeAltitudeElevation/mTPC/(mg/g)Antioxidant activityDPPH/(IC50,μg/mL)ABTS/(mmol/g)FRAP/(mmol/g)C^ote d'Ivo-ireS1W 7°12'58″N 10°1'35″45372.7±4.719.1±1.42.11±0.020.25±0.00 GhanaS2W 0°29'27″N 6°47'11″145132.8±7.610.0±1.82.18±0.020.52±0.03NigeriaS3E 4°28'48″N 11°35'3″28065.8±2.817.3±1.32.21±0.090.68±0.03S4E 5°18'7″N 10°58'9″337247.0±4.57.6±0.23.42±0.281.24±0.07S5E 6°13'52″N 10°10'22″347210.9±5.99.6±0.92.45±0.060.69±0.03S6E 6°44'43″N 9°5'50″242106.5±7.012.8±1.31.65±0.060.48±0.00S7E 6°54'45″N 8°35'4″173110.9±4.212.4±1.91.70±0.040.52±0.00S8E 6°56'35″N 10°38'44″683216.9±6.99.7±0.32.36±0.010.60±0.00S9E 7°27'9″N 9°40'53″365186.4±6.26.8±0.82.07±0.111.32±0.00S10E 8°58'54″N 8°38'34″16065.8±2.823.1±0.91.52±0.030.20±0.01S11E 11°34'36″N 9°9'16″313101.4±6.311.1±2.41.94±0.060.50±0.02S12E 12°29'6″N 9°19'15″245265.7±6.93.4±0.74.09±0.061.93±0.01S13E 12°52'13″N 9°33'36″26725.8±2.454.9±2.80.17±0.010.11±0.00CameroonS14E 10°28'49″N 5°12'55″142177.4±6.212.9±1.11.45±0.030.48±0.02S15E 11°2'56″N 5°50'12″98829.5±2.144.3±4.00.27±0.020.11±0.01ChadS16E 14°19'34″N 9°36'30″31465.8±5.820.4±2.21.45±0.040.22±0.01S17E 15°29'30″N 9°35'54″36342.9±3.834.8±2.10.65±0.030.13±0.01S18E 15°38'17″N 9°19'41″40053.6±5.224.7±0.31.40±0.090.36±0.01S19E 16°9'17″N 8°31'25″468212.3±6.69.9±1.42.22±0.020.61±0.00S20E 16°21'12″N 9°22'45″36646.9±4.533.5±1.70.90±0.030.11±0.01S21E 17°4'44″N 8°38'16″39081.3±4.218.9±3.12.14±0.130.17±0.01S22E 17°26'45″N 9°1'12″38746.4±3.532.3±0.41.11±0.040.12±0.01S23E 18°2'19″N 9°3'56″418109.5±5.610.3±0.82.03±0.120.50±0.05SudanS24E 28°26'55″N 7°17'19″47392.8±5.611.8±2.62.35±0.170.43±0.01S25E 30°31'27″N 6°34'57″47172.7±4.722.2±2.61.48±0.040.21±0.01UgandaS26E 33°40'59″N 2°21'0″120357.7±5.424.5±1.81.50±0.030.45±0.02Troloxa6.9±0.2Mean107.6
aReference compound.TPC:Total phenolic contents;DPPH:1,1-Diphenyl-2-picrylhydrazyl;ABTS:2,2′-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid;FRAP:Radical scavenging activity and ferric-reducing antioxidant power
3.3 细胞毒活性
如表2所示,S1~S3,S5,S9,S10~S12,S15~S18和S22~S26等17个脱脂乳木果仁样品对HL60,A549和SK-BR-3中的一种或多种细胞表现出一定的细胞毒性,IC50范围在25.1~95.5 μg/mL,其中S11和S26 2个样品对实验中3种细胞均表现出细胞毒性,IC50在41.2~92.0 μg/mL范围间。因此,样品S11和S26提取物具有作为潜在抗肿瘤剂价值。结合课题组前期研究[6]发现,Tieghemelin A、Butyroside D、Arginine C、3-O-β-D-葡萄糖醛酸基-16α-羟基原椴树酸、3-O-β-D-吡喃葡萄糖基-16α-羟基原椴树酸、椴树酸、原椴树酸、3-O-β-D-葡萄糖醛酸基椴树酸和3β-(β-D-甲基葡萄糖醛酸基-2β,6β,23-三羟基-5,12-二烯-28-齐墩果酸等化合物对上述细胞中的一种或多种具有较为显著的细胞毒性,因此,脱脂乳木果仁中的三萜类成分是产生细胞毒的主要活性成分。
3.4 EBV-EA抑制活性
如表3所示,所有提取物质量浓度在100 μg/mL(提取物与TPA的重量比5 000∶1)时,可观察到Raji细胞均有较好的存活率(50%以上),提取物质量浓度在10和1 μg/mL时存活率几近100%,表明所有提取物对Raji细胞表现出较低的细胞毒性;同时,提取物质量浓度在100 μg/mL时均对EBV-EA具有显著的抑制作用(85.8%~94.9%)。其中,S3,S7,S15,S17,S19和S21~S23等7个样品即使在1 μg/mL质量浓度下也表现出一定程度的抑制效果(1.4%~7.0%)。目前已有报道,对EBV-EA的抑制作用与体内抑制促肿瘤过程相关[17],因此,上述7种脱脂乳木果仁提取物具有作为促肿瘤抑制剂的潜力。结合课题组前期研究[6]发现,椴树酸、原椴树酸、3-O-β-D-葡萄糖醛酸基椴树酸、3-O-β-D-葡萄糖醛酸基原椴树酸、3-O-β-D-葡萄糖醛酸基-16α-羟基原椴树酸、3-O-β-D-吡喃葡萄糖基-16α-羟基原椴树酸、3β[(β-D-甲基葡萄糖醛酸基]-2β,6β,16α,23-四羟基-12-烯-28-齐墩果酸、3β[(β-D-甲基葡萄糖醛酸基]-2β,6β,23-三羟基-5,12-二烯-28-齐墩果酸、Mi-glycoside I、儿茶素、表儿茶素和槲皮素等化合物具有显著的EBV-EA抑制活性,因此,脱脂乳木果仁中的三萜和黄酮类成分是EBV-EA抑制的主要活性成分。

SampleCytotoxic activity/IC50(μg/mL)HL60A549SK-BR-3S175.2±3.3>100>100S290.9±7.4>100>100S372.2±3.6>100>100S4>100>100>100S588.7±3.9>100>100S6>100>100>100S7>100>100>100S8>100>100>100S976.6±6.2 IC50>100>100S10>100>10053.9±1.2S1168.3±4.777.8±7.292.0±6.8S1240.3±5.6>10093.2±7.9S13>100>100>100S14>100>100>100S15>10050.7±5.286.6±1.3S1653.8±6.5>100>100S1771.7±7.0>100>100S1825.1±4.0>10095.5±6.5S19>100>100>100S20>100>100>100S21>100>100>100S2294.9±3.9>100>100S2337.6±3.4>100>100S2473.6±3.4>10051.1±6.6S2566.6±6.1>10073.3±3.21S2642.2±4.279.7±2.441.2±5.0Cisplatin1.3±0.35.5±2.45.6±2.0

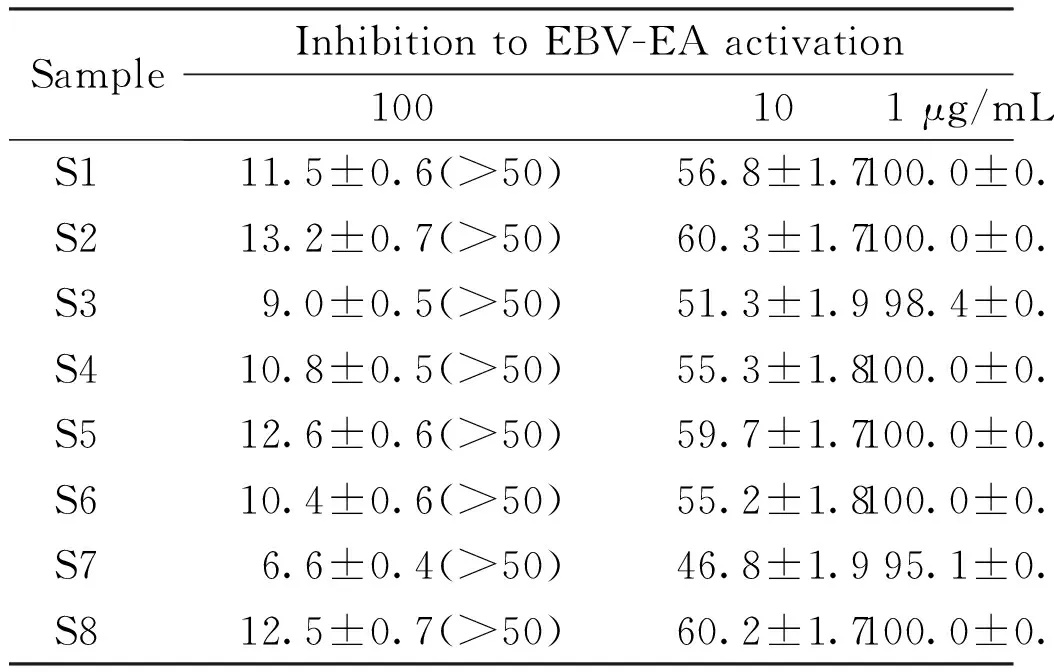
SampleInhibition to EBV-EA activation100101 μg/mLS111.5±0.6(>50)56.8±1.7100.0±0.5S213.2±0.7(>50)60.3±1.7100.0±0.4S39.0±0.5(>50)51.3±1.998.4±0.6S410.8±0.5(>50)55.3±1.8100.0±0.5S512.6±0.6(>50)59.7±1.7100.0±0.4S610.4±0.6(>50)55.2±1.8100.0±0.5S76.6±0.4(>50)46.8±1.995.1±0.7S812.5±0.7(>50)60.2±1.7100.0±0.4
(Continued)

SampleInhibition to EBV-EA activation100101 μg/mLS96.9±0.4(>50)58.6±2.2100.0±0.5S1013.8±0.6(>50)61.5±1.7100.0±0.4S1112.5±0.6(>50)58.4±1.7100.0±0.4S129.3±0.5(>50)53.0±1.7100.0±0.5S1313.2±0.6(>50)58.6±1.6100.0±0.4S1411.5±0.6(>50)57.8±1.5100.0±0.5S157.5±0.5(>50)48.4±1.994.1±0.6S169.6±0.6(>50)52.7±1.7100.0±0.5S178.6±0.6(>50)50.4±1.896.3±0.5S188.0±0.5(>50)50.0±1.9100.0±0.5S195.1±0.4(>50)44.1±1.993.0±0.7S2010.5±0.6(>50)54.6±1.7100.0±0.5S217.8±0.5(>50)45.7±1.998.6±0.5S227.2±0.5(>50)45.2±1.898.0±0.5S236.8±0.5(>50)44.5±1.995.7±0.6S2413.9±0.7(>50)59.3±1.6100.0±0.4S2514.2±0.7(>50)60.7±1.5100.0±0.4S2610.7±0.6(>50)55.3±1.7100.0±0.5
3.5 相关性分析
如表4所示,TPC与DPPH自由基清除活性有显著的负相关关系(r=-0.750,P<0.01)、与ABTS自由基清除活性有显著的正相关关系(r=0.837,P<0.01)、与FRAP有显著的正相关关系(r=0.833,P<0.01),表明提取物的抗氧化活性主要来源于其中的酚类物质,与其他学者报道的一致[18-19]。而TPC与EBV-EA(100 μg/mL)的抑制作用无相关性(r=-0.059,P>0.05),表明提取物中的酚类物质不是产生EBV-EA抑制作用的主要活性成分。基于提取物中酚类成分对HL60,A549,SK-BR-3和10、1 μg/mL质量浓度下的EBV-EA抑制无明显的生物活性,本文未讨论TPC与它们间的相关关系。
4 讨 论
乳木果在非洲当地资源丰富,属重要的“药食同源”植物,生活中被广泛使用。研究已发现[6,20],它具有较多良好的生物活性,如:抗炎、抗氧化等,并应用于抗炎抗敏功效的药妆品中。本文首次研究了亚撒哈拉非洲地区26个不同产地脱脂乳木果仁的TPC及抗氧化、细胞毒和EBV-EA抑制活性。实验结果显示,来自于亚撒哈拉非洲26个不同产地的脱脂乳木果仁甲醇提取物的TPC、抗氧化活性、细胞毒性和EBV-EA抑制活性各有不同,其中的部分产地提取物或表现出较强的抗氧化活性,或表现出较强的对人肿瘤细胞增殖的抑制活性,或表现出较强的EBV-EA抑制活性,表明植物生长的地理环境(包括不同经度、纬度和海拔等)因素对植物的化学成分种类与含量有着一定的影响,进而造成其TPC与生物活性的差异。
Table4 Pearson′s correlation coefficients (r) between TPC and antioxidant (DPPH,ABTS,FRAP) and EBV-EA activation inhibitory activities (100 μg/mL)

ParameterTPCDPPHABTSFRAPEBV-EA(100 μg/mL)TPC1DPPH-0.750**1ABTS0.837**-0.853**1FRAP0.833**-0.670**0.816**1EBV-EA (100 μg/mL)-0.0590.0250.035-0.1341
**P<0.01
此外,由于植物成分多而复杂,且成分间的协同作用难以说明,所以有必要对脱脂乳木果仁化学成分进行更加全面、系统的研究,并对细胞毒和EBV-EA抑制活性的作用机制作深入探讨;基于不同产地来源脱脂乳木果仁化学成分与生物活性上的不同,可采用化学计量学等方法比较其质量差异,有利于建立可靠的质量控制方法,为脱脂乳木果仁质量标准制定提供重要的依据。工业生产中的脱脂乳木果仁除了作为燃料外,常常被当作工业废料丢弃,结合本研究结果,生物活性较好的脱脂乳木果仁具有作为抗氧化剂、抗肿瘤剂和肿瘤化学预防剂的潜力,可为脱脂乳木果仁废弃资源在功能性食品和药用方面的开发奠定研究基础。

