钙测定试剂盒国家监督抽验质量分析
游延军 ,陈 蕊 ,蒲小聪 ,张向崇,王刚林 ,许 欣
(1.四川大学华西公共卫生学院,四川 成都 610041; 2.四川省食品药品检验检测院,四川 成都 611731;3.重庆市医疗器械质量检验中心,重庆 401147)
目前血钙离子浓度常用分光光度法检测,需要合适的金属指示剂或能选择性结合钙离子后引起变色的染料化合物,较常用的染料有邻-甲酚酞络合酮(OCPC)、偶氮胂Ⅲ[1]等。临床常用钙测定试剂盒体外定量测定人血清、血浆或尿液中钙的含量,从而对可疑疾病进行辅助诊断[2-5]。然而,部分钙测定试剂盒由于生产工艺缺陷、原料来源问题或产品研发不完善等因素,造成其产品性能欠佳。另外,国内大部分企业尚未形成自己系统的质量溯源体系,只追求在临床比对结果上能和国外产品吻合,而未在标准品和临床参考值范围上进行深入研究,导致在临床检测样本时可能会报出错误检验结果或无法进行实验室间结果互换,影响患者的诊断、治疗及预后。为了加强医疗器械的监督管理,维护器械市场秩序,促进行业发展,确保产品安全有效,原国家食品药品监督管理总局于2016年将钙测定试剂盒纳入国家监督抽验品种。四川省食品药品检验检测院参与了整个检验过程,现将抽验情况及结果报道如下。
1 材料与方法
1.1 仪器与试样
仪器:7100型全自动生化分析仪(日本Hitachi公司,精度为0.000 1A);611VF型超纯水仪(德国赛多利斯公司);KJMR-Ⅱ型血液混匀仪(江苏康健医疗器械有限公司);移液枪(德国 Eppendorf公司,5 ~1 000 μL)。
样品(评估基础):2016年从北京、河北、吉林、江苏、安徽、山东、上海、浙江、江西、河南、湖北、湖南、广东、广西、重庆、四川等地抽取有效样品52批,均为国产试剂(见表1)。参考品包括钙国际有证参考物质(美国NIST标准品,批号为SRM-915b),各试剂盒配套质控品或抽样时企业提供的工作校准品或主校准品,英国RANDOX公司生化质控血清(水平2,批号为1029UN;水平3,批号为616UE)。
1.2 检验依据和方法
1.2.1 法定检验
按照企业产品注册标准或技术要求,采用企业参考品校准,对各试剂进行检测,检验项目包括准确性、重复性和线性范围。各项目限度要求参见各标准或技术要求。试验中操作步骤严格按照各自试剂盒标准或产品技术要求及说明书进行。

表1 52批样品来源
重复性:同一样本不同的测量结果将影响医疗机构报告结果的可信程度。重复测定待测血清10~20次,计算批内变异系数(CV)。造成该项目不合格的原因可能包括试剂分析灵敏度低、仪器性能不稳定等。
线性范围:在规定范围内,计算样本测定值与标示值作回归分析后的相关系数及偏差程度。考察产品的线性范围是否满足临床高值样品的测试需求。取高浓度样本,按一定比例稀释成不同浓度(需涵盖性能指标的要求范围),每个浓度测定2~3次,计算测定结果的平均值,以稀释浓度为自变量,以均值为因变量,求出线性回归方程。计算线性回归的相关系数(r),将稀释浓度代入线性回归方程,计算其估计值、线性绝对偏差和相对偏差。线性不合格,可能导致临床高值样品的测试结果偏低,原因可能包括试剂反应底物不足、试剂失效等。
准确性:取标准物质或具有溯源性的有证参考物质(CRM),用待测试剂盒测定3次,根据靶值分别计算相对偏差。或通过比对试验(40例不同范围浓度的人源样本)计算和已上市试剂盒的相关性,或通过回收试验计算其回收率。准确性不合格可能引发测量值与真值偏离过大,原因可能包括试剂校准误差大、试剂特异性差、校准溯源链不佳、储存运输过程中校准品浓度变化等。
1.2.2 探索性检验
由于目前上市产品的企业标准指标要求差异性较大,本次探索性研究参考钙测定试剂(盒)行业标准[6],并采用统一的样品钙国家标准品[有证标准物质代号分别为 GBW(E)90621,GBW(E)90622,GBW(E)90623],对各个试剂盒的准确性和重复性进行评价。
2 结果
2.1 法定检验
本次共抽验全国范围内52家生产企业的52批产品,检测结果符合标准。其中1个批次线性范围与准确性均不合格,总体产品质量情况尚可。详见表2。
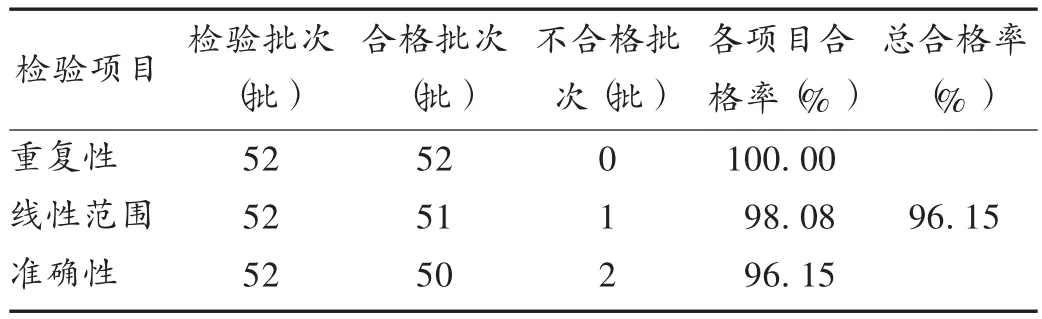
表2 法定检验抽验结果
2.2 探索性研究
准确性:采用前述3种国家标准品(标示值依次为1.90,2.47,2.89 mmol/L 的参考品)测试,准确性试验多能达到标准[6]中相对偏差应不大于5%的要求,剔除2家不合格样品[一家结果显著偏离,且其质控品也不在质控范围,证实为试剂失效;另一家结果偏低,其质控品虽在质控范围内,但偏低],结果见表3。以国家标准品GBW(E)90622为例进行观察,50批样品中有39批结果在±5%范围,符合率为78.00%,详见图1。标准品GBW(E)90621及 GBW(E)90622符合率较高,GBW(E)90623 符合率低,可能与其浓度(2.89 mmol/L)高有关。
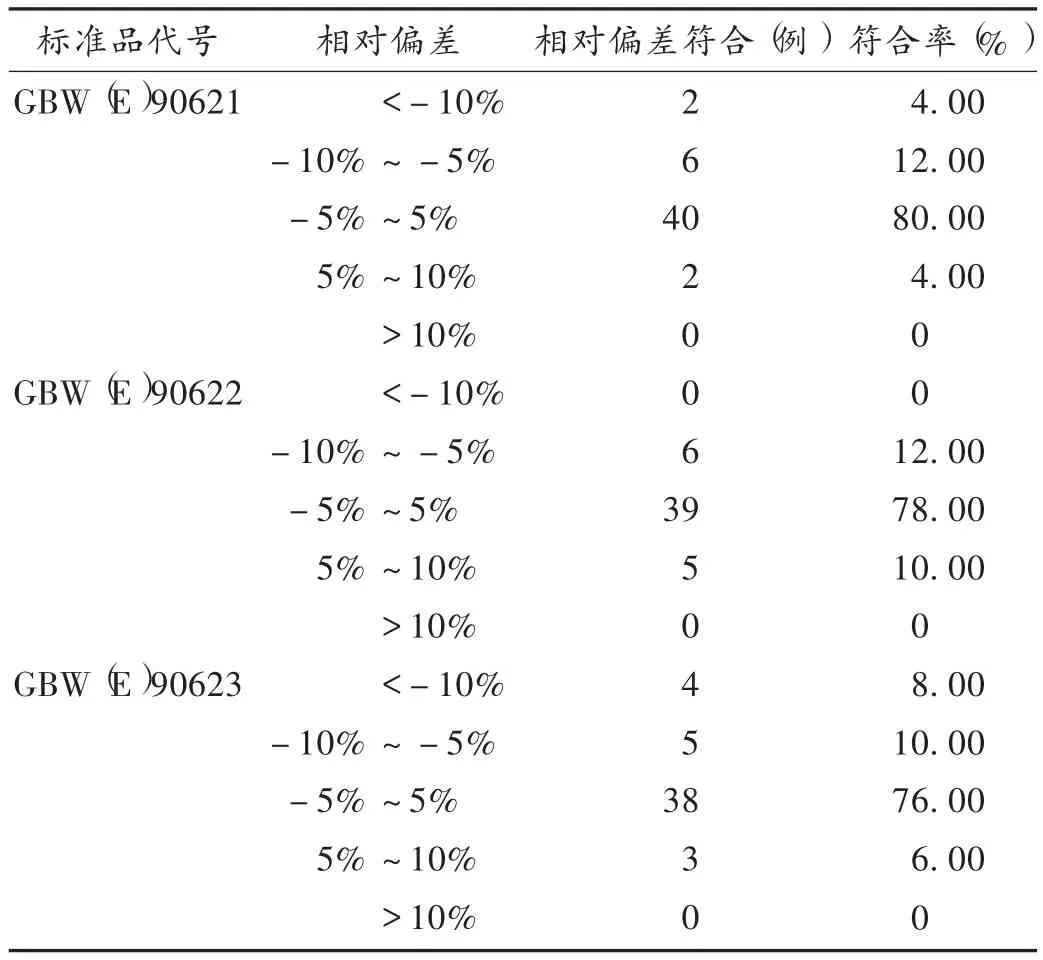
表3 探索性研究准确性结果分布(n=50)
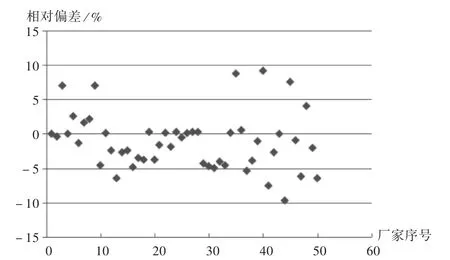
图1 探索性研究准确性结果[GBW(E)90622]分布图
重复性:以“准确性”研究中3种代号及标示浓度国家标准品测试,结果绝大多数标准品符合标准[6]中CV应不大于3.0%的要求。低、中、高浓度标准品重复性试验符合率分别为 96.00%,98.08%,98.08%。CV范围分别为0.43% ~5.33%,0.34% ~3.92%,0.34% ~3.61%。
3 讨论
3.1 现状与问题
国产钙测定试剂盒大部分产自北京、上海、浙江、广东、江苏等地,国产注册证现有159个,进口注册证现有62个。国产注册产品检验方法中约95种为偶氮胂(砷)Ⅲ法,占总量的59.75%;其余约30种为邻甲酚酞络合铜法,占总量的18.87%。此次国家监督抽验的结果只针对重复性、线性范围及准确度3个项目,依据各自企业标准的技术要求进行判定,并对检测结果进行分析,发现以下问题。
术语描述不统一:各企业标准或技术要求中3项指标描述不统一,措辞不严谨,如重复性有的定义为精密度、批内精密度等,线性范围定义为线性、测定范围、线性误差等;准确性定义为准确度、正确度等。虽然以上表述很大程度上不会误导检测人员的认知,但建议企业在确定检测指标时尽量依据行业或国家标准,严谨用词。
性能指标要求和试验方法不统一:本产品既有国家标准[7],又有行业标准[6]。在技术指标和试验方法上均有较好的对照,企业可根据自身产品的技术特点制订相应指标,但不得低于国家标准、行业标准的要求,企业应适时跟踪行业标准制订的动态,不能停留在首次注册时,当有新标准发布时,就应适时调整本企业的技术要求。如有不适用条款,企业可在标准的编制说明中描述理由。
1)线性区间:线性区间与相对偏差或绝对偏差的制订,各企业标准存在较大差异。多数线性上限在4mmol/L附近,低的为 3.75 mmol/L,而有的高达 6 mmol/L。线性下限有规定为 0,也有规定为 0.6,1,1.25 mmol/L。相对偏差,有的要求10%以内,也有的要求15%以内,有的甚至不作误差要求,绝对偏差要求的分段点与绝对偏差限度要求也不尽相同,有的要求绝对误差最大限度为 0.2 mmol/L,有的要求为 0.1 mmol/L,而有的甚至要求为0.05 mmol/L,显然过于严格,因为已经达到试剂盒与仪器的检测极限。
2)重复性:测定的样本浓度值范围和检测测试数均不统一。提供的质控品,有的仅有1个水平,有的有3个水平;测试次数10~20次。对于CV要求不一,3% ~10%均有。对于同一个结果,检测时要求严格的就不合格,而要求宽松的就合格,有失公允。
3)准确性:部分企业未能按照行业标准要求进行拟订。有的用商业质控品、商业校准品代替有证参考品进行检验;也有些企业采用通用校准品、盒内自带校准品等,个别企业盒内校准品赋值不准确或贮存稳定性等问题,均会导致结果偏差较大,从而误导临床使用。
3.2 思考与建议
通过对本次监督抽验结果的分析发现,按照企业注册产品标准或技术要求,使用其自身规定的质控品、工作校准品等,国产钙测定试剂盒准确性达96.00%,重复性达100.00%,总体质量尚可。但是统一使用钙测定试剂盒行业标准及同一国家标准品时,准确性则直降为78.00%,重复性降为96.00%。由企业提供企业参考品又根据其自己规定的注册标准或技术要求进行检验,产品质量看似合格,但不符合常规的行业标准,如运用于临床,则会增加对疾病诊治的误判风险。检验机构检测时也无法有效确认企业参考品信息的真实性,目前一般是企业提供自己的校准品的溯源性资料,通过资料检查,判断其溯源性是否符合要求,而数据是否真实、有效,不得而知。需要结合药监部门现场检查,查看研发记录、仪器使用记录、检验记录等,否则很难进行合理的监督和管理。进行注册检验或出厂检验时,建议采用国家或国际参考品,以控制试剂的质量。国家或国际参考品来源明确,溯源链可被追查、验证,标示值的不确定度也较为合理,参考品大多是经过参考方法定值或经多种方法验证或多个参考试验室的协作标定的,溯源性强,判断产品质量也更科学、客观、公正[8-9]。
因此,建议将体外诊断试剂盒作为国家监督抽验或省级监督抽验的一项常规性工作[10],对可能出现的风险点进行预判,对性能指标不合格的企业进行警告或处罚,以及通过临时性飞行检查等措施,督促企业投入更大的研发及检测力度,促使产品质量提升,经过整改后再次进行钙测定试剂(盒)的监督抽验,或通过追踪抽验的方式来动态评价该产品的质量,从而达到较高的质量水准,以保障人民群众用上安全、可靠的医疗器械[11-12]。

