14个品种(系)平欧杂种榛抗寒性比较1)
李嘉诚
(新疆农业大学,乌鲁木齐,830052)
罗达 宋锋惠 史彦江 马合木提·阿不来提 古丽米热·卡克什
(新疆林业科学院经济林研究所)
Through studying the cold resistance of hybrid hazelnuts introduced in Xinjiang, the varieties (lines) with strong cold resistance were filtered out for cultivation and production promotion. One-year twigs of 14 varieties (lines) of hazelnuts were introduced as test materials and subjected to low temperature treatment at -15 ℃, -20 ℃, -25 ℃, -30 ℃, -35 ℃, and -40 ℃. We measured the physiological and biochemical indexes of different variety (lines) hazelnuts. Under different low temperature treatments, the relative electrolyte permeability of 14 varieties (lines) of hazelnuts showed an “S” curve, which was significantly negatively correlated with the treatment temperature, and the semilethal temperature was between -28.38 ℃ and -33.05 ℃. At different low temperature conditions, the contents of malonaldehyde of 84-254, 84-226 were significantly lower; the free proline contents of 84-226, 84-254, 85-162 and 85-140 were relatively high; The germination rates of 84-254, 84-310, and 84-226 were significantly higher; relative electrical conductivity was significantly correlated with several other indexes. By membership function method combined with comprehensive evaluation of cold resistance, the cold resistance order of different variety (lines) hazelnuts from high to low was 84-254, 82-3, 84-226, 84-310, 84-72, 85-140, 84-5, 85-41, B-11, 82-11, 82-8, 85-162, 85-202, and 84-48. The physiological biochemical indexes and membership function method had high reliability in evaluating the cold resistance of the Corylus heterophylla Fisch.×Corylus avellana L..
平欧杂种榛(CorylusheterophyllaFisch.×CorylusavellanaL.)是由我国原产的平榛(CorylusheterophyllaFisch.)与外来引进的欧洲榛(C.avellanaL.)种间远缘杂交选育出的优良栽培种。它集中了欧洲榛和平榛的优良遗传基因,既有平榛的抗寒特性及独特的口味,又具有欧洲榛的大果、丰产、出仁率高的特点[1]1-2。
新疆林业科学院自2001年开始陆续从东北地区引进平欧杂种榛,经过10 a多的引种、驯化、选育和栽培,现已形成以伊犁河谷和天山北坡为重点的平欧杂种榛种植区。然而,由于北疆地区冬季较长,温度较低,易出现极端低温及灾害性天气,影响了榛子产业的健康良性发展。因此,筛选抗寒性强的平欧杂种榛品种(系)对该区域的榛子规模发展具有重要意义。
果树的抗寒性评价,国内外学者已经提出了一些与抗寒性有关的生理生化指标,如:可溶性糖质量分数、丙二醛质量摩尔浓度、电导率等。果树的抗寒性是遗传基因综合作用的结果,单一指标评价果树抗寒性是片面的,用多个指标进行综合性评价才是科学的[2]。电导法是一种比较简便、快速测定植物抗寒性的方法,配合logistic方程求得半致死温度更能准确地反映植物所能忍受的低温胁迫温度,已广泛应用于多种植物,如枣[3]、苹果[4]、葡萄[2]、扁桃[5]等树种的抗寒能力鉴定。目前,平欧杂种榛抗寒性的鉴定方法及抗寒生理的研究鲜有报道。
笔者研究了新疆引进的14个品种(系)平欧杂种榛枝条在低温胁迫过程中相对电导率、可溶性糖质量分数、丙二醛质量摩尔浓度、游离脯氨酸质量分数、萌芽率等抗寒性相关指标的变化,确定不同品种(系)平欧杂种榛抗寒性强弱差异性及衡量抗寒能力的低温有效范围。其中4个品种(包括:82-11、84-254、84-226和84-310)和韩俊威等[6]研究确定的抗寒性强的品种(系)一致,通过隶属函数法对抗寒能力进行综合评价,以期为平欧杂种榛的抗寒性评价提供一种科学、正确、有效的鉴定方法。筛选出抗寒性较强的品种(系),为平欧杂种榛在伊犁河谷、天山北坡等新疆不同生态区域的生产推广提供理论依据。
1 材料与方法
1.1 材料
于2017年3月上旬采集种植于乌鲁木齐市安宁渠榛子资源汇集圃14个品种(系)平欧杂种榛枝条,包括:82-11、84-254、84-226、84-310、B-11、85-140、84-5、85-41、85-202、84-72、82-8、84-48、85-162和82-3。每个品种(系)选择3~5株树,每株树在东南西北4个方向分别选择3~5个粗度基本一致、无病虫害和木质化良好的1年生枝条。枝条剪口涂抹凡士林。按照品种(系)贴标签,装入自封袋,带回实验室,在冰箱中0~4 ℃储存待测。
1.2 方法
用清水将采集的1年生枝条冲洗干净后剪成20~30 cm的枝段,再用去离子水润洗3~5次,用吸水纸吸干,将剪口进行蜡封。每个品种(系)分为6份,置于可控超低温冰箱中进行人工低温处理。设定6个温度梯度:-15、-20、-25、-30、-35、-40 ℃,以田间温度(-15 ℃)为对照。在既定温度下处理12 h,取出后,测定各项生理生化指标,每个指标重复测定3次。
1.2.1 相对电导率测定
电解质外渗率(REC)的测定参照电导率法[7],将不同低温冷冻处理后的枝条剪成2 mm的小段,然后称取2 g试样投入三角瓶,并加入50 mL蒸馏水,浸泡24 h后,测定浸出液的电导率。然后放在水浴锅中煮沸1 h,静止冷却后测定其电导度,用百分比法计算供试样品的抗寒力。电解质渗出率计算公式为:相对电解质渗出率(Y)=(初电导值/终电导值)×100%。
1.2.2电解质渗透率的logistic方程及半致死温度(tL,50)的确定
式中:y1、y2、y3分别为实际测定值中等距离选取的3点。

按照直线相关方程组求出求出a和b。
②拟合度检验。

③tL,50的估算(拐点值的计算)。在数学上拐点即(d2y/dx2)=0。
则有abe-bx-b=0。

1.2.3 生理生化指标测定
可溶性糖质量分数测定参照蒽酮比色法[10]66-69,丙二醛质量摩尔浓度测定参照硫代巴比妥酸(TBA)法[11]111-112,游离脯氨酸质量分数参照酸性茚三酮染色法[11]111-112。
1.2.4 生长恢复试验
供试材料经不同低温处理后,用修枝剪在水盆中把枝条底端剪成斜面截口,每段枝条上保留6个芽。用0.3%的高锰酸钾溶液擦洗枝条剪口,按品种(系)做好标记,插入装有去离子水的玻璃瓶中。玻璃瓶直径5 cm、高度10 cm,水位的高度在3~5 cm,置于空气湿度为70%~80%,温度为20~25 ℃的温室中,使枝条恢复生长。大概2~3 d换1次去离子水,并剪去枝条发黑的部分。凡是能发生愈伤组织,能生根或萌芽,说明枝条仍然活着,芽鳞片错开,芽体萌大,统计萌芽率[12]72-75。
1.3 数据处理与分析
试验数据采用Excel2007进行数据处理、作图。利用相对电导率,配合logistic方程求出半致死温度。用SPSS19.0进行单因素方差分析(one-way ANOVA)、Duncan法差异显著性检验(α=0.05)和相关性分析,并根据隶属函数法综合各项指标进行抗寒性评价。
2 结果与分析
2.1 不同低温处理对不同品种(系)相对电解质渗透率的影响
随着温度降低平欧杂种榛各品种(系)的相对电解质渗透率均逐渐升高,在-25~-35 ℃时,上升幅度较大;在-35 ℃时,上升缓慢,变化曲线大体呈“S”型(图1)。14个品系的平欧杂种榛在不同低温处理下的相对电解质渗透率差异较大,说明各品种(系)间抗寒性存在差异。电导率与处理温度呈极显著负相关(P<0.01),这与前人的研究基本一致[3]。由表1可知,处理温度不同以及品种(系)间的差异性,致使相对电导率产生很大的差异。其中处理温度在-15~-30 ℃时,品种(系)间的差异性较大,说明低温胁迫下品种(系)间细胞破坏程度不同,使得相对电导率差异性较大。而当处理温度到达一定的程度时,细胞破坏程度变大,使得品种(系)差异性变小,说明组织细胞已经完全破坏。

图1 低温处理后不同品种(系)平欧杂种榛相对电导率变化
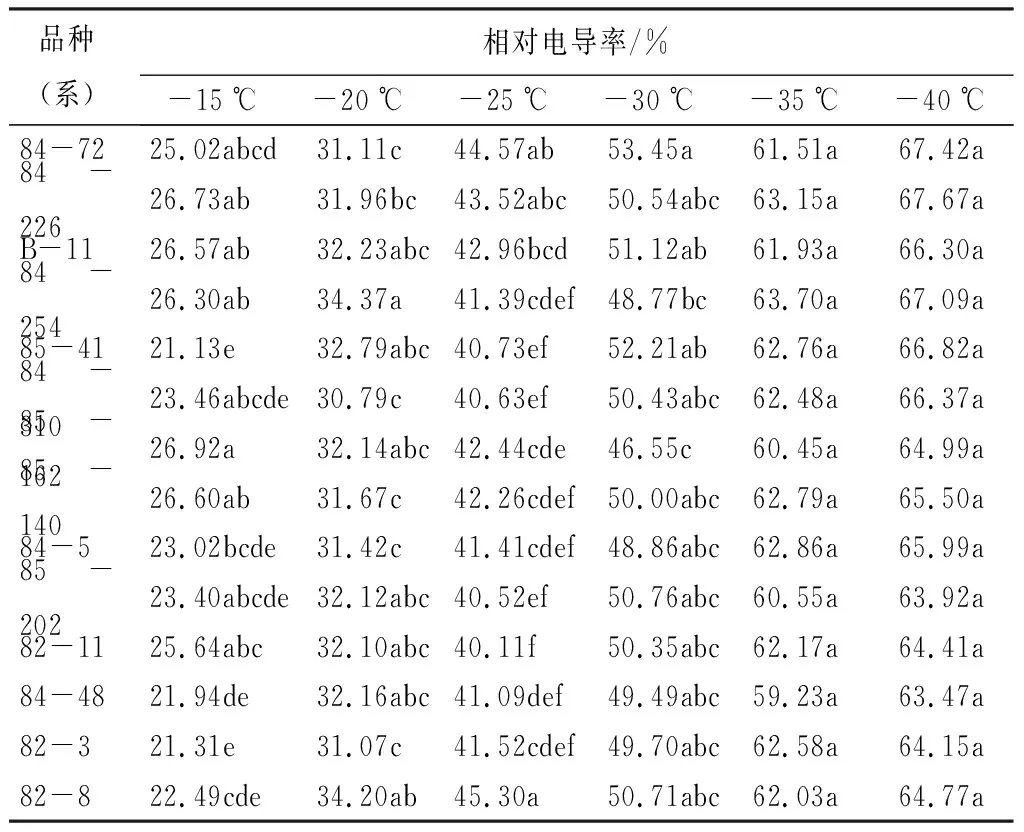
品种(系)相对电导率/%-15℃-20℃-25℃-30℃-35℃-40℃84-7225.02abcd31.11c44.57ab53.45a61.51a67.42a84-22626.73ab31.96bc43.52abc50.54abc63.15a67.67aB-1126.57ab32.23abc42.96bcd51.12ab61.93a66.30a84-25426.30ab34.37a41.39cdef48.77bc63.70a67.09a85-4121.13e32.79abc40.73ef52.21ab62.76a66.82a84-31023.46abcde30.79c40.63ef50.43abc62.48a66.37a85-16226.92a32.14abc42.44cde46.55c60.45a64.99a85-14026.60ab31.67c42.26cdef50.00abc62.79a65.50a84-523.02bcde31.42c41.41cdef48.86abc62.86a65.99a85-20223.40abcde32.12abc40.52ef50.76abc60.55a63.92a82-1125.64abc32.10abc40.11f50.35abc62.17a64.41a84-4821.94de32.16abc41.09def49.49abc59.23a63.47a82-321.31e31.07c41.52cdef49.70abc62.58a64.15a82-822.49cde34.20ab45.30a50.71abc62.03a64.77a
注:表中数字后同列不同小写字母表示在0.05水平差异显著。
2.2 不同品种(系)半致死温度的差异
利用相对电导率拟合logistic方程求得的半致死温度可反映植物在低温条件下对保持膜系统的稳定性和完整性的能力,进而反映植物的抗寒能力[8]。根据供试材料在不同低温处理下的相对电解质渗透率求得logistic回归方程、拟合度及半致死温度(见表2),14个品种(系)的半致死温度在-28.38~-33.05 ℃;拟合度均都大于0.950,均达到极显著水平(P<0.01);抗寒性的差异使得不同品种(系)间的半致死温度不同,半致死温度和抗寒性呈负相关的趋势,半致死温度越高,抗寒能力越差,反之则越强。根据该结果可将此14个品种(系)平欧杂种榛抗寒性大致分为2类:第1类为抗寒性较强的,tL,50在-30 ℃以下,包括84-72、84-254、84-310、85-140、84-5和82-11;第2类为抗寒性较弱的,tL,50在-30 ℃以上,包括84-226、B-11、85-41、85-162、85-202、84-48、82-3和82-8。
14个品种(系)平欧杂种榛按tL,50从低到高的顺序依次为:84-254、84-226、84-310、82-3、85-140、84-72、84-5、82-11、85-41、82-8、B-11、85-162、85-202、84-48。其中84-254表现最为抗寒,tL,50为-33.05 ℃;而84-48表现最不抗寒,tL,50为-28.38 ℃。
2.3 低温处理对不同品种(系)的平欧杂种榛丙二醛质量摩尔浓度的影响
根据表3所示,随着处理温度的降低,14个品种(系)的平欧杂种榛的丙二醛质量摩尔浓度均有上升的趋势,大多数品种的丙二醛质量摩尔浓度呈先升后降的趋势。在-15 ℃时,各品系间的丙二醛质量摩尔浓度在3.0~7.9 μmol/g的范围内,而在-20 ℃时丙二醛质量摩尔浓度普遍升高到8 μmol/g。在-25~35 ℃时,相对-15 ℃而言,上升幅度显著,说明温度对丙二醛质量摩尔浓度的影响显著。方差分析结果显示,低温胁迫和品种(系)间遗传特性的差异是影响丙二醛质量摩尔浓度的主要因素。84-254、84-310、85-140、85-202和84-48品种(系)在-30 ℃以下时丙二醛质量摩尔浓度达到最大值,而其余品种(系)在-30 ℃以上时,丙二醛质量摩尔浓度相对较高。丙二醛质量摩尔浓度的峰值出现的温度差异性也较大,达到峰值的温度越低,说明该品种(系)抗寒性越强,反之则越弱。

表2 不同品种(系)枝条相对电解质渗透率logistic方程参数及半致死温度
注:**表示拟合度达极显著水平(P<0.01)。
表3不同低温处理各品种(系)枝条丙二醛质量摩尔浓度变化

品种(系)丙二醛质量摩尔浓度/μmol·g-1-15℃-20℃-25℃-30℃-35℃-40℃84-724.81ab3.53c9.11abcde15.37ab11.42ab9.72b84-2263.82ab8.62a12.10abcd12.17abc13.26a14.47bB-113.95ab6.77d15.43a15.39ab16.76a13.92b84-2544.14ab7.16ab8.51bcde11.35abc17.26a13.82c85-416.40ab7.29ab13.10abc4.93c15.22a10.01b84-3103.61b5.19bc14.34ab18.40a18.58a19.43a85-1625.51ab6.61ab14.72ab18.93a15.45a12.22b85-1404.94ab6.86ab12.82abc12.56abc18.85a12.81b84-55.02ab8.75a9.63abcde17.21ab6.72b11.88b85-2024.68ab6.62ab12.85abc15.33ab18.57a9.71b82-115.27ab7.44ab6.17de13.91abc13.59a12.61b84-486.65ab7.58ab9.96abcde16.05ab19.11a10.88b82-35.12ab8.56a5.52e7.85bc11.71ab14.77b82-87.90a6.44ab7.21cde8.74abc11.45ab8.77b
注:表中数字后同列不同小写字母表示在0.05水平差异显著。
2.4 低温处理对不同品种(系)的平欧杂种榛可溶性糖质量分数的影响
从表4可以看出,随着温度的降低,14个品种(系)平欧杂种榛枝条的可溶性糖质量分数均呈现升降交替的趋势。总体来说,可溶性糖质量分数随着温度的降低,呈现上升的趋势,上升到一定程度后,开始降低。大部分品种(系)的可溶性糖质量分数峰值出现在-25 ℃和-35 ℃时,且-35 ℃出现的峰值相对要高于-25 ℃的峰值。当平欧杂种榛遇到低温胁迫时,需要提高可溶性糖质量分数来抵御逆境,从研究中发现不同品种(系)间的可溶性糖质量分数差异性较大。
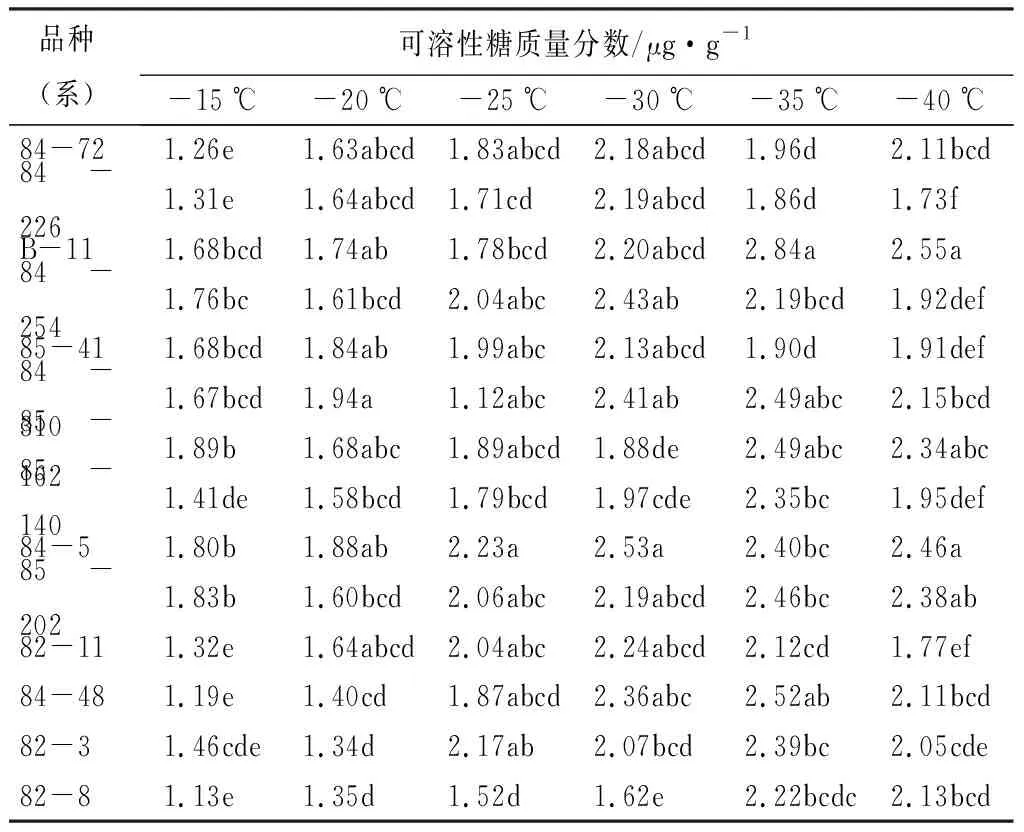
表4 不同低温处理各品种(系)枝条可溶性糖质量分数变化
注:表中数字后同列不同小写字母表示在0.05水平差异显著。
2.5 低温处理对不同品种(系)的平欧杂种榛游离脯氨酸质量分数的影响
从表5可以看出,14个平欧杂种榛品种(系)的游离脯氨酸质量分数的随着温度的降低,呈逐渐上升的趋势。在-15 ℃时,84-254和82-3的游离脯氨酸质量分数最大,分别为32.06、36.55 μg/g;84-41的游离脯氨酸质量分数最小,为23.18 μg/g。在-20~-40 ℃的游离脯氨酸质量分数相较-15 ℃都有不同程度的增加。方差分析可以看出,不同品种(系)的平欧杂种榛,在不同的温度条件下的游离脯氨酸质量分数差异均达到极显著水平(P<0.01)。可以看出,在不同温度处理下,84-226、84-254、85-162和85-140的游离脯氨酸质量分数相对较高,其抗寒性相对也较强;B-11、85-41、82-8和85-202的游离脯氨酸质量分数相对较低,随之抗寒性相对也较弱。其余6个品种(系)的游离脯氨酸质量分数介于上述两者之间,其抗寒性居中。
表5不同低温处理各品种(系)枝条游离脯氨酸质量分数变化

品种(系)游离脯氨酸质量分数/μg·g-1-15℃-20℃-25℃-30℃-35℃-40℃84-7226.35cd31.72e32.45f34.03f38.06g39.00d84-22625.70cd35.10cd39.13b40.21a39.54e40.66aB-1121.96d25.99f30.01h34.04f35.65k36.46i84-25432.06b36.88c36.61c40.50a41.44a40.54a85-4123.18cd27.21f31.24g35.26e36.07j35.26j84-31025.10cd33.16de33.96e36.51d40.54b37.32g85-16231.71b37.09bc40.38a40.51a37.29i38.90e85-14031.88b38.59ab39.67b40.66a39.86d38.25f84-525.72cd33.77d36.20cd40.22a38.94f40.15b85-20224.30cd31.01e33.83e37.86c40.14c38.12f82-1127.62bc31.20e32.54f36.57d37.95gh39.28d84-4830.86b34.89cd36.10cd40.13a40.36b36.90h82-336.55a40.13a40.66a39.47b37.86h38.26f82-823.36cd31.41e35.44d36.51d40.54b39.74c
注:表中数字后同列不同小写字母表示在0.05水平差异显著。
2.6 低温处理后不同品种(系)的平欧杂种榛枝条萌芽率的变化
恢复生长法是指植株或某些器官被人工冷冻处理后,在一定条件下让其恢复生长,通过鉴定其恢复生长的能力来判定其抗寒力的大小。植物受冻后是否存活,主要通过芽对冻害的敏感性反映出来[13]。从表6可以看出,随着低温胁迫的不断加剧,萌芽率持续降低,不同品种(系)间萌芽率的差异性较大,萌芽率较高的品种(系)抗寒能力较强。在-15~-25 ℃时萌芽率较高的品种有84-254、84-72、84-48、84-310、85-41、85-202和84-226,其余的品种(系)的萌芽情况相对较差或者极差,比如85-162、85-140的萌芽情况极差,大多温度梯度下的萌芽率都是0,说明持续低温胁迫对植物组织形成了不可逆的破坏。
2.7 相关性分析
根据表7所示,对14个品种(系)平欧杂种榛丙二醛质量摩尔浓度、可溶性糖质量分数、游离脯氨酸质量分数及相对电导率进行相关性分析。结果表明,丙二醛质量摩尔浓度、游离脯氨酸质量分数与相对电导率呈极显著正相关(P<0.01),相关系数达0.715和0.738。萌芽率与相对电导率呈极显著负相关(P<0.01),相关系数达-0.474。测定相对电导率是研究植物抗寒性最有效的手段,并运用logistic方程计算各平欧杂种榛半致死温度tL,50,以tL,50作为抗寒性的衡量指标。本研究中4个指标与相对电导率的相关性均达到极显著水平(P<0.01),说明除了传统的相对电导率和半致死温度测定评价平欧杂种榛抗寒性强弱外,丙二醛质量摩尔浓度、游离脯氨酸质量分数和萌芽率也可以作为评价平欧杂种榛抗寒性强弱的重要指标。

表6 不同低温处理各品种(系)枝条萌芽率变化
注:表中数字后同列不同小写字母表示在0.05水平差异显著。
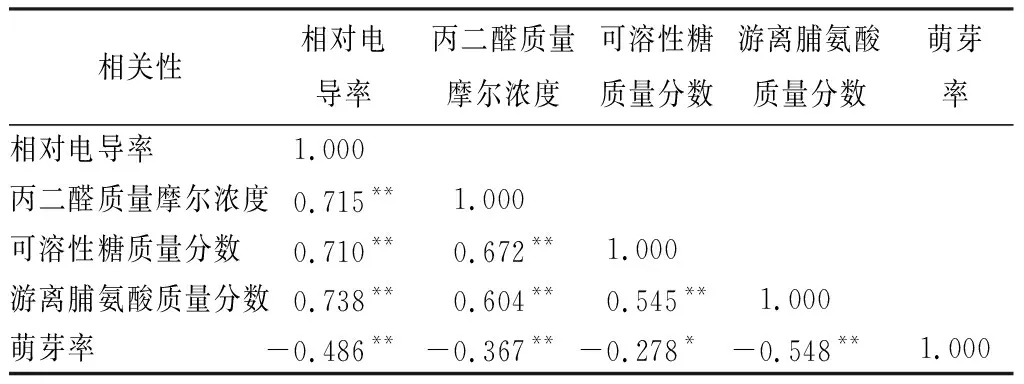
表7 4个指标与相对电导率的相关性分析
注:*表示在0.05水平上显著相关,** 表示在0.01水平上极显著相关。
2.8 隶属函数法对抗寒性的综合性评价
根据以上方差分析和相关性分析可知,游离脯氨酸质量分数等指标在不同品种(系)间的差异极显著,且与电导率呈极显著相关,可以有效地评价平欧杂种榛的抗寒性。以相对电导率、丙二醛质量摩尔浓度、游离脯氨酸质量分数、可溶性糖质量分数和萌芽率等作为依据,计算各指标的隶属函数值,并进行综合评价,结果见表8。抗寒性由大到小排列顺序依次为84-254、82-3、84-226、84-310、84-72、85-140、84-5、85-41、B-11、82-11、82-8、85-162、85-202、84-48。

表8 不同低温胁迫下平欧杂种榛隶属函数值
3 结论与讨论
果树的抗寒性综合评价是现代果树抗性育种工作的重要内容之一。果树的抗寒性是指果树在抵御低温环境的过程中,通过自然选择和本身的遗传特性获得的一种抗寒能力[14]。果树在抗寒过程中,每个抗寒性指标对果树的抗寒性都有一定的作用。植物受到低温胁迫后,细胞膜透性增大,电解质大量外渗,胞间物质浓度增大,使电导率值变大,抗寒性较强的品种(系)细胞受害程度相对较轻,膜透性增大程度低,且透性变化易恢复能力强;反之,抗寒性差的品种(系)膜透性增加程度较大,不易或者不能恢复[15]。Sukumaarn et al.[16]基于电解质外渗率的50%与半致死程度一致,提出以电解质外渗率50%时的温度为组织的半致死温度;而朱根海[7]等认为可以用logistic方程中拐点温度来确定植物组织的低温半致死温度。罗正荣等[17]对柑桔抗寒力研究表明,细胞电解质外渗率配以logistic方程,两者具有很好的拟合度。本研究测定发现相对电解质渗透率配合logistic方程回归分析,以拐点温度表示植物半致死温度更为准确。根据相对电导率与温度的关系拟合logistic方程,推算出植物的半致死温度(tL,50)被广泛用作植物抗寒性评价的一个重要方法[18]。采用此方法确定14个品种(系)平欧杂种榛按tL,50从低到高的顺序依次为84-254、84-226、84-310、82-3、85-140、84-72、84-5、82-11、85-41、82-8、B-11、85-162、85-202、84-48。这与采用隶属函数分析法所得的综合评价试验结果基本一致,只有少部分品种(系)顺序有差异。
丙二醛是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度。丙二醛从膜上产生的位置释放出后,可以与蛋白质、核酸反应,改变这些大分子的构型或产生交联反应,从而丧失功能,还可使抑制蛋白质合成[10]。在低温处理过程中,抗寒性弱的材料丙二醛质量摩尔浓度显著上升,从而加剧细胞膜脂过氧化程度;反之,抗寒性强的材料则有一定的调节能力,使丙二醛质量摩尔浓度维持在相对较低水平,使细胞结构及功能得到保护,降低了低温对细胞的伤害[19]。在相同的胁迫条件下,丙二醛质量摩尔浓度相对低的品种抗寒性更强[20]。因此,在本试验中84-254细胞受伤害最小,抗寒力最强;84-48细胞膜受伤寒相对较重,抗寒性最差。
植物体内重要的渗透调节物质主要是游离脯氨酸、可溶性糖等,在低温逆境条件下,它们的大量积累有助于减轻低温对植物的伤害[21]。可溶性糖是植物抗寒性的主要保护物质,可以提高细胞液浓度,使冰点降低,保护细胞质胶体不致遇冷凝固。抗寒性强的植物,在低温时其可溶性糖含量比抗寒性弱的高[22]290-291。游离脯氨酸是细胞中一种比较特殊的氨基酸,具有高度水溶性。游离脯氨酸能促进蛋白质水合作用,蛋白质亲水面积增大,能使可溶性蛋白质沉淀,在植物处于低温胁迫时,使植物具有一定的抗性和保护作用。从表6可知,相对电导率与萌芽率呈极显著负相关,说明植物的萌芽率与抗寒性呈正相关。萌芽率高的品种(系),抗寒性相对较强;反之,则弱。本研究表明,在同等温度条件下,84-254、84-226等品种的可溶性糖质量分数、游离脯氨酸质量分数及萌芽率,相对其他品种(系)较高,说明其抗寒性优于其余品种(系)。研究显示相对电解质渗透率呈上升趋势,这与Lyons[15]的研究结果基本一致。随着温度的降低,各品种(系)枝条的丙二醛质量摩尔浓度总体呈上升的趋势,这与段肖翠[23]的研究基本一致。随着低温胁迫的加深,各品种(系)枝条可溶性糖质量分数、游离脯氨酸质量分数总体上呈现先上升趋势,这表明品种(系)通过可溶性糖、游离脯氨酸来增强抗冻能力;随着处理温度能进一步降低,可溶性糖质量分数、游离脯氨酸质量分数呈下降趋势,调节能力降低,这与冯献宾等[24]和崔红等[25]的研究基本一致。
植物的抗寒生理过程错综复杂,受多种因素的影响,同时,植物抗寒能力评价标准具有多样性,不同学者研究得出的结果具有一定的差异,为了准确判断植物的抗寒性需参考不同的鉴定方法进行综合比较分析[26]。植物体抗寒机制非常复杂,影响其抗寒性的因素较多,因此产生了多种测定植物抗寒性的方法。目前,国外测定木本植物抗寒性的主要方法有电解质渗出率法、全株冰冻测试法、叶绿素荧光法、热分析法等,国内在形态结构、膜脂的成分及蛋白质、抗寒生理生化、抗寒基因等方面的研究已取得显著进展[2]。本研究运用隶属函数法综合评价分析平欧杂种榛的抗寒性,得出其抗寒性从大到小排序为84-254、82-3、84-226、84-310、84-72、85-140、84-5、85-41、B-11、82-11、82-8、85-162、85-202、84-48。其中,84-254、82-3和84-310这3个品种(系)的低温抗寒能力较强,能适应一定的低温环境;85-162、85-202和84-48适应的低温有限。此外,本实验结果表明,82-11、84-254、84-226和84-310的抗寒性强于其他平欧杂种榛,与韩俊威等[6]的研究结果基本一致。这表明此类方法在测定平欧杂种榛抗寒性方面,具有很高的可信度以及正确性;但在具体评定平欧杂种榛抗寒性时,还应多方面综合评价,同时结合田间观察,才能使结果更加准确、科学。

