microRNA-193b和microRNA-141在脓毒血症休克小鼠组织中的表达变化及意义
汪潇潇,李雪,李如利,蒋维,3,吴思思
1.重庆大学 附属肿瘤医院/重庆市肿瘤研究所/重庆市肿瘤医院,肿瘤转移与个体化诊治转化研究重庆市重点实验室,重庆 400030;2.四川大学 生物治疗国家重点实验室,四川 成都 610041;3.四川大学 华西医院分子医学研究中心,四川 成都 610041;4.四川大学 华西医院公共实验技术中心,四川 成都 610041
脓毒血症是由感染或创伤等诱发的剧烈的全身性炎症反应,并引起组织器官继发性损伤的临床全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),进一步发展会出现多器官功能衰竭,危及生命,影响患者预后[1-3]。脓毒血症的发生机制非常复杂,近年的研究报道认为其与炎症反应调节失控密切相关,但具体调节机制尚不清楚[4-5]。因此,深入探讨脓毒血症的病理生理学机制,进而开发新的诊断和治疗手段是其研究的热点和难点[5-6]。
微小RNA(microRNA,miRNA)是一种非编码单链小分子RNA,长度约为22个核苷酸,存在于真核生物中。miRNA可通过特异性识别并结合其靶mRNA的3′非编码区,发挥抑制mRNA翻译或降解靶mRNA的作用,从而抑制靶蛋白质的合成,调节细胞活动[2-3]。研究表明,miRNA在机体的生理过程中发挥重要作用,包括参与生长发育、炎症反应调节及免疫应答等[7]。microRNA-193b(miR-193b)和 microRNA-141(miR-141)已被证实参与心血管疾病、肿瘤和感染等疾病的调控过程[8-12],但目前未见二者参与调节脓毒血症多器官损伤的研究。我们构建了小鼠盲肠结扎穿孔诱导的脓毒血症模型,观察miR-193b和miRNA-141的表达变化,探讨二者在脓毒血症休克中的病理生理学意义,为脓毒血症休克提供新的发病理论基础及治疗策略。
1 材料和方法
1.1 材料
20只8周龄野生型SPF级雄性C57BL/6小鼠购自四川大学实验动物中心,饲养于洁净的层流动物房内,温度、空气等条件符合标准。
TRIzol试剂、逆转录酶抑制剂(Invitrogen);Bio-Rad iTaq Universal SYBR Green Supermix;Bio-Rad DNAEngine;Bio-Rad CFX96荧光定量PCR仪;HiFiScript gDNA Removal cDNA Synthe⁃sis kit(CWBIO);罗氏COBAS INTEGRA 800全自动生化分析仪。
1.2 引物设计
根据miRNA序列设计引物,检测miR-141(miRBase Reference Sequence:MIMAT0000432-U AACACUGUCUGGUAAAGAUGG) 和 miR-193b(miRBase Reference Sequence:MIMAT0002819-A ACUGGCCCUCAAAGUCCCGCU),选择 U6(NCBI ReferenceSequence:NR_004394.1)作 为 定 量 内参。用茎环法设计以上miRNA逆转录引物,U6引物采用Primer 5软件设计。引物序列见表1,理论上荧光定量PCR扩增产物U6为94 bp,miR-141和miR-193b为34 bp。
1.3 脓毒血症休克小鼠模型建立[19]
小鼠用2% 戊巴比妥钠腹腔麻醉后,将其四肢固定于动物实验台,37℃保温,腹部去毛并消毒;腹部正中切开约1.5 cm,寻找、暴露盲肠;将盲肠轻柔牵出,置于无菌纱布上,用6-0号缝合丝线结扎回盲瓣下方,用19号无菌针头对结扎部分盲肠进行单孔穿刺,不对穿盲肠;将牵出的盲肠及其内容物复位回腹腔,用4-0号手术缝合线关闭腹壁切口;对照组腹部正中切口并暴露盲肠,但不进行结扎和穿孔;术后,于小鼠背部皮下注射1 mL生理盐水补液,放回笼中正常饲养。
1.4 小鼠血压测定及组织样本处理

表1 引物及序列
纳入本研究的小鼠随机分为对照组(n=10)和模型组(n=10)。采用盲肠结扎穿孔法构建脓毒血症休克模型后24 h,戊巴比妥(30 mg/kg)腹腔注射麻醉,颈部正中切口约1 cm,钝性分离并游离颈总动脉,结扎远心端,近心端切口,颈总动脉插管连接八导生理记录仪(iWorx公司),分别监测平均动脉压(mean arterial pressure,MAP)、收缩压(systolic blood pressure,SBP)、舒张压(dia⁃stolic blood pressure,DBP)、心率(heartrate,HR),随后经腹主动脉取血,血液以肝素抗凝后离心(4000 r/min,4℃)分离血浆,置-70℃保存待测。打开胸腹腔,取心脏、肝脏、肺和小肠组织,用无RNAase的水洗净后,立即加入TRIzol,剪碎,提取总RNA。
1.5 Real-time PCR检测组织miR-193b和miR-141的表达
提取对照和休克模型小鼠的心脏、肝脏、肺及小肠组织的总RNA,逆转录得到cDNA后,用荧光定量PCR引物进行Real-time PCR。
1.6 统计学处理
所有数据均以x±s表示,采用Prism 5软件进行统计学分析。2组间的比较采用Unpaired stu⁃dent′st-test进行统计学分析,组与组之间的差异进一步采用Newman Keulst-test进行统计学分析。P<0.05为具有统计学差异。
2 结果
2.1 休克小鼠的血压和心功能指标
在小鼠败血症模型实验中,盲肠结扎穿孔24 h呈休克晚期表现,可见小鼠萎靡、活动明显减少、毛发无光泽,心率、收缩压、舒张压、平均动脉压、血糖水平与对照小鼠相比分别下降20.9% (P<0.05)、37.9% (P<0.05)、25.8% (P<0.05)、32.9% (P<0.05)和58.7% (P<0.01),血乳酸水平则明显增加355% (P<0.01)(表2),且动物很快发生多器官衰竭死亡。

表2 对照和休克晚期小鼠的血压和心功能指标
2.2 脓毒血症休克时miR-193b在心脏组织的表达下降,在肝脏和肺组织的表达增加
采用Real-time PCR检测对照组和模型组小鼠心脏、肝脏、肺及小肠组织中miR-193b的表达变化,结果如图1。与对照组相比,模型组小鼠心脏组织中miR-193b的表达水平下降52.6% (P<0.05),肝脏和肺组织中miR-193b的表达水平分别增加124.7% 和126.1% (均P<0.05),小肠组织中miR-193b的表达水平呈增加趋势,但无统计学差异。
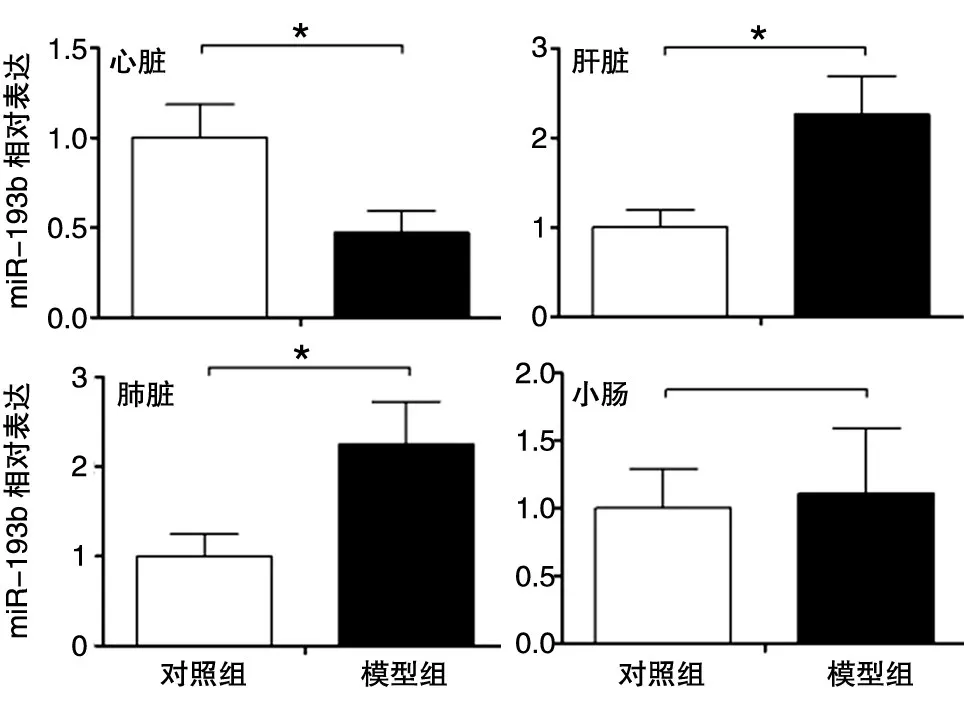
图1 miR-193b在对照和休克晚期小鼠心脏、肝脏、肺、小肠组织中的表达变化
2.3 脓毒血症休克时miR-141在肺和小肠组织的表达均增加
采用Real-time PCR检测对照组和模型组小鼠心脏、肝脏、肺及小肠组织中miR-141的表达变化,结果如图2。与对照组相比,模型组小鼠肺和小肠组织中miR-141的表达水平分别增加63.4% 和76.5% (均P<0.05),心脏和肝脏组织中miR-141的表达水平呈增加趋势,但均无统计学差异。
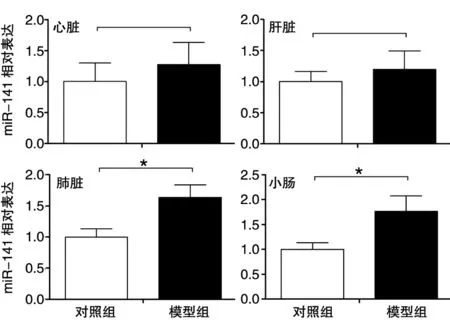
图2 miR-141在对照和休克晚期小鼠心脏、肝脏、肺、小肠组织中的表达变化
3 讨论
盲肠结扎穿孔诱导动物发生感染性休克的模型被广泛用于研究脓毒血症过程中全身多系统、多器官的病理生理学改变。脓毒血症是严重感染产生的一种全身性炎症反应,进一步可进展为急性呼吸窘迫综合征、感染性休克和多器官衰竭,其发生发展的重要机制之一是促炎细胞因子和抗炎细胞因子之间的失衡。脓毒血症发生时,机体释放促炎性介质,如IL-1、IL-2、IL-6和TNF-α等[4,13],引起过度促炎症反应,进而引起全身炎症反应综合征。脓毒症的发展机制包含多种细胞内及细胞间信号通路如核因子κB(NF-κB)通路、JAK激酶/信号转导和转录激活子(JAK/STAT)通路、丝裂原激活的蛋白激酶(MAPK)通路、磷脂酰肌醇3激酶(PI3K/Akt)通路、胆碱能抗炎通路等及其下游的分子[4]。我们的研究发现,与对照小鼠相比,盲肠结扎穿孔处理的小鼠在术后24 h呈现休克晚期表现,心率和血压下降,代谢发生紊乱,血糖水平降低,血乳酸水平增加,提示心功能障碍,组织缺血缺氧,以无氧酵解为主。这些研究结果表明,感染性休克晚期出现了以心血管功能障碍和代谢紊乱为特征的多器官损伤[14]。目前,阐明脓毒血症的病理生理学特征及其发病机制,寻找新的诊断及治疗靶点已经成为感染性休克研究的热点和难点[4,15]。
miRNA通过影响转录后水平参与调控多种炎症因子相关基因、转录因子的表达与抑制,各种炎症因子受体的表达,各种细胞因子及炎性介质的产生、释放,进而调控脓毒血症导致的全身失衡的炎症反应[4,9,15-16]。已有报道表明miRNA可以微调炎症通路中的多个靶点进而调控炎症[9],且已证实多个miRNA参与炎症的调控[3]。在细菌和病毒刺激时,miR-155均可被激活,调节机体的免疫反应[17]。miR-146a也在脓毒血症发病过程中发挥着调控免疫和炎症的重要作用[18]。此外,miR-146a、miR-150和miR-223的表达水平均可在一定程度上反映机体炎症反应的状态,可作为脓毒血症预警、诊断和治疗的血清标志物。
miR-193b最初被发现参与肿瘤的转移调控。炎症发生时,人体脂肪细胞中过表达miR-193b显著抑制趋化因子2和TNF-α的表达,进而减少促炎脂肪因子的分泌,促进具有抗炎作用的脂联素的分泌[14]。miR-141是miRNA-200家族成员,参与不同肿瘤的调节,影响肿瘤细胞增殖、转移、浸润。卵巢癌中,miR-141通过P38调节氧化应激。目前尚不清楚miR-193b和miR-141在脓毒血症中的作用及其调节机制[10]。本研究观察到脓毒血症休克晚期时,miR-193b在心脏组织中表达下降,而在肝脏和肺组织中的表达水平增加,提示不同组织的miR-193b对感染性休克的反应性不同,即受miR-193b调节的靶蛋白可能在心脏中表达增加,而在肝脏和肺组织中的表达降低。同时,感染性休克晚期miR-141在肺和小肠组织的表达均增加,提示受miR-141调节的靶蛋白可能在肺和小肠组织中的表达降低。我们的研究表明miR-193b和miR-141的表达水平在感染性休克晚期小鼠的不同受累组织中发生明显变化,初步证实它们参与脓毒血症的病理生理调节,其可能的机制是在转录后水平调节其下游与炎症相关的靶蛋白的表达,进而影响各种炎性细胞因子的生成和释放,从而实现对炎症反应的调控,但具体机制有待深入探究。我们通过检测感染性休克晚期小鼠不同受累组织中miR-193b和miR-141的表达水平,观察到miR-193b在心脏中的表达下降,在肝脏和肺中的表达增加,而miR-141在肺和小肠中的表达均增加。结果提示miR-193b和miR-141可能参与脓毒血症受累器官的功能调节,是感染性休克防治的潜在新靶点。

