清肝祛湿活血方对非酒精性脂肪肝大鼠肿瘤坏死因子α及肝脏组织的影响*
张玉香 ,王一强 ,姜德民 ,王凤丽 ,史晓伟 ,陈有源 ,王俊喹 甘肃省中医学校,甘肃 兰州 70050;甘肃省中医院;兰州市安宁区医院;西和县中医院
非酒精性脂肪肝(non-alcoholic fatty liver,NAFLD)是肝细胞性肝硬化的重要病因[1-2]。近年来,发病率呈逐年上升趋势[3-4]。而中医药在治疗NAFLD方面起到越来越重要的作用,主要作用机制为调节脂肪组织分泌和储存、改善胰岛素抵抗、调节氧化应激等[5],具有多靶点治疗、安全可靠的特点。清肝利湿活血方为王俊喹经验方,用于治疗肝经湿热瘀阻型NAFLD。前期临床研究[6]表明,其具有改善NAFLD患者临床症状,降低体质指数、腰围,改善肝功能和胰岛素抵抗,调节血脂代谢的作用。本研究采用高脂饮食建立NAFLD大鼠模型,观察清肝祛湿活血方对NAFLD大鼠肿瘤坏死因子α(TNF-α)及肝脏组织病理形态学的影响,现报道如下:
1 材料与方法
1.1 实验动物 选取同批清洁级SD大鼠,雄性,90只,体质量130~170 g,由甘肃中医药大学动物实验中心提供,动物生产许可证号:SYXK(甘)2011-0001。
1.2 实验药物 清肝祛湿活血方药物组成:茵陈10g,郁金 10g,青葙子 10g,丹参 15g,夏枯草 10g,密蒙花10 g,垂盆草10 g。由甘肃中医药大学药学实验室制备中药煎剂。罗格列酮片(太极集团重庆涪陵制药厂有限公司生产,国药准字H20041399,规格4 mg/粒)。肿瘤坏死因子α(TNF-α)ELISA试剂盒均购自上海酶联生物研究所。
1.3 实验仪器 GS300型血糖仪(华广生技股份有限公司);OHAUS1/1000型电子天平(美国BECKANCOULTER公司);IX71-22FL/PH型倒置荧光显微镜(日本OLYMPUS公司);LKB-Ⅲ型超薄切片机(瑞典LKB公司);TC-120型生物组织自动脱水机(孝感泰维电子设备有限公司);HH-S型数显水浴箱(金坛医疗仪器厂);5417R型低温离心机(德国艾本德公司);TC-120型生物组织自动脱水机(湖北泰维电子设备有限公司)。
1.4 实验方法
1.4.1 动物分组与造模 将90只实验动物随机分为正常对照组,模型对照组,罗格列酮组,清肝祛湿活血方高、中、低剂量组,每组15只。大鼠适应性饲养7天,常规饮食,自由饮水。从第8天开始正常组给予普通饲料,连续60天;其余各组按照聂文山等[7]的造模方法,予高脂饲料(84%基础饲料+10%猪油+5%蛋黄粉+1%胆固醇)喂养1周后腹腔注射四环素(150 μg/g,然后每隔6天腹腔注射1次四环素)100 μg/g;分别于实验开始前及造模后第 6、12、18、24、30 天称量大鼠的体质量,依据造模大鼠体质量的变化改变给药量,造模时间30天。
1.4.2 给药方法 参考《药物试验方法学》[8],按照人与大鼠的体质量换算,大鼠的等效剂量为:生药11.25 g/kg。中药复方高、中、低剂量组依次为生药22.50、11.25、5.63 g/kg。将清肝祛湿活血方用蒸馏水配制成浓度为0.28、0.56、1.13 g/mL的溶液。根据文献[9]报道,罗格列酮组用药剂量为3mg/(kg·d)造模成功后大鼠平均体质量按200g/只计算,干预组各大鼠每日灌胃给药1次,每次4 mL。正常对照组与模型对照组分别给予蒸馏水灌胃,1/d次,4 mL/次。各组大鼠连续灌胃30天,末次灌胃24小时后处死并测定相关指标。
1.4.3 观察指标
1.4.3.1 TNF-α测定 实验前大鼠空腹至少8小时,经鼠尾采血5 mL,室温放置2小时后,离心15分钟,3 000 r/min,取上清液,放冰箱-20℃保存。TNF-α采用酶联免疫吸附法定量检测。
1.4.3.2 肝脏组织病理形态观察 处死大鼠,迅速摘取肝组织,并将肝脏浸泡于10%甲醛内固定,石蜡包埋,切片,进行常规HE染色。肝组织脂变程度判断标准。见表1。

表1 肝组织脂变程度判断标准
1.5 统计学方法 所有数据均经SPSS 19.0统计学软件进行处理,计量资料用(±s)表示,采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 血清TNF-α 罗格列酮致大鼠死亡1只,中药复方低、中、高剂量组分别死亡2只,2只及4只。血清TNF-α水平,与正常对照组相比,模型对照组明显升高,差异有统计学意义(P<0.05);与模型对照组比较,清肝祛湿活血方各剂量组及罗格列酮组明显降低,差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠血清TNF-α水平比较(±s)
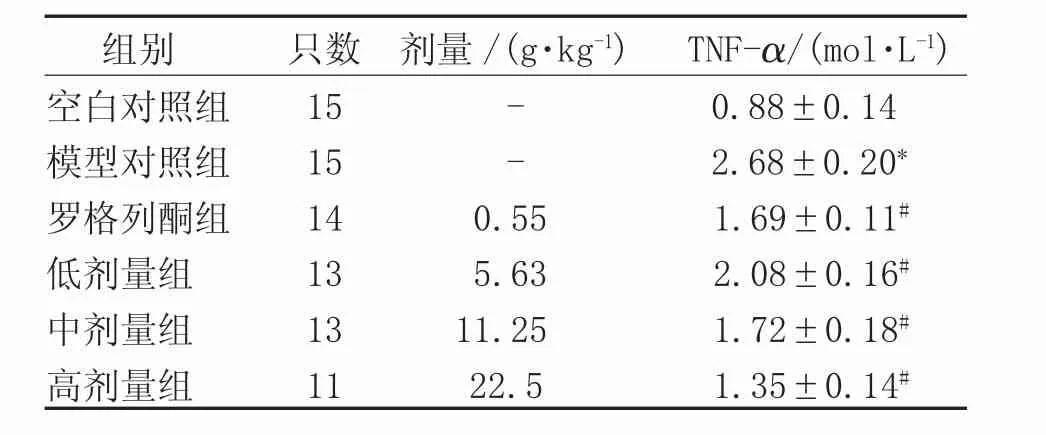
表2 各组大鼠血清TNF-α水平比较(±s)
注:*表示与空白对照组比较,P<0.05;#表示与模型对照组比较,P<0.05
组别 只数 剂量/(g·kg-1) TNF-α/(mol·L-1)空白对照组 15 - 0.88±0.14模型对照组 15 - 2.68±0.20*罗格列酮组 14 0.55 1.69±0.11#低剂量组 13 5.63 2.08±0.16#中剂量组 13 11.25 1.72±0.18#高剂量组 11 22.5 1.35±0.14#
2.2 肝脏组织病理形态 空白对照组大鼠肝脏外形大小正常,呈红色,肝小叶内未见脂滴肝细胞,为阴性。模型对照组大鼠腹腔肥大,肝体积增大明显,脂肪组织丰富,表面粗糙呈灰黄色,肝血窦扩张,充血,切面油腻感,胞质内几乎均呈脂滴肝细胞,为(++++)。与模型对照相比较,罗格列酮组,中药复方低、中剂量组大鼠肝脏脂肪组织含量减少,肝脏体积偏大,呈暗红色。脂变程度较轻,空泡样变肝细胞数目明显减少,胞浆内仅见少量脂肪滴,为(++)。中药复方高剂量组肝脏脂变程度明显减轻,肝小叶基本完整,空泡样变肝细胞消失,为(+)。见图1。
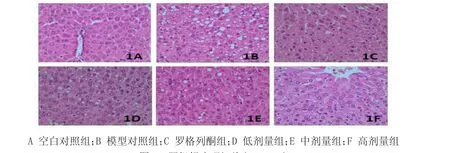
图1 肝组织病理切片(HE×400)
3 讨论
NAFLD的发病与胰岛素抵抗和遗传易感性关系密切。根据临床不同时期的临床表现可将其归属于中医学中“脂满”“肝著”“积聚”“痰证”等范畴。本课题组认为NAFLD的病机为肝火旺盛、湿热瘀结。清肝祛湿活血方以夏枯草清肝散郁;密蒙花清热泻火,养肝明目;青葙子清肝凉血;茵陈清热利湿、退黄;垂盆草清热解毒、利胆;丹参、郁金散结化瘀,行气通络。诸药合用活血化瘀,清肝祛湿[10-11]。
近来有关炎症因子TNF-α在NAFLD发生、发展中的作用备受关注[12]。TNF-α是机体炎症反应和免疫应答反应的主要调节因子,其可通过增加氧自由基和脂质过氧化而导致脂肪性肝纤维化。黄永红[13]研究指出,NAFLD发展到一定阶段时,脂肪组织中的TNF-α水平与胰岛素抵抗呈正相关。研究发现,TNF-α是非糖基化细胞因子,是炎症和代谢失衡的重要脂肪因子,可引起线粒体功能不全、肝细胞变性坏死及炎细胞浸润,加重脂肪肝的程度[14-15]。本研究结果也进一步证实,清肝祛湿活血方高剂量干预组可显著降低NAFLD大鼠TNF-α水平,说明清肝祛湿活血方可通过增强机体对TNF-α的清除能力来改善NAFLD。这与相关文献[16]报道一致。
综上所述,清肝祛湿活血方防治非酒精性脂肪肝可能的机制是下调肝脏TNF-α水平。

