刺激状态时血清TG检测在分化型甲状腺癌术后转移中的价值
王永斌,邓智勇,朱家伦
(云南省肿瘤医院核医学科,昆明 650118)
甲状腺癌是内分泌肿瘤中最为常见的肿瘤,也是近年来发病率增长最快的头颈部肿瘤,其中又以分化型甲状腺癌(DTC)为主,主要包括乳头状癌和滤泡性癌(占85%~90%)[1]。甲状腺手术、131碘(131I)内照射以及甲状腺激素药物抑制治疗是目前公认的DTC主要治疗方法。甲状腺球蛋白(TG)作为DTC的肿瘤标志物,在监测肿瘤的复发、转移过程中有较高的敏感度和特异度。TG是DTC术后经131I治疗长期监测的重要指标,根据血清促甲状腺激素(TSH)水平差异,可将血清TG分为刺激状态的TG和抑制状态的TG。本研究旨在探讨DTC术后刺激状态下,血清TG水平变化与DTC转移分级的关系,以期为临床提供早期、有用的肿瘤复发转移依据。现报道如下。
1 资料与方法
1.1一般资料 回顾性分析2017年9-12月本科收治拟行131I放射治疗的DTC患者。纳入标准:(1)经病理确诊为DTC;(2)已行甲状腺全切术;(3)接受甲状腺激素替代抑制治疗;(4)停服甲状腺素片4~6周,且血清TSH水平>30 mIU/L;(5)抗甲状腺球蛋白(TGAb)<110 mIU/L。排除标准:(1)TGAb> 110 mIU/L;(2)有甲状腺组织残留;(3)严重肝肾功能异常。共纳入81例患者,其中男16例、女65例,中位年龄43.2岁。
1.2方法 所有患者在入院前,均停服甲状腺素片4~6周。入院行颈部超声、CT、131I全身显像和(或)病理诊断等综合检查以明确是否发生转移,以及是否为远处(肺、骨、肝等)转移。所有纳入患者清晨空腹采静脉血4 mL,离心3 000 r/min,10 min,上机检测血清TG、游离甲状腺素(FT4)、TSH,TGAb水平以及肝肾功能。其中TG、TSH、TG-Ab采用罗氏电化学发光仪器Cobas e601检测,FT4采用安图全自动化学发光仪A2000检测。血清TG测定范围为0.4~500.0 μg/L;TSH检测范围为0.005~100.000 mIU/L,TSH功能敏感度为0.014 mIU/L;TGAb检测范围为10~4 000 IU/L;FT4检测范围为1~50 pmol/L。严格按照实验室操作规程处理标本,检测前常规质控,质控合格方可检测患者标本。
1.3统计学处理 采用SPSS20.0统计软件进行数据处理和分析。血清TG、TSH、FT4、TGAb水平为偏态分布数据,各组结果用M(P5~P95)表示,各组间结果差异性比较采用Mann-WhitneyU检验,多组之间结果差异性比较采用Kruskal-WallisH检验。采用Spearman等级相关分析TG水平与临床分期的相关性。采用受试者工作特征(ROC)曲线分析血清TG对DTC患者发生转移的诊断效能。以P<0.05为差异有统计学意义。
2 结 果
2.1转移组与未转移组刺激状态时TG、TSH、FT4、TGAb水平比较 在DTC术后刺激状态下,发生转移22例(转移组),未转移59例(未转移组)。转移组TG水平明显高于未转移组,差异有统计学意义(P<0.05);两组的TSH、FT4、TGAb水平比较,差异无统计学意义(P>0.05)。见表1。

表1 转移组与未转移组刺激状态时TG、TSH、FT4、TGAb水平比较[M(P5~P95)]
2.2不同转移级别血清TG水平比较 根据影像检查的结果,将转移分为淋巴结转移组(13例)和远处转移组(9例)。血清TG水平在各转移分级中,差异有统计学意义(P<0.05);并且随着转移部位分级提高,血清TG水平逐渐增高。通过Spearman等级相关分析发现,血清TG水平与转移分级呈明显正相关(r=0.607,P<0.05)。见表2。

表2 不同转移情况下血清TG水平比较[M(P5~P95),μg/L]
2.3刺激状态下血清TG对DTC患者发生转移的诊断效能 根据ROC曲线原理,通过影像检查明确是否发生转移,制作ROC曲线。血清TG在刺激状态下对DTC患者发生转移的曲线下面积为0.823(95%CI:0.689~0.956,P<0.05),最佳截点值为9.46 μg/L。此时TG在诊断DTC是否发生转移的敏感度为85.7%,特异度为75.7%。见图1。
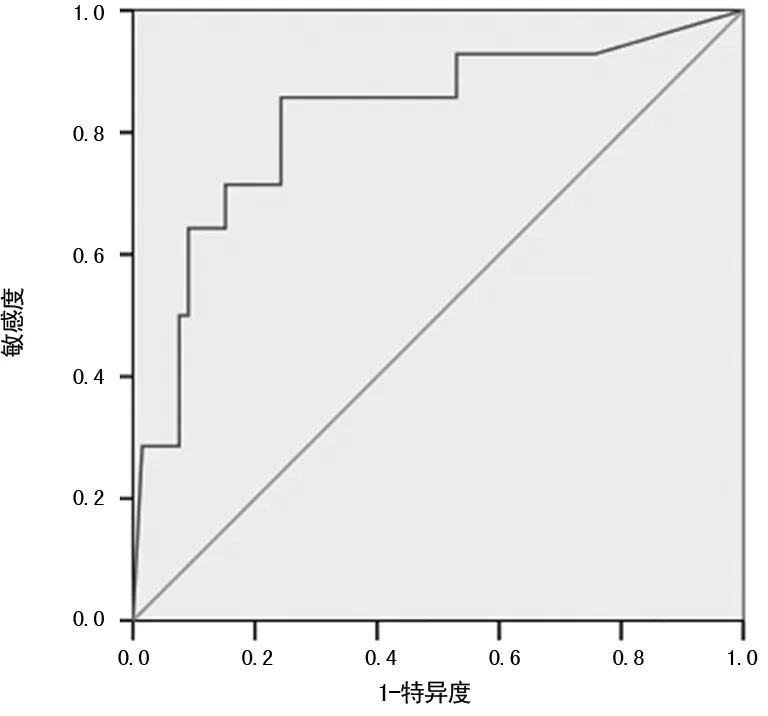
图1 ROC曲线分析
3 讨 论
TG是甲状腺最重要、含量最丰富的蛋白质,定位于8号染色体的8q24区,全长260 kb,由含有48个外显子的基因转录[2]。TG基因的转录受到一些激素的调控,如TSH和三碘甲状腺原氨酸(T3),其中TSH可以促进TG的转录,相反T3可以抑制TG的转录。TG为大分子含碘糖蛋白,由两条相同的多肽链组成,相对分子质量为660×103。
血清TG在诊断DTC复发或转移时具有较好的敏感度和特异度,常用于DTC患者治疗后的监测。在甲状腺全切或次全切除及131I治疗后,血清TG水平升高提示肿瘤转移或复发价值更为明显[3]。有学者指出,DTC患者术后血清TG水平监测可作为现有诊断淋巴结转移手段的主要补充,临床对于甲状腺癌全切或次全切术后患者血清TG水平异常升高者,应进行超声、CT、131I全身扫描或者PET/CT等检查以筛查是否有转移灶漏诊,并及时制订出合理的治疗方案[4]。TSH是DTC细胞产生和释放TG的重要刺激因子[5]。高水平的血清TSH可刺激残留的正常甲状腺组织及摄碘的DTC组织生成TG,从而能明显提高血清TG诊断肿瘤组织大小的敏感性,故刺激状态的TG,即血清TSH>30.0 mIU/L时的TG,较抑制状态的TG(TSH<0.1 mIU/L)更能灵敏地反映出潜在的极微小肿瘤病灶。一项纳入3 947例DTC的Meta分析指出,在刺激状态下,当血清TG水平<10 μg/L时,其对甲状腺疾病预后的阴性预测值远高于抑制状态时的TG,即刺激状态时血清刺激状态的TG<10 μg/L时,甲状腺癌复发转移的概率明显减低[6]。临床上通常在停服左甲状腺素片4~6周、TSH水平达到25~30 mU/L时测定血清TG水平[7],作为刺激状态的TG。此时内源性TSH水平升高可提高血清TG水平。还有研究指出当TSH达到60~90 mU/L 时,会增加血清TG的临床预测性能[8]。《美国国立综合癌症网络(NCCN)指南(2015版)》提出将刺激状态的TG是否大于10 μg/L作为肿瘤复发的判断标准之一[9],而国内《131I治疗DTC指南(2014版)》[10],也将刺激状态的TG作为131I治疗DTC的评价标准之一。
本研究发现,DTC行甲状腺全切术后,规律服用甲状腺素片进行替代抑制治疗患者,当停服甲状腺素片4~6周(处于刺激状态),血清TG水平与DTC患者复发、转移关系密切。未发生转移的甲状腺癌患者其体内血清TG水平中位数为5.74 μg/L,而一旦发生转移则血清TG水平逐渐增高至195.05 μg/L,二者之间差异有统计学意义(P<0.05)。根据影像检查的结果,将转移分为颈部淋巴结转移和远处转移。当发生颈部淋巴结转移时,血清TG水平中位数为51.24 μg/L,而当肿瘤转移至肺、骨、肝脏等远处时,血清TG水平为354.82 μg/L,差异有统计学意义(P<0.05)。同时本研究通过Spearman等级相关,分析血清TG水平与临床转移分级的相关性,结果显示在甲状腺癌全切术后,处于刺激状态时,血清TG水平与转移分级呈明显正相关(r=0.607,P<0.05)。
本研究通过制作血清TG的ROC曲线,得出曲线下面积为0.823(95%CI:0.689~0.956,P<0.05),并找出刺激状态时血清TG诊断DTC患者是否转移的最佳截点值为9.46 μg/L,该水平的诊断敏感度为85.7%,特异度为75.7%。这该结论与《NCCN指南(2015版)》[9]及POLACHEK等[11]研究结果基本一致,但与其他一些学者研究结论(认为刺激状态时的血清TG预测肿瘤复发或转移的临床切点值为10~50 μg/L不等)有一定的差异[12-13]。分析原因,考虑有以下几种可能:(1)血清TG检测采用的仪器、方法不一致。目前用在临床上检测TG的方法主要有罗氏电化学发光方法、西门子和索林化学发光方法、放射免疫法等。这些方法所检测TG的原理、抗原位点、溯源性并不一致,导致检测结果差异性很大。(2)血清TGAb对TG检测的干扰不一致,血清TGAb采用竞争法检测时,可使TG结果假性增高。而采用双抗体夹心法检测TG时,则会导致TG结果假性偏低[14]。(3)研究对象刺激状态程度不一致。为确保检测的敏感度,本研究对象均为停服甲状腺素片4~6周不等患者,TSH水平中位数为87.54 mIU/L,这可能与其他研究对象的刺激程度不完全相同,导致血清TG的水平不一致。因此,不同检测方法、患者接受的刺激状态不一致等均可导致血清TG结果不相同。
综上所述,刺激状态时的血清TG水平可作为预测DTC全切术后转移的指标。血清TG水平为9.46 μg/L可以作为DTC刺激状态转移的判断截点值。

