血清GPC3联合AFP检测对肝癌患者诊断与肝功能评估的价值
凌 欣,王 军,高 伟,郭绪晓,张冬新
(1.山东中医药大学附属医院检验科,济南 250014;2.山东省荣军总医院检验科,济南 250013)
原发性肝癌(PHC)是现在社会的一种发病率较高的恶性肿瘤,我国PHC的发病率尤其高,每年新发及因该病死亡的人数均在全球占有很高的比例[1]。手术虽然是治疗PHC的主要手段,但依赖于早期发现和早期诊断。目前,PHC诊断的主要手段除了超声、CT、MRI外,在检验方面主要是检测患者血清甲胎蛋白(AFP)水平。有研究报道,血清AFP较易受到其他肝病,如肝炎、肝囊肿等的影响,且部分患者疾病早期血清AFP可表现为正常水平,这给PHC的诊断带来了一定的局限性[2]。血清磷酸酯酰肌醇蛋白聚糖-3(GPC3)是近年来发现的一种与PHC关系较为密切的标志蛋白。研究发现GPC3与肝癌的发展、转移、复发有关,且与肿瘤的分化程度及肿瘤大小有一定的相关性[3]。本研究通过对PHC患者、一般肝脏疾病患者及健康人群的对比研究,旨在探讨血清GPC3检测对PHC患者诊断和治疗的评估价值。现报道如下。
1 资料与方法
1.1一般资料 选择2015年8月至2017年8月山东中医药大学附属医院收治的52例PHC患者纳入研究组;同时选择肝硬化患者18例,慢性乙型肝炎患者16例,脂肪肝患者10例及肝血管瘤患者8例纳入病例对照组(52例);选择同期参加体检的健康者52例纳入健康对照组。PHC患者纳入标准:(1)按PHC诊断标准,经细胞穿刺检查或术后病理检查确诊为PHC[4];(2)本次入院检查或治疗前未接受过治疗;(3)患者临床资料齐全;(4)一切检查和治疗均做到患者知情同意。病例对照组患者也根据血清检验、超声、CT等检查确诊。排除标准:(1)合并其他脏器肿瘤或者转移性肝癌患者;(2)合并有心、肾、肺、脑功能不全患者;(3)孕妇;(4)失访或临床资料不全患者。研究组中男33例,女19例;年龄41~76岁,平均(56.27±10.38)岁。病例对照组中男31例,女21例;年龄38~74岁,平均(54.83±9.67)岁。健康对照组中男34例,女18例,年龄43~78岁,平均(57.34±9.96)岁。3组研究对象性别、年龄差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1采集与保存血清标本 清晨在研究对象空腹状态下采集静脉血5 mL,高速离心分离血清,-80 ℃保存备用。
1.2.2血清GPC3水平检测 根据说明书将试剂盒中GPC3标准品稀释成0.780、1.560、3.125、6.250、12.500 ng/100 μL的5个倍比水平,用于绘制标准曲线。用稀释液将血清标本按1∶200的比例稀释后,滴入96孔板,每孔100 μL,同时设立空白对照孔。在37 ℃下温育30 min,弃液体,用洗涤液冲洗5次。将100 μL酶联免疫吸附试验检测抗体滴入孔中,37 ℃下温育30 min,弃液体后反复冲洗5次。然后将50 μL底物A和底物B滴入孔中,避光显色3 min后滴入50 μL终止液,用酶标仪检测各孔450 nm处的光密度值(A)。以标准液的A值为纵坐标,标准液的水平为横坐标,绘制标准曲线。根据标准曲线计算标本中GPC3的水平。
1.2.3血清AFP水平检测 采用电化学发光法(Roche原装试剂)检测各组血清AFP水平。AFP≥200 ng/mL为阳性[5]。
1.2.4肝功能检查 采用全自动生化分析仪(Roche原装试剂)检测患者天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TBIL)、清蛋白(ALB)水平。采用血凝分析仪(ACLTOP500原装试剂)检测患者血浆凝血酶原时间(PT)。
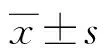
2 结 果
2.13组研究对象血清GPC3和AFP水平比较 研究组患者GPC3、AFP水平高于病例对照组和健康对照组,差异均有统计学意义(P<0.05);病例对照组GPC3、AFP水平高于健康对照组,差异均有统计学意义(P<0.05)。见表1。
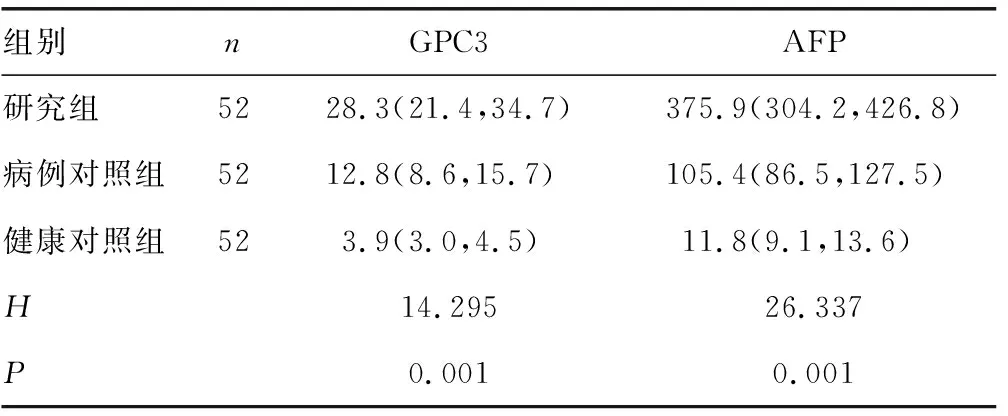
表1 3组研究对象血清GPC3和AFP水平比较[M(P25,P75),ng/mL]
2.2研究组患者血清AFP水平与血清GPC3的关系 研究组患者中,随着AFP水平的升高,GPC3水平也逐渐升高。采用Spearman相关分析,AFP水平与患者GPC3呈正相关(r=0.579,P<0.05)。见表2。

表2 研究组患者血清AFP水平与血清GPC3的关系[M(P25,P75),ng/mL]
2.3血清GPC3、AFP及二者联合检测在诊断PHC中的价值 根据ROC曲线判定血清GPC3≥20 ng/mL,AFP≥200 ng/mL为诊断阳性值,GPC3诊断PHC的敏感度为65.38%,特异度为92.31%;AFP诊断PHC的敏感度为71.15%,特异度为84.62%;二者结合诊断PHC的敏感度为90.38%,特异度为88.46%。GPC3联合AFP检测诊断的敏感度高于单纯GPC3检测及AFP检测(P<0.05)。见表3。

表3 血清GPC3、AFP及二者联合检测在诊断PHC中的价值
注:AUC为曲线下面积
2.4研究组患者GPC3水平与肝功能的关系 研究组GPC3阳性患者AST、ALT、PT水平明显高于GPC3阴性患者,ALB水平明显低于GPC3阴性患者,差异均有统计学意义(P<0.05),两类患者TBIL水平差异无统计学意义(P>0.05)。见表4。
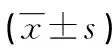
表4 GPC3水平与患者肝功能的关系
3 讨 论
GPC3是一种位于细胞膜表面的糖蛋白,GPC3主要是由核心蛋白及糖胺聚糖侧链构成,主要作用是通过与细胞外基质、蛋白酶及生长因子等相互作用,进行信号的传递[6]。GPC3在细胞的生长、发育、分化等过程中起着至关重要的作用。GPC3主要在人类胚胎和胎儿期表达,其表达具有器官组织特异性。有研究报道,成年后GPC3的高表达与恶性肿瘤如肝癌、结肠癌、子宫内膜癌、肺癌等密切相关[7]。目前GPC3的作用机制还不是很清楚,可能是与多种配体、受体结合相互作用而参与到细胞的各种生理及病理过程,从而调节多数中胚层组织和器官的生长,也可能通过活化细胞外信号调节激酶而促使上皮间质进行转化[8-9]。
GPC3的氨基端可脱落并分泌到细胞外,可作为可溶性物质存在于血清中,运用酶联免疫吸附试验能够检测到血清GPC3的水平。现在有学者认为GPC3可用于PHC的诊断,甚至比传统的PHC肿瘤标志物AFP更有价值[10]。有研究报道,GPC3可能是通过作用于Wnt信号通路而影响着PHC的发生、发展[11]。CHEN等[12]在对PHC患者、肝硬化患者及健康人群的检查中发现,PHC患者血清GPC3水平明显高于肝硬化患者及健康人群。本研究中PHC患者GPC3水平明显高于病例对照组和健康对照组,结果与上述报道一致。AFP是目前使用最多也是最有价值的PHC肿瘤标志物,虽然AFP具有很高的特异度但是其诊断PHC的敏感度较低,容易导致早期肝癌患者的漏诊。在本研究中,AFP和GPC3诊断PHC的敏感度为71.15%和65.38%,敏感度均不高,但是将两种指标联合使用后诊断敏感度为90.38%,有了很大提高,提示AFP与GPC3的联合使用可以提高PHC的诊断敏感度,降低漏诊率。
PHC病情发展较快,目前手术切除是治疗PHC的主要手段,在部分早期患者中可以使用射频消融术,对于肿瘤较大且难以切除的患者可以采用动脉栓塞法。目前也有学者主张使用GPC3衍生物单抗来辅助PHC的治疗,但具体疗效还需进一步的临床试验确认[13-14]。本研究PHC患者中GPC3阳性的患者肝功能明显较GPC3阴性的患者差,也从侧面说明了GPC3衍生物抗体可能对PHC患者的治疗有帮助。GPC3水平增高可以通过与细胞黏附分子、基质成分、酶及酶的抑制剂等多种配体及受体的相互作用,从而起到调节或抑制中胚层组织及器官的生长;GPC3可能通过抑制肝细胞生长并诱导细胞凋亡引起患者肝功能的降低。目前关于GPC3与PHC患者治疗预后的研究较少,WANG等[15]对进行肝移植手术的患者进行随访研究,发现GPC3水平与患者肝移植后肿瘤复发有密切的关系。本研究中,30例治疗后病情好转的患者中有22例患者GPC3水平明显下降,而只有16例患者AFP水平明显下降,提示GPC3能够较好地反映PHC患者治疗的预后情况,且效果可能优于AFP。
综上所述,血清GPC3与PHC关系密切,GPC3和AFP联合检验有助于提高诊断敏感度,以及判断患者肝功能。

