盐地碱蓬PsaH基因的克隆及生物信息学分析
郝晓燕,李建平,常晓春,足木热木,高升旗,陈果,黄全生
(新疆农业科学院核技术生物技术研究所,乌鲁木齐 830091)
0 引 言
【研究意义】光系统I(Photosystem I,PS I)是由至少13个独立亚基多肽组成的嵌于光合膜上的色素蛋白复合物,在植物中主要分布于叶绿体类囊体膜基质膜区[1-2]。在光合反应中主要起催化光电子传递的作用。在高等植物中所有已知的编码PS I蛋白亚基的基因都已经被克隆,依据这些基因被发现的先后顺序依次命名为PsaA-PsaN。真核生物中PS I蛋白亚基基因由叶绿体或细胞核基因组编码,其中H亚基(PsaH)是由核基因组编码的低分子量膜外周蛋白,主要存在于复合蛋白的边缘[3-4]。盐地碱蓬(suaedasalsaL.)隶属藜科(Chenopodiaceae)碱蓬属(suaeda),是一种叶片高度肉质化的一年生真盐植物[5],主要分布于新疆、山东、辽宁等省区海滨、平原荒漠区湖边潮湿盐土上,是一种典型的盐碱地指示植物,也是我国最重要的盐土荒漠建群种之一。随着土壤盐渍化日趋严重与人口数量急剧增长矛盾的突出,开发和有效利用盐渍土逐渐成为研究热点,而增强植物的耐盐性是提高盐渍土利用效率有效的方法之一。因此,利用现代生物学技术,通过对盐生植物耐盐基因的发掘和功能研究能够为改良作物耐盐性提供理论基础,还将对有效地改良和利用盐渍土提供思路。对于农业生产、环境保护和生态治理都具有重要的意义。【前人研究进展】有关盐地碱蓬的研究工作虽然早已起步,涉及了叶片结构、离子平衡、渗透调节、抗氧化系统和光合特性等方面[6-7]。在分子水平上,构建了碱蓬盐胁迫cDNA文库,筛选出很多可能与耐盐相关的基因[8]。目前从碱蓬中克隆的有INPS、P5CS、BADH、CMO、NHX1、TypA1、H+/Ca2+等耐盐相关基因[9-12],且转化了拟南芥、水稻、烟草等植物中并显著提高了转基因后代的耐盐能力。【本研究切入点】有关盐地碱蓬中PsaH基因的研究尚未见报道。利用RT-PCR技术从盐生植物碱蓬中获得耐盐相关基因SsPsaH全长,并对其进行生物信息学分析,以便进一步的了解其分子生物学功能。【拟解决的关键问题】 研究以盐地碱蓬为材料,从盐胁迫cDNA文库中获得PsaH基因cDNA全长序列,通过生物信息学软件对其结构和功能进行预测,为开展该基因的功能研究提供基础。
1 材料与方法
1.1 材 料
1.1.1 植物材料
盐地碱蓬(suaedasalsa)种子收获于阜康水库盐碱地,生长至4周大小,以400 mM NaCl胁迫处理48 h取样,迅速置于液氮中冷冻,-70℃冰箱保存备用。
1.1.2 质粒、菌株、试剂
大肠杆菌(Escherichiacoli)Trans-T1感受态细胞、DNA Marker、TaqDNA聚合酶、pEASY-Blunt Zero Cloning Kit购自TransGen Biotech;;PowerScriptTMII 反转录试剂盒、限制性内切酶均购自NEB公司,DNase 酶Ⅰ、LATaq酶、ExTaq酶、dNTP均购自TaKaRa 公司,T4DNA 连接酶购自Promega 公司,DNA 回收试剂盒购自于OMEGA,引物由北京华大生物科技有限公司合成。
1.2 方法
1.2.1 RNA的提取与纯化,cDNA的合成
材料的总RNA提取按照Life Technologies公司的PureLinkTMRNA Mini Kit 说明书进行操作。以DNaseⅠ纯化处理后,通过琼脂糖凝胶(1.0%)电泳检验获得的各处理样品总RNA的完整性,并用紫外分光光度计(Eppendorf)检测各样品总RNA的纯度和浓度。
第一链cDNA的合成按照Fermentas公司的First Strand cDNA Synthesis Kit操作说明进行,采用的反转录引物为Oligo(dT)15。取1 μg 总RNA 作为模板进行RT-PCR,20 μL体系中总RNA 1 μg,DEPC水6 μL,Oligo(dT)151 μL,65℃ 5 min,冰上放置5 min,RNase inhibitor 1.0 μL,5×Reaction buffer 4 μL,dNTP(10 mmol/L)2 μL 和M-MLV(200 U/μL)1 μL,42℃温育60 min,70℃变性5 min,冰上放置5 min,-70℃保存备用。
1.2.2 SsPsaH基因的克隆
使用Primer Primer 5.0软件在开放阅读框两侧设计一对能有效扩增SsPsaH的特异性引物(SsPsaH-ORF-F:5’-ATGGCTTCTCTAGCAACCTTTGCC-3’;SsPsaH-ORF-R:5’-TTAGATCTTGCCACGAGGTCCG-3’,扩增片段长度为438 bp)。以合成的第一链cDNA为模板,进行PCR扩增。反应体系为50 μL:cDNA 1 μL,引物各1 μL,ExTaq酶0.5 μL,10×PCR Buffer (Mg2+plus)5 μL,dNTP Mixture 4 μL,加ddH2O至50 μL。PCR程序:94℃预变性3 min;94℃变性30 s,60℃复性30 s,72℃延伸30 s,30个循环;72℃延伸10 min; 4℃保存。琼脂糖凝胶电泳检测后用DNA回收试剂盒回收目的片段连接到pEASY-Blunt Zero载体进行克隆,阳性克隆经酶切鉴定后送北京华大基因科技有限公司完成DNA测序。
1.2.3 SsPsaH基因的生物信息学分析
SsPsaH基因的核苷酸和氨基酸序列分别用NCBI的BLASTn和BLASTp(http://bladt.ncbi.nlm.nih.gov/Blast.cgi)进行相似性分析;利用在线软件Protparam (htpp://www.expasy.org/protparam/)分析蛋白的理化性质;用TMPred软件预测蛋白的跨膜区;用SignalP 4.1 Server 在线软件预测蛋白的信号肽;用GOR4软件分析蛋白的二级结构。在NCBI数据库中查找与PsaH基因同源性较高的其他物种的同源基因进行多序列比对,用MEGA5.0通过邻接算法(Neighbor-Joining)完成系统进化树构建[13-15]。
1.2.4 SsPsaH基因的组织特异性表达分析
分别提取盐地碱蓬根、茎、叶3种不同组织的总RNA(方法参见ThermoFisher PureLink RNA Mini Kit使用手册)。以总RNA为模板,Oligo(dt)18为引物反转录合成第一链cDNA(方法见Fementers公司的 RevertAid First-strand cDNA Synthesis Kit for RT-PCR试剂盒使用手册)。获得的cDNA稀释10倍后作为RT-PCR定量检测的模板。SsPsaH基因的表达分析引物(SsPsaH-RT-F:5’-AGGATGTTCTACCCATCACAAA-3’;SsPsaH-RT-R:5’-ATGATACACCAAAAGGAAAGAAAT-3’),同时以盐地碱蓬内参基因Actin为对照,引物序列(Actin-RT-F:5’-GGGCGAGTACGACGAATCTG-3’,Actin-RT-R:5’-CCTCTCCATCTCTCTCGACCAAAT-3’),反应条件为94℃预变性1 min,随之94℃ 30 s,56℃ 30 s,72℃ 30 s,28个循环,最后72℃延伸7 min。
2 结果与分析
2.1 盐地碱蓬SsPsaH基因的获得
对400 mM NaCl胁迫处理48 h的碱蓬cDNA文库进行耐盐筛选后测序过程中,发现了1个与菠菜PsaH基因(XP_021B62899.1)同源性高达91%的序列(EST),对其相应的克隆进行完全测序,ORF Finder软件分析发现该片段包含完整的CDS序列,将其命名为SsPsaH(GenBank Accession Number:KC4048847)。该基因全长770 bp,含有1个长为438 bp的开放阅读框,编码145个氨基酸。图1

注:M:起始密码子;*:终止密码子
Note: M: start codon; *: stop codon
图1 获得的SsPsaH基因的cDNA全长序列及其氨基酸序列
Fig.1 Cdna sequence and amino acid sequence of SsPsaH gene obtained
2.2 SsPsaH蛋白的同源性及功能结构域
在NCBI上通过Blast对SsPsaH蛋白序列同源性进行分析。研究表明,SsPsaH蛋白与藜麦(chenopodiumquinoa) 相似性最高为94%,与菠菜(Spinaciaoleracea) 同源性为91%,与甜菜(Betavulgarissubsp)相似性为90%,与木薯(Manihotesculenta)、蓖麻(Ricinuscommunis) 相似性为85%,与毛果杨(Populustrichocarpa)的相似性为84%,与其它植物的氨基酸序列有着高度保守性。由此确定,研究所克隆的SsPsaH基因是属于光系统I(PSI) H亚基成员。
利用DNAMAN软件对包含SsPsaH基因在内的6种植物的氨基酸序列进行保守结构域分析发现,SsPsaH基因与其他植物中的PsaH基因一样包含4个保守的结构功能域典型特征:1个N端的高酸性富集结构域NH-KYGDK,1个转移肽(101-121)代表该基因编码的氨基酸可能具有跨膜结构域,1个中心疏水结构域和1个C端的高度保守结构域PPKLGPRGKI。这些分析结果表明克隆的SsPsaH基因属于PsaH超级家族。图2

图2 SsPsaH蛋白与其他物种的氨基酸序列
Fig.2 Comparison of amino acid sequences homology of SsPsaH with different plant PsaH
2.3 SsPsaH蛋白质的系统进化树分析及理化性质预测
将盐地碱蓬与藜麦、菠菜、甜菜、拟南芥、木薯、蓖麻等的PsaH氨基酸序列,用相邻连接法通过MEGA5.0软件构建系统进化树,迭代值为1 000。可以看出,碱蓬与菠菜、甜菜、藜麦、拟南芥聚为一组,且与同属藜科的菠菜、甜菜、藜麦聚在同一个分支,其中与菠菜亲缘关系最近。而蓖麻、毛果杨、木薯、烟草樟子松、大豆、花生聚为一组,其中蓖麻和毛果杨亲缘关系最近且在同一分支。这与NCBI中氨基酸同源性分析的结果相一致。用在线软件ExPasy预测SsPsaH基因所编码的蛋白质理化性质。该蛋白为不稳定的亲水性蛋白。图3,表1

RcPsaH (蓖麻Ricinuscommunis, XP002516025);PtPsaH (毛果杨Populustrichocarpa, XP002304206);MePsah(木薯Manihotesculenta,XP021627101);NsPsaH (烟草樟子松Nicotianasylvestris, BAA04634); GmPsaH (大豆Glycinemax, ACU13848);AhPsaH (花生Arachishypogaea,AB184258); AtPsaH (拟南芥Arabidopsisthaliana,NP175633);CqPsaH (藜麦Chenopodiumquinoa,XP02136868); BvSPsaH (甜菜Betavulgarisstubsp. XP010691337); SoPsaH (菠菜Spinaciaoleracea, XP021862899)
图3 SsPsaH系统进化树构建
Fig.3 Phylogenetic tree analysis of SePsaH protein
表1 SsPsaH蛋白的理化性质预测
Table 1 Physicochemical property analysis of SsPsaH protein

蛋白理化特性characteristics预测结果Predicted result编码的氨基酸个数 Number of coding amino acids145等电点 Theoretical PI9.84分子量 Molecular weight (Mr/103)15372.66负电荷残基Total number of negatively charged residues (Asp+Glu)8正电荷残基Total number of positively charged residues (Arg+Lys)16分子式 FormulaC699H1109N183O204S1不稳定系数 Instability index (II)47.81平均疏水性 Grand average of hydropathicity (GRAVY)-0.148脂肪系数 Aliphatic index (AI)83.45
2.4 SePsaH蛋白质二级结构预测
使用GOR 4在线分析软件预测SePsaH蛋白二级结构发现,α-螺旋(Helix)占8.97%,延伸链(Extended strand)占25.52%,无规则卷曲(Random coil)占65.52%,无β-螺旋结构存在。图4

注:A:大写字母代表SePsaH蛋白质的氨基酸序列;h、c、e分别代表α-螺旋、无规则卷曲、延伸链. B:短竖线区(紫色线),无规则卷曲;中竖线区(红色线),延伸链;长竖线区(蓝色线),α-螺旋
Note: A. capital letters represent the amino acids sequence of SsPsaH protein; h, c and e represent the alpha helix, random coil and extended strand, respectively. B. short vertical bar area (purple wire): random coil; medium vertical bar area(red wire): extended strand; long vertical bar area(blue wire): alpha helix
图4 SsPsaH蛋白质二级结构预测
Fig.4 Secondary structure prediction of SsPsaH
2.5 SsPsaH蛋白质的信号肽预测
使用SignalP 4.1 Server 在线软件,对SsPsaH蛋白进行信号肽预测,研究表明,第21位苏氨酸残基原始剪切位点最高分值0.167,综合剪切位点最高分值0.165,第1位蛋氨酸信号肽最高分值0.228,远远小于5,推测SsPsaH蛋白不存在信号肽。图5,表2

图5 SsPsaH蛋白的信号肽预测
Fig.5 Prediction of the SsPsaH protein signal P-NN
表2 SsPsaH蛋白的信号肽预测数据
Table 2 Signal P-NN data prediction of the SsPsaH protein
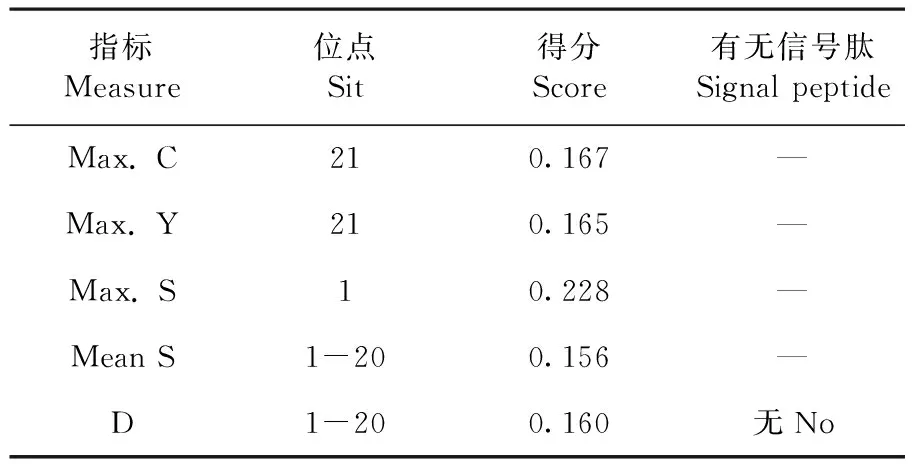
指标Measure位点Sit得分Score有无信号肽Signal peptideMax. C210.167—Max. Y210.165—Max. S10.228—Mean S1-200.156—D1-200.160无No
Max. C:原始剪切位点的分值;Max. Y:综合剪切位点的分值;Max. S: 信号肽的分值;Mean S:信号肽分值的平均值;D score:mean S和max. Y 的加权平均值
Max. C: scores of putative cleavage site; Max. S: scores of signal peptide; Max. Y: scores of synthesis cleavage site; Mean S: average S-score; D score: weighted average of the Mean S and the Max. Y scores
2.6 SsPsaH蛋白质跨膜结构预测
通过在线软件TMPred分析SsPsaH蛋白的跨膜性预测,可知该蛋白具有1个跨膜结构域(位于第101~121个氨基酸残基之间)。同时利用PredictProtein对 SsPsaH蛋白进行亚细胞定位预测分析,发现该蛋白可能定位于叶绿体膜系统上。这些结果与该基因氨基酸序列的结构功能域分析结果相符。图6

图6 SsPsaH蛋白的跨膜结构域预测
Fig.6 The transmembrane domain prediction of the SsPsaH protein
2.7 SsPsaH基因的组织特异性表达
以盐地碱蓬的根、茎、叶3种不同组织的RNA为模板进行RT-PCR分析。研究表明,SsPsaH基因在根、茎、叶中均有表达,但在叶和茎中表达量明显高于根中的表达量。图7

R: root; S:stem; L:leaf
图7 SsPsaH基因的组织特异性表达
Fig.7 The expression analysis of the SsPsaH gene
3 讨 论
光合作用是植物赖以生存的基础,也是植物对外界环境刺激最敏感的生理过程之一。PS I作为光系统复合体蛋白在光合作用中起维持单子传递效率和状态转化等作用。研究表明,组成PS I 光系统各亚基的变化会影响它们之间的相互作用及蛋白复合体的结构形成。PsaH蛋白作为PS I复合体的一个组成亚基,主要通过与其它几个亚基PsaD、PsaG、PsaI、PsaL、PsaP、PsaO相结合以及光合系统的环状捕光天线LHCII形成相互作用区域,从而完成光合作用的同化过程[4、16、17]。Helle等[18]在PSI-H亚基缺乏的拟南芥突变体中发现,H亚基的缺失会引起PSI-L亚基组份的降低和NADP+酶活性降低至61%,此外还会影响到光电子传递的效率。郑成超等克隆了裂叶牵牛(Pharbitis nil Choisy)PsaH基因[19],并发现其受内生昼夜节奏的调控,明显受光诱导表达。江玉梅等[20]从(Lycoris radiata)石蒜中克隆了PsaH基因,张林华等[21]从天山雪莲(Sasussured involucrate Kar.et Kir)中克隆了PsaH基因,Lunde等[22]研究发现,PsaH基因在维持PS I的稳定和光电子传递过程中起重要作用。对于该基因的研究大多都集中在光合作用本身。研究是在通过耐盐胁迫文库筛选后测序中获得碱蓬SsPsaH基因全长cDNA序列,而PsaH基因在参与盐地碱蓬应答盐胁迫的研究还未见报道。
4 结 论
以盐地碱蓬为实验材料,获得PsaH基因。通过生物信息学软件分析结果显示,该基因编码蛋白定位于叶绿体膜系统上,是一种不稳定的亲水性蛋白,不含信号肽;二级结构中无规则卷曲所占比例最高;有PsaH基因家族的保守结构域,属于光系统I(PSI)复合蛋白H亚基。系统进化树分析表明其与藜科的菠菜、甜菜聚为一个组,且同源性高达90%,该基因具有很强的保守性,且在亲缘关系较近的物种中保守性更高。RT-PCR对碱蓬组织特异性表达分析结果表明,SsPsaH基因主要在碱蓬的茎和叶中表达。

