丙型肝炎病毒核酸荧光定量检测法的性能验证
崔燕红 赵一琳 宛传丹
作者单位:215500 江苏常熟,常熟市医学检验所分子生物学实验室
丙型肝炎病毒(hepatitis C virus,HCV)是导致慢性肝炎的重要嗜肝病毒之一,全球感染人数很多。HCV长期慢性感染会导致肝硬化和肝癌,因此慢性丙型肝炎(丙肝)已成为全世界重要的公共卫生问题[1-2]。丙肝的诊断依赖实验室检验,目前主要针对血清中的HCV抗原抗体进行初筛。但进行抗病毒治疗时,血清HCV-RNA定量检测才是实验室检验诊断的金标准[3]。核酸定量检测对试剂、样本和操作的要求较高,因此有必要对实验室建立的检测系统进行性能验证,以评价其为临床提供可信报告的能力。ISO 15189质量认可规则明确指出,临床实验室在开展某一检测项目前需进行方法学认证,充分了解其检测性能,评估并确认分析性能是否符合预期用途[4]。本文拟对基于QIGEN cube全自动核酸提取仪与ABI 7500核酸扩增仪的HCV-RNA定量检测系统进行多方面的性能验证,评价该方法在临床检验中的应用价值。
1 材料与方法
1.1 实验前准备 对美国ABI 7500 实时荧光PCR扩增仪、QIGEN cube全自动核酸提取仪、Eppendorf高速低温离心机、杭州蓝焰干式恒温器和经校验合格的Eppendorf连续可调式移液器进行校准。所用试剂盒及配套耗材为凯杰生物工程(深圳)有限公司的HCV核酸定量检测试剂盒,确保有效期在规定范围内。实验室环境设施均满足ISO 15189认可准则[5]有关实验室环境设置的各项要求,包括温度、湿度、生物安全、分区操作等。
1.2 标本血清、试剂与耗材 HCV-RNA血清标本为常熟市医学检验所接收的来自常熟本地综合医院送检的丙肝患者标本,所有标本在分离血清后当天贮存于-20 ℃的冰箱保存备用。着重收集强阳性、临界阳性患者的血清,以同期经筛查无肝炎病毒感染史,无严重肝功能损伤以及基础疾病的检查者血清作为阴性血清标本。质量控制(质控)标准品来自国家卫生计生委临床检验中心,按说明书要求进行实验与保存。之后将收集的标本转入超低温冰箱-80 ℃长期保存(不超过2个月)。
1.3 核酸提取 利用QIA cube仪器进行提取,操作步骤与试剂配制严格按照实验室标准操作程序(standard operating procedure,SOP)文件进行,具体参考本实验室ISO 15189文件手册中的QIA cube标准操作规程(文件编号:CSJYS-SOP-PCR-2012)。PCR 扩增:50 ℃ 30 min,95 ℃ 15 min,95 ℃ 15 s,50 ℃ 45 s,72 ℃ 15 s,荧光采集点 50 ℃,45 个循环;反应体系 50 μL。
1.4 数据处理 将HCV-RNA 检测的初始数据转化为对数值(log值),输入SPSS软件,对相关的均值()、标准差(s)、变异系数(CV)、回归方程和相关系数(r)等进行统计分析。
1.5 性能验证指标
1.5.1 精密度 取2个浓度水平(level 1、level 2)的质控血清15 mL,同一批次内重复检测3管,连续检测5 d,每日1次。每个批次均绘制室内质控与标准品曲线。将每个样本充分混匀,在相同环境下由同一名人员进行操作。室内质控均在控,当次试验数据可信有效。记录检测数据,经统计软件处理以评估批内精密度和批间精密度。
1.5.2 正确度 取具有可溯源性的国家卫生计生委临床检测中心丙肝核酸定量检测室间质量评价(质评)的血清样本,共5个浓度水平。每个浓度水平重复检测3次,同一批次完成,室内质控在控。记录结果,计算与理论赋值(室间质评实验室均值)的偏倚,最大允许偏倚<7.5%。
1.5.3 线性范围 采集临床血清标本,取高次方(1.0×108kU/L)阳性混合血清5 mL。以阴性混合血清进行10倍倍比稀释,稀释成8个梯度。每个梯度重复检测3次。所有检测实验在同一天同一个批次内完成。室内质控在控,无离群值。将实验结果填表,进行线性相关分析评估该方法的线性区间。
1.5.4 检测下限 取一份高值样本(接近或高于线性上限10%~15%,N×108kU/L),用阴性混合血清10倍倍比稀释成8个梯度,使最低梯度低于厂家声明值(1.0×102kU/L),理论上达到10 kU/L。每个梯度的样本重复测定3次,所有检测实验均在同一天同一批次内完成。室内质控在控,无离群值,检验结果呈良好线性相关(同线性范围验证)。再将最低梯度的样本以阴性混合血清2倍稀释,重复检验20次,要求全部检出,且与理论值绝对偏倚<0.4 log值。
2 结果
2.1 精密度验证 将检出的核酸拷贝数进行对数化(log值)再进行统计处理。浓度水平level 1和level 2的CV批内和CV批间均小于厂家声明的5%,同时也小于CNAS-CL36:2012文件[5]中7.5%的要求,见表1。说明厂家声明的重复精密度可靠,满足ISO 15189医学实验室认可的质量要求[5]。5个批次质控血清重复检测的log值动态变化趋势,见图1。
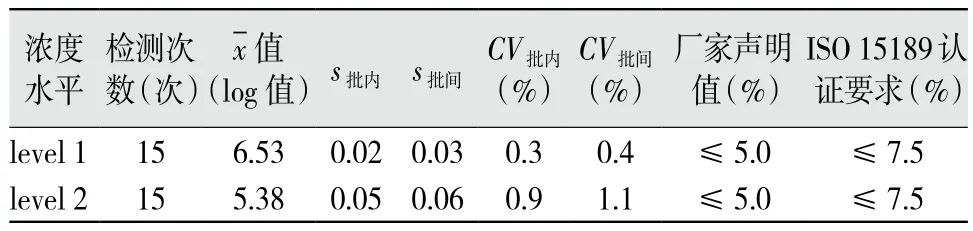
表1 2个浓度水平质控血清的精密度验证结果
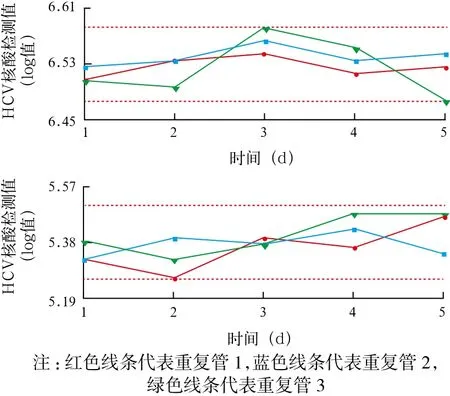
图1 level 1(上)和level 2(下)质控品5 d内5个批次精密度重复检测log值的变化趋势
2.2 线性范围验证 经回归分析,得方程Y=0.182+0.993X,相关系数 R2=0.999,相关系数检验P<0.01。实验数据在 1.6×102~1.9×108kU/L(拷贝数值)呈良好线性,较厂家声明的线性范围(1.0×102~5.0×107kU/L)有所扩大。因此,可判断厂家提供的线性范围真实可信,符合文件标准要求[5-6]。HCV-RNA定量检测的线性相关性见图2,各稀释梯度重复检测3次的log值见表2。
2.3 正确度验证 本研究采用2016年度全国室间质评HCV-RNA定量检测实验结果进行分析。5份标本共15个检测结果,其中2份标本结果为阴性(值为0);3份标本结果为阳性,均值(log值)与检验中心反馈的均值(理论值)偏倚均<0.4 log值。验证结果均合格,正确度良好。见表3。

图2 HCV-RNA定量检测的线性相关性
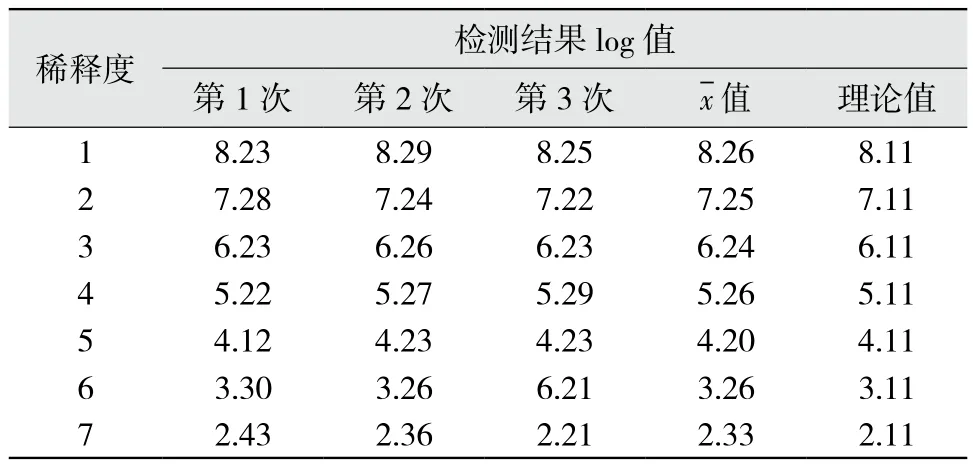
表2 线性范围验证结果
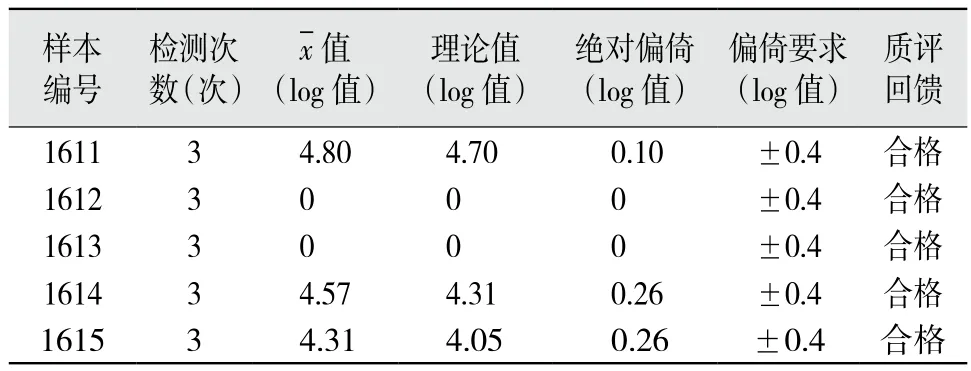
表3 5个浓度水平质控血清的正确度验证结果
2.4 检测下限验证 稀释梯度的检测方法同线性范围,结果说明当理论值稀释至101梯度时,检测结果出现不稳定性,但在102梯度检测数据稳定。将梯度102的样本进行2倍稀释,重复20次检测,结果检出率为100%,且与理论值的偏倚均在0.4 log值内。证明本方法的检测下限为1.0×102kU/L,与厂家声明值一致。见图3。

图3 检测下限验证结果
3 讨论
RNA不稳定且较易降解,对环境设备和实验操作人员的要求较高。实验室实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测HCV起步较晚,业界缺乏针对HCV检测性能验证的报道[7-9]。本研究根据卫生行业标准和CNAS文件[5-6],结合本实验室实际情况提出一套关于商品化试剂盒HCV核酸定量检测的性能验证方案。所有实验操作要充分考虑样本容器存在的瓶间差,在生物安全柜内进行,气流气压均正常。宜取多瓶样本复溶,充分颠倒混匀并静置5 min,以保证样本的匀质性。再分装在密闭小瓶中,-20 ℃以下保存。实验前半小时取出,于室温融化,避免反复冻融。所有检测实验均进行室内质控,若出现室内质控失控或其他操作问题,应将此批次数据弃去,另加一个批次实验。单次测量数据超出总均值±4 SD的为离群值;剔除数据量小于总测量数据量的5%[6]。
精密度是反映方法学性能的主要指标,它确保了样本在实验室检测的稳定性、可靠性。精密度验证至少含有2个浓度水平,本研究采用HCV-RNA 2个浓度质控血清(一个为N×103kU/L,另一个为N×106kU/L)的阳性混合血清。质控血清具有更好的匀质性,排除了临床样本中可能存在的其他未明干扰因素(如患者饮食、用药、基础疾病等)对精密度验证造成的影响。浓度水平与厂家精密度评价时所用样本的浓度高低均相差1次方,但更符合实验室常见阳性样本浓度水平。验证结果显示,批内精密度和批间精密度均远小于厂家声明值(5%)和ISO 15189标准(7.5%)。
正确度验证可分为以下两种方法:① 采用患者样本与其他检验方法或试剂盒进行正确度验证实验,此方法适用于未参加室间质评的项目认可;② 用参考物质进行正确度验证实验,参与各级室间质评的认可项目均可采用此法进行正确度验证[6]。本实验室丙肝核酸检测项目参与国家卫生计生委临床检验中心全国室间质评活动。由使用相同检测系统,或相同检验方法,或相同试剂盒的实验室形成同方法组。采用此类室间质评血清样本,其均值可作为有权威的赋值(理论值)。本文参照2016年度第2次室间质评活动结果进行统计分析,上报检测均值,检验中心回馈结论为合格通过。对照回馈赋值,本实验室检测值偏倚均在±0.4 log值的标准要求内[5]。
临床收集高浓度水平血清样本(N×108kU/L),10倍倍比稀释,形成理论值在101~108的梯度。检测显示,在N×102~N×108kU/L时线性良好,R2=0.999,P<0.01。与厂家声明的线性范围在低限上一致,高限上要高1次方。业界有关临床可报告范围的验证[9-11],实际为检测下限的验证。本文检测下限验证的前期操作与线性范围一致,确定最低稀释梯度。最后再对最低梯度样本进行1:2稀释,重复检测20次(20次是小样本统计分析的最低要求)[12]。结果显示,在 102级的检出率为 100%,偏倚在合理范围内,但在101级的检测结果不确定,重复性差。说明检测下限为1.0×102kU/L,低于此限的定量检测结果将变得不可靠。有学者认为,由此可确定最大稀释度为106,所以临床可报告范围可定为 1.0×102~1.0×1014kU/L[11]。我们认为这样确定稀释上限的意义不大,因为临床上几乎无法遇到HCV-RNA拷贝数为1014级的血清标本,且再高的上限均可通过稀释进行分析,并不能说明方法学的性能,检测下限才是真正能反映该方法学的性能指标。
操作人员首先应全面领悟性能验证的含义,同时对实验设计和操作步骤烂熟于心,这样才能熟练快捷地操作,不易犯错误。分子实验多数进行的是微量实验,极小的动作误差就有可能造成结果的千差万别。本研究的实验数据均在几次摸索中才得以成功。PCR分子检测项目不同于其他专业的检测项目,其试剂成本高、检测过程繁琐、涉及多种操作步骤、某些特殊项目的阳性标本稀缺,对实验室来说,方法学验证需要花费更大的人力和财力[12-13]。值得注意的是,处理核酸定量数据时要注意一定的技巧,在统计实验数据时,应明确将初始浓度值进行对数转化后再进行统计。我们同时用原始浓度值和由原始浓度值与对数转化得到的数据计算精密度和线性范围,统计结果出现偏差,这也与文献报道一致[7,14]。
综上,本实验室基于QIA cube全自动核酸提取仪与ABI 7500核酸扩增仪的HCV-RNA定量检测系统所用试剂盒性能卓越,能够完全满足临床对HCV核酸的定量检测要求。本研究同时也为业界提供了一份符合ISO 15189医学实验室认可准则的关于HCV核酸定量检测的性能验证方案。

