酸、铝和盐胁迫对夏季豆科绿肥作物种子萌发及根瘤菌抗氧化酶活性的影响
王登科,于翔宇,张学风,黄蕾,李晓婷,贺治斌,康林,王党军,姚露花,郭彦军
(西南大学农学与生物科技学院,重庆 400716)
豆科绿肥作物是一种养分全面的优质生物肥源,也是我国农作物种植制度中重要的轮作倒茬作物,在提供作物养分、改善农田生态环境和防止土壤侵蚀及污染等方面起到积极的作用[1]。如,作物休闲期种植绿肥有利于改善土壤质量、提高后茬作物产量[2-3];种植绿肥后,后茬玉米(Zeamays)氮素利用效率有所提高[4],并可降低后茬小麦(Triticumaestivum)氮肥施用量[5]。然而,对于豆科绿肥作物而言,全球气候变化及人类不合理的土地利用方式所引起的土壤质量退化,包括盐碱化、酸化等[6],严重限制了豆科作物的生长及其根瘤的生物固氮能力,影响其在生产中的推广种植[7-8]。
盐碱胁迫可引起植物生理干旱,使植物根系及种子发芽时不能从土壤中吸收足够的水分[9];减少植物对钾、磷和其他营养元素的吸收[10];影响植物的气孔关闭,植物容易干旱枯萎[11]。随着土壤pH值的降低,矿物结构和有机络合态锰、铝等易被活化,活性铝的溶出量增加[12],抑制植物根系生长[13],影响营养元素的吸收[14]。豆科与根瘤菌形成的共生系统对逆境胁迫尤为敏感。根瘤菌适宜的pH值为6.5~7.5[15],过低的土壤pH值影响根瘤菌存活,抑制宿主与根瘤菌的亲和力,降低生物固氮能力[16]。如铝胁迫下,根瘤菌的细胞结构、细胞分裂、酶系统等受到毒害影响,对结瘤和固氮产生抑制作用[17-18]。在盐胁迫下,高渗透环境抑制细胞分裂、降低根瘤菌密度及细胞高精脒含量,使固氮能力显著下降[19-20]。在逆境胁迫下,根瘤菌自身会形成一些抗性机制,如细胞外排、胞外沉淀、主动输出、酶类解毒及降低细胞对铝、酸和盐敏感性等[21-22]。随着pH水平的下降,天蓝苜蓿(Medicagolupulina)根瘤菌抗氧化酶活性显著高于紫花苜蓿(Medicagosativa)根瘤菌,表现出较强的耐酸、耐铝性[23]。说明豆科植物根瘤菌对酸、铝、盐等胁迫存在明显的基因型差异[24-25],可针对不同的土壤环境选择适宜的豆科作物进行种植。
竹豆(Phaseoluscalcaratns)、田菁(Sesbaniacannabina)、绿豆(Vignaradiata)、豇豆(Vignaunguiculata)等为夏季主要的豆科填闲植物。有关这些植物逆境胁迫方面的研究多集中在植物养分吸收上[26],鲜有研究比较它们根瘤菌的抗氧化酶活性差异。鉴于此,本研究通过设置不同水平pH、活性铝含量和氯化钠含量,研究了不同根瘤菌的抗氧化酶活性,包括SOD(超氧化物歧化酶)、POD(过氧化物酶)、CAT(过氧化氢酶)及GR(谷胱甘肽还原酶)。同时,考虑到早期种子萌发阶段对逆境胁迫较为敏感,分析了上述逆境胁迫下豆科绿肥作物种子的萌发特性。旨在通过选择适宜的豆科绿肥作物品种,为改良和利用盐渍地和酸性土壤提供理论依据与实际指导。
1 材料与方法
1.1 植物材料
本试验选择的豆科绿肥作物品种有4个,包括竹豆、绿豆、普通田菁和豇豆。其中竹豆2015年购自江西进贤芽苗菜公司;田菁为普通田菁,2015年购自郑州世纪天缘公司;绿豆为冀绿7号,豇豆为重庆二巴豇,均为2015年购自重庆市北碚区种子公司。
1.2 种子萌发实验
种子萌发实验于2017年6-7月在西南大学农学与生物科技学院饲料作物研究所进行。实验设4个NaCl胁迫水平,即0、40、120和200 mmol·L-1;4个活性铝(Al3+)水平,即0、50、100和200 mg·L-1,利用Al2SO4·18H2O配制;4个pH水平,即4、5、6和7。选取大小均匀、无虫眼的竹豆、绿豆、田菁和豇豆种子,消毒后(3%H2O2溶液消毒3 min),用清水清洗3次,然后采用纸上发芽法,按每个培养皿30粒种子分别放在加入5 mL各个处理溶液的滤纸(直径12 cm的培养皿双层滤纸)床中进行发芽,清水做对照,每个处理设3个重复。在(24±2) ℃恒温培养箱中进行发芽,光照变幅12 h/12 h。每日用约5 mL处理液淋洗种子,防止种子发霉,并保持培养皿有一定的处理溶液。从每个品种开始发芽的第1天,每隔24 h观察并记录种子的发芽数,直至无萌发种子出现为止[27],共记录7次。
1.3 供试根瘤菌菌株的分离、纯化
于2015年8月在重庆市合川区西南大学试验田采集竹豆、绿豆、田菁和豇豆4种绿肥作物的根瘤,分离纯化竹豆根瘤菌、绿豆根瘤菌、田菁根瘤菌和豇豆根瘤菌。西南大学合川试验基地,年平均气温18.4 ℃,年日照时数1342.6 h,年降水量1552.7 mm,年相对湿度84%,平均风速0.7 m·s-1,土壤呈弱酸性(pH值6.5)。
1.3.1菌株纯化 分别对采集的根瘤经95%的酒精杀菌处理10 s后,再用3% H2O2消毒3~5 min,用无菌水冲洗3~5次后,加1滴无菌水,把根瘤菌捣碎,用接种环挑取一环根瘤的汁液接种到醇母甘露醇培养基(YMA)上,划线分离,在28 ℃黑暗条件下培养,待菌落长成,选取单菌落,划线分离培养,连续2次,得到纯的根瘤菌菌株。
纯化培养采用YMA固体培养基(甘露醇10 g·L-1,酵母提取物1 g·L-1,蒸馏水800 mL·L-1,土壤提取液200 mL·L-1,琼脂30 g·L-1)。
1.3.2扩大培养 将纯化后的菌种用5 mL无菌水洗脱于装有液体培养基(YMB)的锥形瓶(150 mL)中,至于摇床(150 r·min-1)恒温(28 ℃)培养至指数期,备用。
YMB液体培养基:甘露醇10 g·L-1、酵母提取物1 g·L-1、蒸馏水800 mL·L-1和土壤提取液200 mL·L-1,用 0.1 mol·L-1NaOH或HCl调pH值至6.8。
1.4 根瘤菌胁迫处理
于2017年1月开展根瘤菌胁迫处理。实验设5个NaCl胁迫水平,即0、10、20、30和40 g·L-1;5个活性铝(Al3+)水平,即0、25、50、75和100 μmol·L-1;4个pH水平,即4、5、6和7。通过在培养基(YMB)中加入分析纯NaCl试剂调节NaCl水平;加入分析纯AlCl3调节活性铝含量。通过在培养基(YMB)加入HCl调节pH水平。
各绿肥作物根瘤菌菌种于超净工作台接种至装有处理溶液的液体培养基中,于35 ℃、150 r·min-1的条件下摇床培养。24 h后每日测定溶液OD值(600 nm,吸光值),于对数生长期停止培养,置于4 ℃冰箱备用。以不接种为对照,各处理重复3次。
1.5 根瘤菌抗氧化酶活性测定
1.5.1细胞破碎和粗酶液提取 各处理菌液于4 ℃、8000 r·min-1离心5 min,收集菌体。将收集的菌体用磷酸缓冲液(0.05 mmol·L-1, pH 7.8,4 ℃预冷)混匀洗涤3次,置于无菌滤纸上,洗去表面余液。然后置于10 mL离心管中,记录菌体质量,加4 mL磷酸盐提取液[0.05 mmol·L-1, pH 7.8,含1% 聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP),4 ℃]混匀,置于冰上超声波破壁,离心15 min(4 ℃,1500 r·min-1),上清液为抗氧化酶粗提液,保存于-20 ℃冰箱以备用。
1.5.2抗氧化性酶活性测定 超氧化物歧化酶(superoxide dsmutase,SOD)活性的测定采用氮蓝四唑(nitro-blue tetrazolium, NBT)光化还原法[28],将NBT光化还原反应抑制到50%为一个酶活性单位(U)。过氧化氢酶(catalase,CAT)活性采用紫外吸收法测定[29],以每分钟减少0.1个OD值所需的酶量为1个酶活力单位(U)。过氧化物酶(peroxidase,POD)活性的测定采用愈创木酚法[30],在H2O2存在下POD催化愈创木酚生成棕色聚合物,在470 nm有特征吸收峰,以每分钟内A470变化为1个过氧化物酶活性单位(U)。谷胱甘肽还原酶(glutathione reductase,GR)的活性采用还原型辅酶Ⅱ(triphosphopyridine nucleotide,NADPH)法[31-32],以每分钟每毫克蛋白氧化1 nmol NADPH为一个活性单位(U)。
1.6 数据处理
采用二因素方差分析法分析品种与不同处理(酸、活性铝、盐胁迫)对种子萌发、根瘤菌抗氧化酶(SOD、CAT、POD、GR)活性的影响,显著水平为P<0.05(l.s.d)。数据为3个重复的平均值±标准误。
2 结果与分析
2.1 酸、铝、盐胁迫及品种影响发芽率及根瘤菌抗氧化酶活性的方差分析
酸、铝、盐胁迫显著影响几种豆科绿肥作物的种子发芽率及其根瘤菌的抗氧化酶活性,其中根瘤菌抗氧化酶活性较绿肥种子发芽率对胁迫更敏感(表1)。整体上,随活性铝浓度和NaCl浓度的增加及pH水平的下降,绿肥作物根瘤菌各抗氧化酶活性呈下降趋势。在胁迫条件下,不同绿肥作物的发芽率及其根瘤菌抗氧化酶活性也存在显著品种差异,且整体表现出品种与胁迫的交互作用。
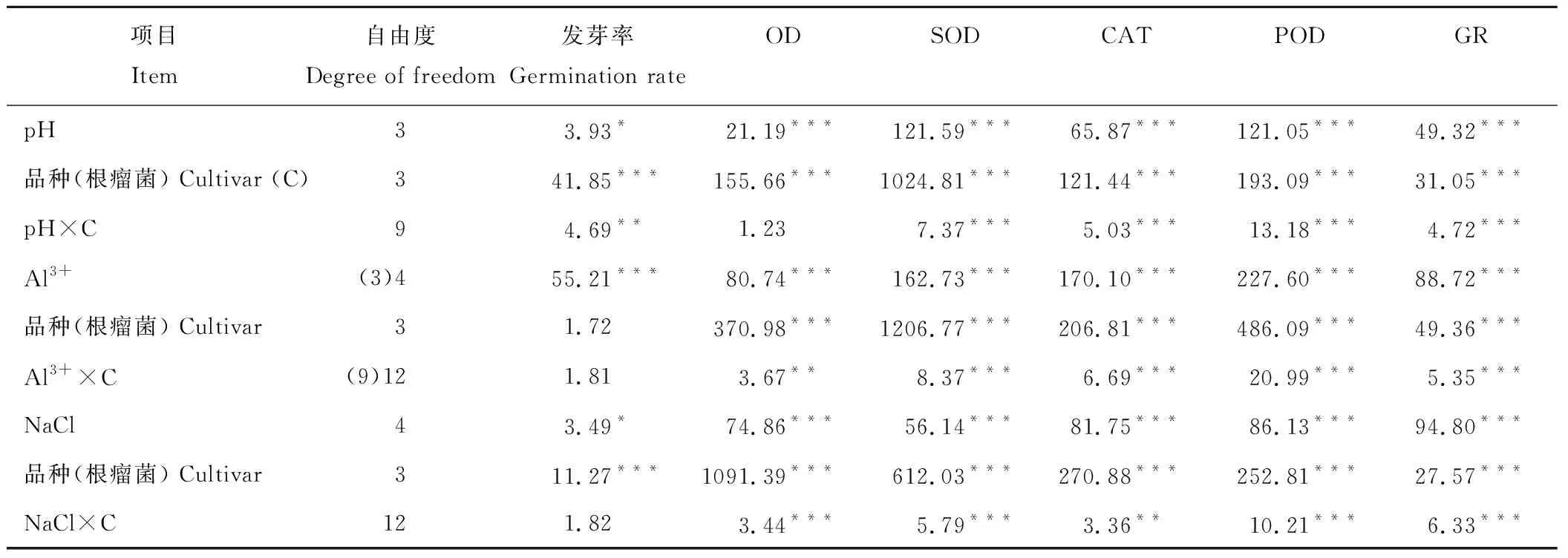
表1 酸、铝、盐胁迫及品种影响豆科绿肥作物发芽率及根瘤菌抗氧化酶活性的方差分析(F值)Table 1 Analysis of the effects of acid, aluminum, salt stress and cultivars on the germination rate and the activities of the rhizobia antioxidant enzymes in legume green manures (F value)
*,P<0.05; **,P<0.01; ***,P<0.001.
2.2 竹豆、绿豆、田菁和豇豆种子发芽率
豆科绿肥作物种子发芽率对环境pH水平、活性铝浓度及盐浓度的敏感性不同,且存在显著的品种差异(表2)。在4个pH水平下,田菁种子在pH值为4时不发芽,pH值为5时发芽率只有36.67%,而pH值为6和pH值为7时保持在60%左右;其余品种发芽率对4个pH水平无显著响应。在4个不同活性铝浓度下,所有品种均表现为发芽率随浓度增加而显著下降的趋势,且Al3+含量为0 mg·L-1时发芽率最高,至100 mg·L-1时发芽率分别下降82%(绿豆)、76%(竹豆)、65%(田菁)和54%(豇豆),至200 mg·L-1时,所有品种均无发芽。各品种发芽率对盐浓度的反应不一致,其中竹豆和绿豆在NaCl 达到40 mmol·L-1时最高,显著高于120和200 mmol·L-1时;田菁在120 mmol·L-1时达到最大值,显著高于其他盐浓度时的发芽率;而豇豆在各盐浓度下均无显著差异。
2.3 酸胁迫对根瘤菌生长及抗氧化酶活性的影响
豆科绿肥作物根瘤菌的生长及抗氧化酶活性对环境pH水平的变化较为敏感(表3)。随着pH水平的提高,各根瘤菌菌液的OD值呈增加趋势。竹豆和豇豆根瘤菌pH值为6和pH值为7时的OD显著高于pH值为4和pH值为5时;田菁根瘤菌pH值为7时的OD值显著高于pH值为5和pH值为6时,而pH值为4时的OD值最低;绿豆根瘤菌OD值处理间差异不显著。不同品种根瘤菌间比较,pH值为4时的OD值,豇豆根瘤菌为1.67,显著高于竹豆根瘤菌(1.35);而绿豆根瘤菌和田菁根瘤菌均低于1.2。
各根瘤菌抗氧化酶活性,整体随pH水平的增加呈增加趋势,且pH值为7时的SOD、CAT、POD及GR酶活性显著高于pH值为4时的(表3)。根瘤菌SOD酶活性对pH最敏感的是田菁根瘤菌,其pH值为5、6和7时的SOD酶活性较pH值为4时分别增加122%、266%和625%;竹豆和绿豆根瘤菌SOD酶活性较pH值为4时提高32%~116%;而豇豆根瘤菌SOD酶活性较pH值为4提高不足50%。CAT酶活性对pH最敏感的是绿豆根瘤菌,其pH值为5、6和7时的CAT酶活性较pH值为4时分别增加96%、216%和315%;竹豆、田菁和豇豆根瘤菌pH值为7时的CAT酶活性较pH值为4分别提高185%、224%和167%。POD酶活性对pH最敏感的是竹豆根瘤菌, 其pH值为5、6和7时的POD酶活性较对照分别增加113%、229%和248%;绿豆、田菁和豇豆根瘤菌pH值为7时的POD酶活性较pH值为4分别提高114%、83%和153%。GR酶活性对pH最敏感的是豇豆根瘤菌,其pH值为5、6和7时的GR酶活性较pH值为4时分别增加185%、270%和390%;竹豆、绿豆和田菁根瘤菌pH值为7时的GR酶活性较pH值为4分别提高225%、181%和193%。
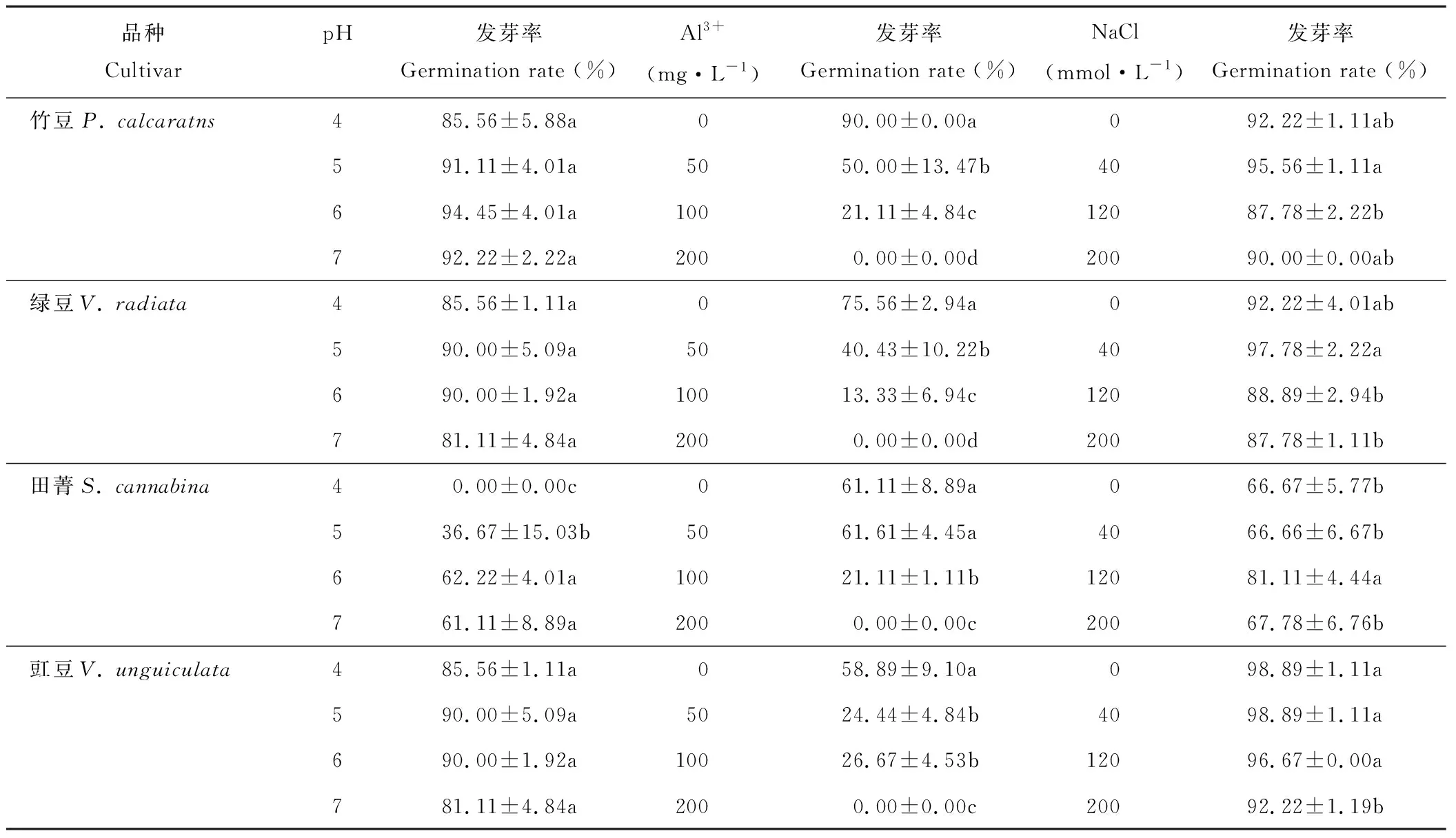
表2 盐、铝和酸胁迫对竹豆、绿豆、田菁和豇豆种子萌发的影响Table 2 Effects of salt, aluminum and acid stresses on seed germination of P. calcaratns, V.radiata, S. cannabina and V. unguiculata
注:同品种不同处理数值后小写字母不同表示显著(P<0.05)。下同。
Note: Different lower case letters after the value for same cultivar represented significance difference atP<0.05 (l.s.d). The same below.
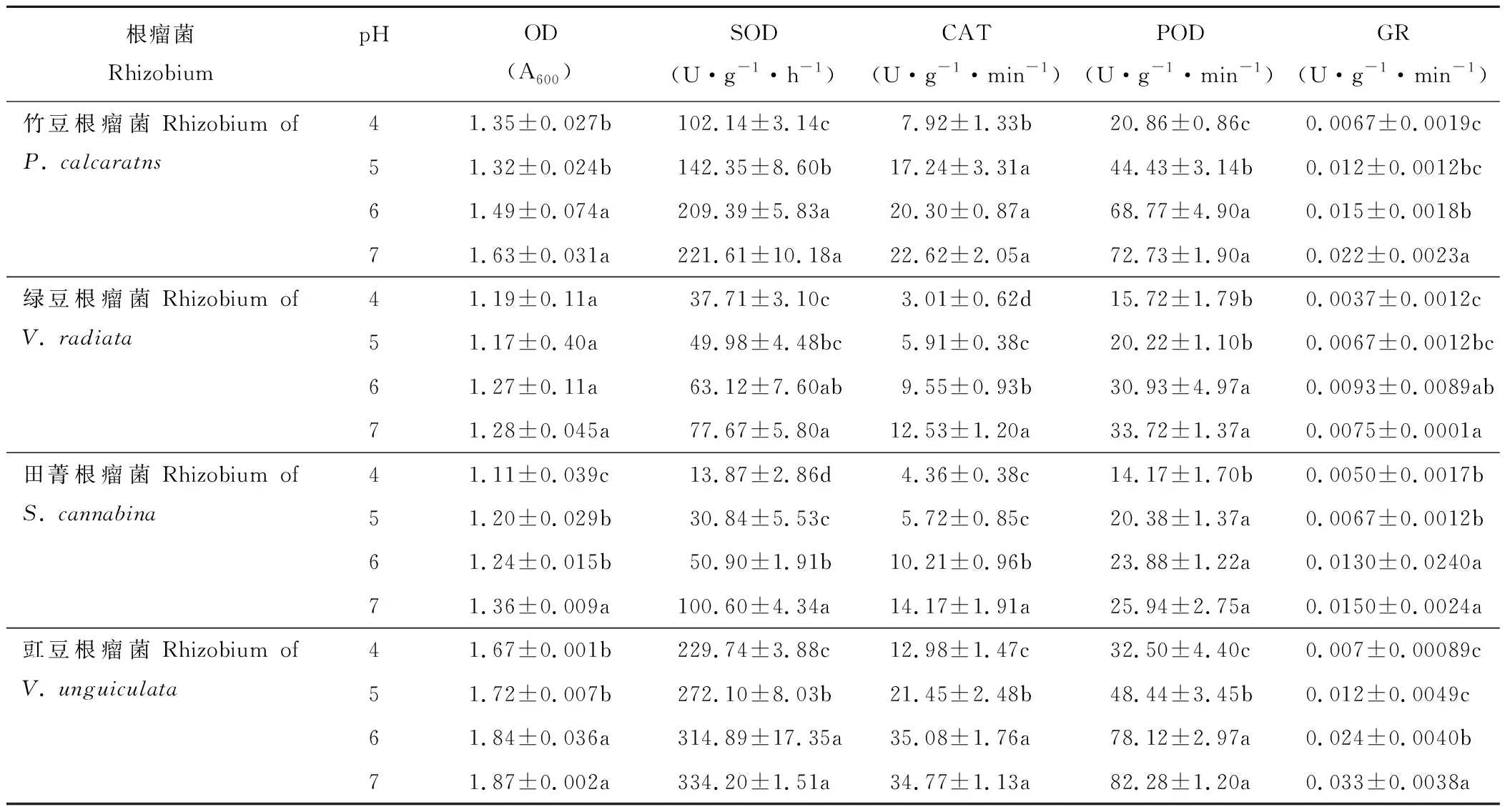
表3 酸胁迫对竹豆、绿豆、田菁和豇豆根瘤菌生长及抗氧化酶活性的影响Table 3 Effects of acid stress on the growth and antioxidant enzymes activities of rhizobia of P. calcaratns, V. radiata, S. cannabina and V. unguiculata
2.4 铝胁迫对根瘤菌生长及抗氧化酶活性的影响
铝胁迫显著影响豆科绿肥作物根瘤菌的生长及抗氧化酶活性(表4)。整体上,随着活性铝浓度的增加,各根瘤菌菌液OD值呈下降趋势。活性铝浓度低于50 μmol·L-1时,各豆科根瘤菌OD值较对照无显著变化;当活性铝浓度增加至75和100 μmol·L-1时,OD值较对照显著下降。品种根瘤菌间比较,100 μmol·L-1时的OD值,豇豆根瘤菌为1.65,显著高于竹豆根瘤菌(1.26);而绿豆和田菁根瘤菌分别为1.08和0.84。
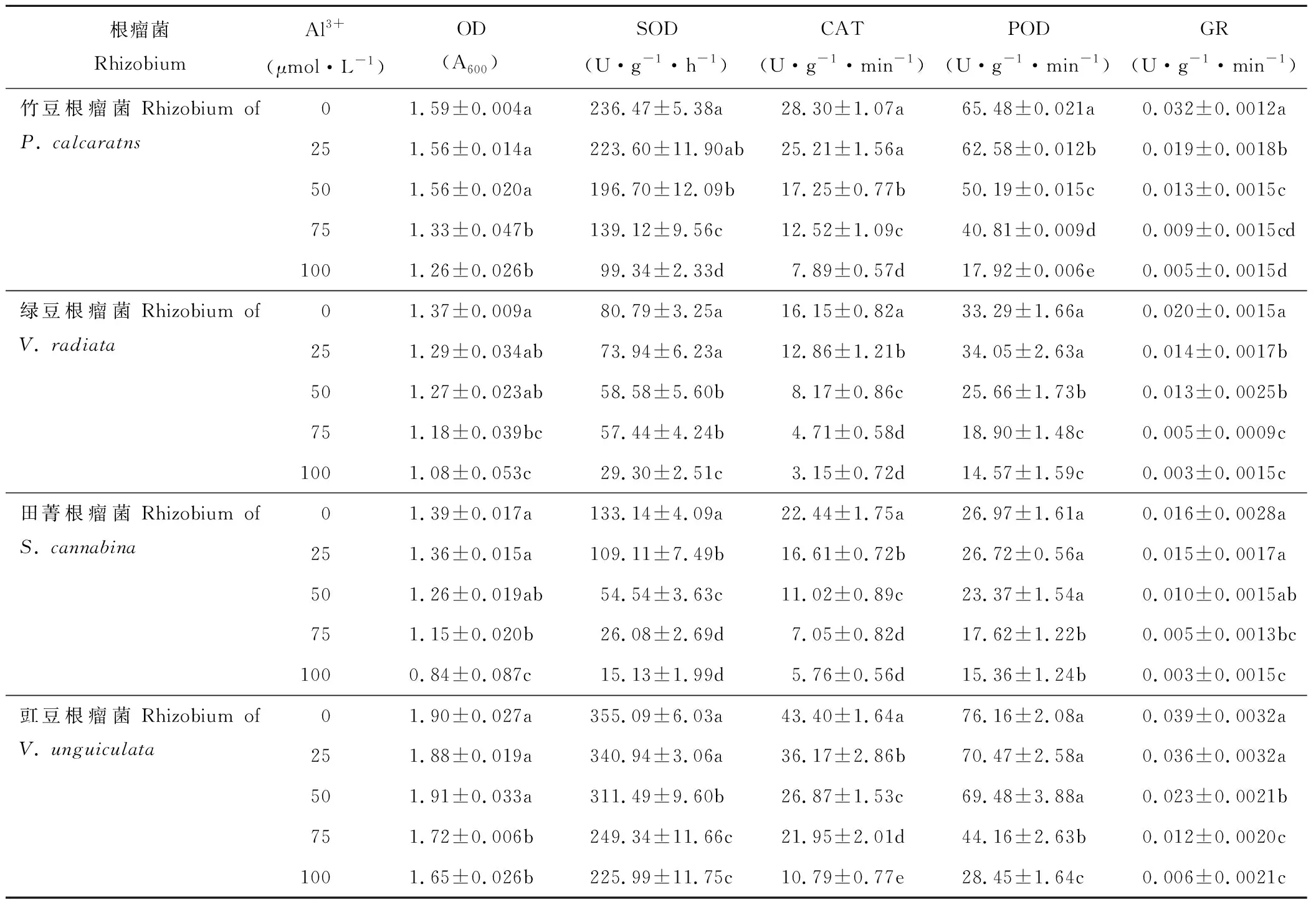
表4 铝胁迫对竹豆、绿豆、田菁和豇豆根瘤菌生长及抗氧化酶活性的影响Table 4 Effects of aluminum stress on the growth and antioxidant enzymes activities of rhizobia of P. calcaratns, V. radiata, S. cannabina and V. unguiculata
各根瘤菌抗氧化酶活性随活性铝浓度的增加呈下降趋势。根瘤菌SOD酶活性对活性铝最敏感的是田菁根瘤菌,其0、25、50和75 μmol·L-1时的SOD酶活性较100 μmol·L-1分别增加779%、621%、260%和72%;竹豆和绿豆根瘤菌SOD酶活性较100 μmol·L-1增加40%~175%;而豇豆根瘤菌SOD酶活性较100 μmol·L-1升幅不足60%。CAT酶活性对活性铝最敏感的是绿豆根瘤菌,其0、25、50和75 μmol·L-1Al3+时的CAT酶活性较100 μmol·L-1时分别增加412%、307%、159%和49%;竹豆、田菁和豇豆根瘤菌0 μmol·L-1时的CAT酶活性较100 μmol·L-1分别提高258%、289%和302%。POD酶活性对活性铝最敏感的是竹豆根瘤菌,其0、25、50和75 μmol·L-1时的POD酶活性较对照分别增加265%、249%、180%和127%;绿豆、田菁和豇豆根瘤菌0 μmol·L-1时的POD酶活性较100 μmol·L-1分别提高128%、75%和167%。各菌液GR酶活性100 μmol·L-1时较0 μmol·L-1下降422%~555%,品种根瘤菌间GR酶活性差异较其他酶活性小。
2.5 盐胁迫对根瘤菌生长及抗氧化酶活性的影响
随着NaCl浓度的增加,各根瘤菌菌液OD值呈下降趋势,且存在品种差异(表5)。当NaCl浓度由0 g·L-1增加至10 g·L-1时,绿豆根瘤菌OD值显著下降,而其他品种无显著变化;当浓度继续增加至20 g·L-1时,除竹豆根瘤菌外,其余根瘤菌OD均显著下降;当浓度达到40 g·L-1时,竹豆、绿豆、田菁和豇豆根瘤菌OD值较对照显著下降分别为11%、14%、12%和9%。
各根瘤菌抗氧化酶活性随NaCl浓度的增加也整体呈下降趋势(表5)。当NaCl浓度由0 g·L-1增加至20 g·L-1时,竹豆和绿豆根瘤菌SOD酶活性无显著变化;田菁和豇豆根瘤菌SOD酶活性显著下降;当浓度达到40 g·L-1时,竹豆、绿豆、田菁和豇豆根瘤菌SOD酶活性较对照显著下降53%、38%、45%和33%。田菁和绿豆根瘤菌CAT酶活性对较低浓度NaCl(20 g·L-1)无显著响应,而竹豆和绿豆根瘤菌显著下降;当NaCl 浓度达到40 g·L-1时,竹豆、绿豆、田菁和豇豆根瘤菌CAT酶活性较对照下降45%左右。竹豆和绿豆根瘤菌POD酶活性对低浓度NaCl(20 g·L-1)无显著响应,而田菁和豇豆根瘤菌显著下降;当NaCl 浓度达到40 g·L-1时,竹豆、绿豆、田菁和豇豆根瘤菌POD酶活性较对照下降62%、36%、52%和58%。绿豆和田菁根瘤菌GR酶活性对较低浓度NaCl(20 g·L-1)无显著响应,而竹豆和豇豆根瘤菌较对照显著下降;当NaCl浓度达到40 g·L-1时,竹豆、绿豆、田菁和豇豆根瘤菌GR活性较对照分别显著下降84%、73%、67%和87%。
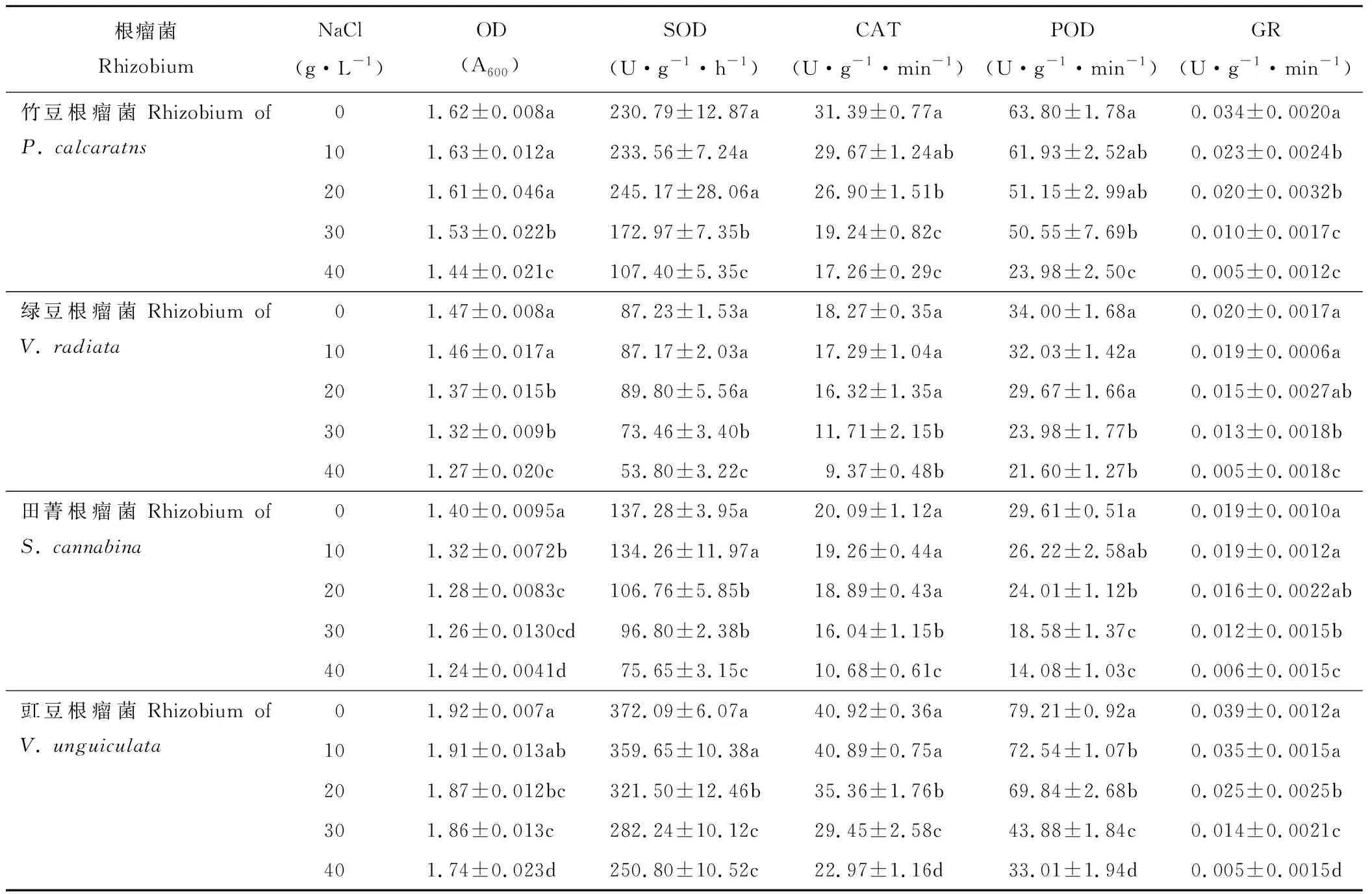
表5 盐胁迫对竹豆、绿豆、田菁和豇豆根瘤菌生长及抗氧化酶活性的影响Table 5 Effects of salt stress on the growth and antioxidant enzymes activities of rhizobia of P. calcaratns, V. radiata, S. cannabina and V. unguiculata
3 讨论
在逆境土壤,种子的成功萌发与根瘤的形成是确保豆科作物正常生长的关键[33]。本试验中,土壤盐碱化、酸化和活性铝含量增加均显著抑制豆科作物种子萌发及根瘤菌抗氧化酶活性,说明这些土壤环境不利于豆科作物种子的萌发和共生固氮体系的建立,制约着豆科作物在生产中的推广种植。然而,豆科作物品种对逆境胁迫的响应存在品种差异[34]。如田菁种子发芽率对pH较敏感,pH值为4时不发芽,pH值为5时发芽率只有36.67%,显著低于弱酸性至中性环境;而竹豆、绿豆和豇豆种子对pH变化无显著响应。因此,在酸性土壤选择豆科绿肥作物时可不考虑田菁。活性铝含量增加是酸性土壤引起植物生长不良主要原因之一[35]。本试验中,当活性铝浓度达到100 mg·L-1时,所有品种发芽率降幅均超过50%,其中绿豆降幅高达82%,表现最为敏感;至200 mg·L-1时,所有品种均无发芽。因此,在活性铝含量较高的酸性土壤,种植豆科作物之前需要通过调节土壤酸碱性[36],降低活性铝含量[37],以提高豆科作物的种子萌发。如施用石灰被广泛用于改良酸性土壤,提高作物生产[38]。几种豆科绿肥作物的发芽率对盐浓度的反应不一致,且一定的NaCl浓度有利于种子萌发。如竹豆和绿豆的发芽率在NaCl 达到40 mmol·L-1时最高,田菁在120 mmol·L-1时达到最大值,而豇豆在不同NaCl浓度下无显著差异。品种间存在的耐盐性差异可能与不同作物对盐分离子的吸收和累计具有不同的特点有关[39],其中豇豆和田菁萌发期可能通过吸收较多钠离子提高细胞束缚水的能力,以抵御盐害。
相对于种子萌发,豆科绿肥作物根瘤菌对酸、活性铝及盐的敏感性较高。整体上,随着pH水平的下降、活性铝浓度增加和盐浓度的增加,根瘤菌的生长及抗氧化酶活性均受到不同程度的抑制。一方面,不利的土壤环境条件可通过影响根瘤菌的繁殖,降低其与宿主植物之间的亲和性[40]。另一方面,根瘤菌抗氧化酶参与其对逆境的适应性调节过程[41],以保证其在逆境中的存活。如SOD能消除根瘤菌在新陈代谢过程中产生的有害物质[42],POD(CAT)能水解去除H2O2、氢化有毒化合物等[43],而GR能保护细胞免受氧化剂和抗生素的影响[44]。这些酶活性在逆境中的下降可能也是导致根瘤菌生长受阻的直接原因。在Cu2+浓度≤0.8 mmol·L-1胁迫下,苜蓿中华根瘤菌抗性菌株可通过提高SOD、CAT、GPX、GR的活性以降低Cu2+的毒害效应[21]。
本试验中,酸胁迫下竹豆、豇豆和田菁根瘤菌OD值显著降低,而绿豆根瘤菌变化较小;当NaCl浓度增加至20 g·L-1时,竹豆根瘤菌OD无显著变化,而其余根瘤菌OD均显著下降。说明不同豆科绿肥作物根瘤菌对不同逆境胁迫的响应存在明显的品种差异,如绿豆根瘤菌相对耐酸,而竹豆根瘤菌相对耐盐。这种差异可能与不同品种根瘤菌抗氧化酶的调节能力不同有关[41]。如根瘤菌SOD酶活性对pH和活性铝最敏感的是田菁根瘤菌,CAT酶活性对pH和活性铝最敏感的是绿豆根瘤菌,POD酶活性对pH和活性铝最敏感的是竹豆。在苜蓿根瘤菌的研究中,李智燕等[23]发现天蓝苜蓿根瘤菌的CAT、POD和GR酶活性随活性铝浓度增大显著下降,而紫花苜蓿根瘤菌的SOD、CAT及GR酶活在低铝胁迫下无显著变化,在高铝胁迫下显著下降。这些结果说明,不同根瘤菌中参与抵御逆境的抗氧化酶存在差异。品种间根瘤菌抗氧化酶活性调节能力的差异可能与各自遗传背景有关,而且这种对能力是相对稳定的[45]。
综合分析认为,不同夏季豆科绿肥品种中,田菁不耐酸、铝胁迫,但对盐胁迫有一定耐受性;竹豆、绿豆和豇豆对低浓度的盐和弱酸性环境有一定耐受性;但是所有品种对活性铝浓度增加较为敏感。在酸性和盐碱化土壤,较高浓度的H+、活性铝或NaCl抑制种子萌发,减缓根瘤菌的生长,降低根瘤菌对有害物质的抗氧化能力,最终限制豆科绿肥作物的早期生长。整体而言,根瘤菌抗氧化酶活性较发芽率对胁迫敏感。

