扩散峰度成像动态定量检测兔轻度脑外伤模型早期变化及其与β-淀粉样前体蛋白阳性表达的相关性
熊婧彤,伍建林,张 清,沈 晶
(1.大连医科大学附属第二医院放射科,辽宁 大连 116023;2.大连大学附属中山医院放射科,辽宁 大连 116001)
轻度脑外伤(mild traumatic brain injury, mTBI)约占创伤性脑损伤的75%,WHO将其定义为脑外伤致短暂意识丧失小于30 min,短时记忆障碍或定向障碍小于24 h,或二者同时存在[1-2]。MR扩散峰度成像(diffusion kurtosis imaging, DKI)是基于DTI的非独立成分多 b值扩散加权成像,可进行水分子非高斯分布组织异质性分析,弥补DTI对脑灰质结构扩散不敏感等缺陷[3]。本研究旨在建立兔脑mTBI模型,观察损伤早期DKI定量指标动态变化,并探讨其与β-淀粉样前体蛋白(β-amyloid precursor protein, β-APP)阳性表达的相关性。
1 材料与方法
1.1实验对象与分组 健康6月龄新西兰白兔15只[SPF级,由大连医科大学标准动物实验中心提供,实验动物许可证号:SCXK(辽)2013-0003],雌雄不限,体质量2.25~2.90 kg,平均(2.52±0.34)kg,采用随机数字表法分成损伤组12只(包括伤后6 h、24 h、48 h、72 h共4个亚组,每亚组3只)和对照组3只。本实验通过本院医学伦理委员会批准。
1.2 模型建立与兔行为学观察 参阅既往文献[4],采用自制快速旋转致动物脑损伤装置建模,实验装置由本课题组与大连现代高科技发展公司共同研制。将清醒兔保定于兔笼内,快速旋转90°,使千斤顶压缩弹簧于储能状态瞬间释放(相当于承受损伤角速度248.50~282.58 rad/s)产生的剪应力致兔脑损伤。装置模式图及实物图见图1。建模后置实验兔于空旷处,从运动、姿势、意识、眼功能、呼吸等进行行为学观察与记录。常规MR检查(T1W、T2W及Flair序列)呈阴性表现而实验兔出现神经功能方面症状为建模成功。对照组兔直接观察其行为,之后进行MR检查。
1.3 MR检查 对损伤组兔分别在建模后超急性期(6 h)、急性期(24 h、48 h)、亚急性早期(72 h)采用3%戊巴比妥钠50 mg/kg体质量腹腔麻醉后行MR检查;对照组兔观察行为学后即刻麻醉,行MR检查。应用Siemens 3.0T Magnetom Verio 超导型MR扫描仪,8通道膝关节线圈。扫描序列包括T1W、T2W、T2 FLAIR及DKI序列,主要参数见表1。其中DKI序列b值为0、1 000、2 000 s/mm2,在30个方向上施加梯度磁场。

图1 自制快速旋转致兔脑损伤装置示意图(A)及实物图(B)

参数T1WT2WT2 FLAIRDKITR(ms)1 7104 3004 3006 800TE(ms)2.39118109120层厚(mm)1.52.02.02.0扫描层数25252525FOV(mm×mm)150×150128×128128×128128×128带宽(kHz)170260260752NEX2534
1.4 数据处理与测量 利用基于MatLab平台的扩散峰度测量器(diffusion kurtosis estimator, DKE)软件处理DKI数据[3],解读平均扩散峰度(mean kurtosis, MK)、轴向扩散峰度(axial kurtosis, K//)与径向扩散峰度(radial kurtosis, K┴)数据信息,生成相应图像,见图2。 应用Image J软件对ROI数据进行读取与测量。参照兔脑解剖[5],于脑白质、丘脑、中脑、桥脑及延髓皮层下选取ROI,双侧对称性、多层面放置ROI,每个ROI大小约1~3个像素;皮层下白质ROI包括双侧额、顶、颞、枕叶白质,每侧各脑叶不少于3个,取其平均值;避开脑室/池系统、大血管、骨骼等。所有ROI放置及测量均由同一名熟练实验者完成。
1.5 病理学检查及观察 MR扫描后即刻处死实验兔,并迅速取脑组织,固定、包埋,行HE染色和β-APP免疫组化染色,计数ROI区每5个高倍视野(×400)下β-APP染色阳性轴突数,以轴突出现棕黄色颗粒状沉积为阳性表达,取其平均值。
1.6 统计学分析 采用SPSS 16.0统计分析软件。计量资料为非正态分布时以中位数(上下四分位数)表示,符合正态分布则以±s表示。采用多个独立样本秩和检验比较损伤组与对照组间MK、K//及K┴值的总体差异,并以两独立样本秩和检验两两比较损伤组各亚组与对照组间的差异。采用单因素方差分析比较损伤组与对照组间各测量脑区β-APP染色阳性轴突数的总体差异,并以LSD-t检验两两比较损伤组各亚组与对照组间的差异。MK、K//及K┴值与β-APP染色阳性轴突数的相关性分析采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 兔mTBI建模及DKI定量检测动态演变 建模后损伤组出现精神不振、蹲坐、活动减少、短暂性四肢行走拖曳、闭目、呼吸紊乱急促等神经功能损伤症状,未见昏睡、昏迷,提示建模成功;其中1只兔因建模意外致颅颈分离死亡,后补充建模成功,建模成功率为92.31%(12/13)。对照组未见行为异常。损伤组MK值于皮层下白质随损伤时间呈一过性升高后持续减低趋势,丘脑一过性减低后持续性升高,脑干区MK值始终高于对照组(P<0.05)。K//与K┴值于皮层下白质、丘脑及中脑均表现为伤后24 h内持续升高,至48 h一过性减低后再次升高趋势,桥脑及延髓K//与K┴值均较对照组持续性升高(P均<0.05)。见图2、表2~4。
2.2 mTBI兔脑病理学观察 损伤组及对照组实验兔脑大体标本无明显肉眼可见脑挫裂伤、脑实质损伤或血肿等改变(图3A)。损伤组伤后6 h亚组兔见受损轴突增粗、呈红色深染,神经元轻度水肿,部分轴突β-APP染色见棕黄色颗粒沉积;伤后24 h亚组神经元肿胀显著,胞体增大、胞质淡染;伤后48 h亚组轴突内棕黄色颗粒沉积减少,大多轴突蓝染呈阴性表现;伤后72 h亚组可见较多深染增粗轴突,散在固缩神经元,胞质呈深红色,部分细胞核溶解(图3)。兔脑损伤后β-APP阳性轴突数总体上始终高于伤前,呈逐渐增加后一过性减少又增加趋势。见表5。
表2 各组实验兔不同脑区MK值比较[中位数(上下四分位数)]
注:*:与对照组比较,P<0.05;△:与损伤组伤后6 h亚组比较,P<0.05;▲:与损伤组伤后24 h亚组比较,P<0.05;◇:与损伤组伤后48 h亚组比较,P<0.05

表3 各组实验兔不同脑区K//值比较[中位数(上下四分位数)]
注:*:与对照组比较,P<0.05;△:与损伤组伤后6 h亚组比较,P<0.05;▲:与损伤组伤后24 h亚组比较,P<0.05;◇:与损伤组伤后48 h亚组比较,P<0.05
2.3β-APP阳性轴突表达与DKI测量值相关分析 除丘脑外,各测量脑区MK值均与β-APP阳性轴突数呈正相关;中脑K//值与β-APP阳性轴突数呈正相关;中脑、桥脑及延髓K┴值均与β-APP阳性轴突数均呈正相关。见表6。
3 讨论

表4 各组实验兔不同脑区K┴值比较[中位数(上下四分位数)]
注:*:与对照组比较,P<0.05;△:与损伤组伤后6 h亚组比较,P<0.05;▲:与损伤组伤后24 h亚组比较,P<0.05;◇:与损伤组伤后48 h亚组比较,P<0.05
表5 各组实验兔不同脑区β-APP阳性轴突数比较(±s)

表5 各组实验兔不同脑区β-APP阳性轴突数比较(±s)
组别皮层下白质丘脑中脑桥脑及延髓损伤组(n=12) 伤后6 h亚组4.83±1.47∗6.71±2.87∗13.80±3.19∗14.20±3.27∗ 伤后24 h亚组4.67±1.86∗9.00±4.30∗7.33±1.37∗△11.33±3.67∗ 伤后48 h亚组3.17±1.17∗7.60±2.70∗6.40±2.41∗△▲5.67±0.52△▲ 伤后72 h亚组6.40±2.79∗△11.33±3.39∗△10.50±1.05∗△▲◇11.00±3.54∗◇对照组(n=3)1.00±0.891.67±1.211.43±1.132.83±1.17F值8.018.4235.8216.43P值<0.01<0.01<0.01<0.01
注:每一脑区观察5个视野(×400),取平均值;*:与对照组比较,P<0.05;△:与损伤组伤后6 h亚组比较,P<0.05;▲:与损伤组伤后24 h亚组比较,P<0.05;◇:与损伤组伤后48 h亚组比较,P<0.05
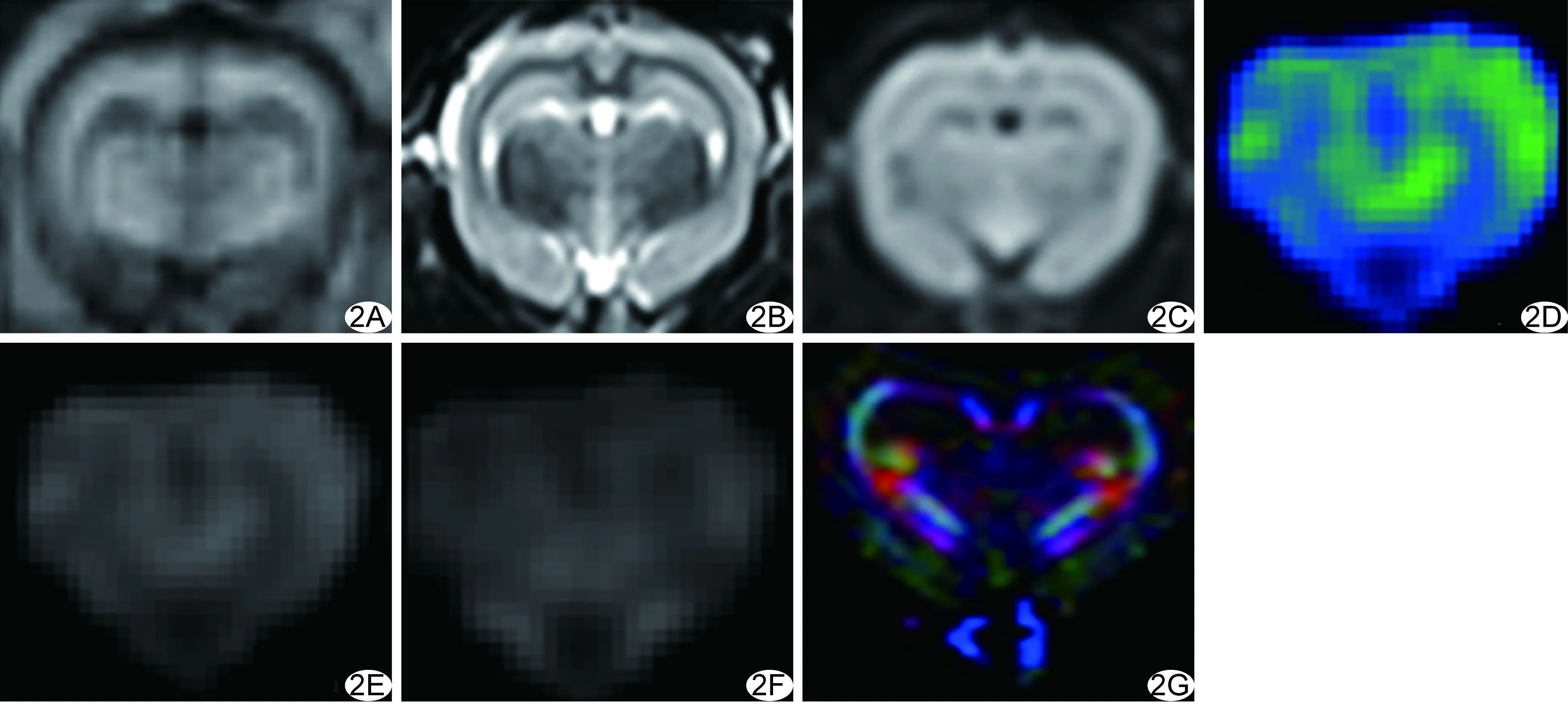
图2兔脑MR图(对照组为例) A~G.分别为兔脑伤前T1WI、T2WI、T2 FLAIR、MK、K//、K┴及DKI方向图
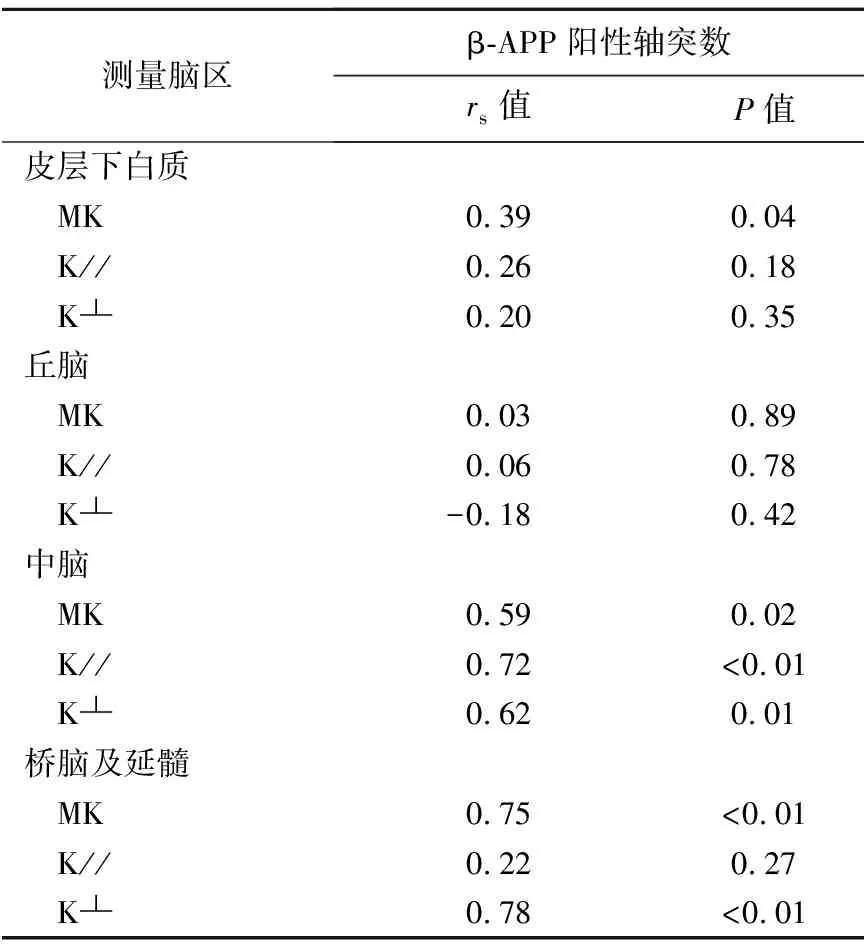
表6 mTBI模型兔各测量脑区MK、K//、及K┴值与β-APP阳性轴突数的相关性分析
3.1 兔脑mTBI建模与测量脑区选择 既往研究[6]发现,旋转性致脑损伤模型可较好模拟临床上脑剪切力作用产生的TBI。本研究损伤组实验兔均出现不同程度神经功能损伤症状,但未见明显昏睡、昏迷,符合mTBI定义,且病理观察发现兔脑组织内存在神经轴突微结构损伤,进一步验证建模有效,建模成功率高(12/13,92.31%)。本研究选取TBI易受累的皮层下白质、丘脑、脑干进行观察。目前国内外对脑干区TBI研究较为宽泛,本研究将其细分为中脑、桥脑及延髓,
分别进行观察,结果证实其DKI测量值与病理学动态变化均有不同,表明此分区观察和研究具有意义。
3.2 DKI测量值动态演变及其病理学机制 MK值可反映水分子各向平均扩散峰度,其增高提示组织结构复杂性增加,呈非正态分布的水分子扩散受限显著,其降低则与组织微结构破坏、缺血缺氧性改变致脑血流量减少有关[3,7]。根据K//与K┴值可对组织微结构不同方向弥散扩散受限情况进行分析,二者数值越大,提示非高斯分布水分子扩散受限越显著[8]。β-APP正常情况下在神经元内表达水平低,发生脑机械性损伤、缺血、缺氧等情况时可被诱导聚集[9]。本研究中伤后6 h亚组多数测量脑区MK、K//与K┴值均较对照组增高,系瞬间剪应力致离子泵功能障碍,造成细胞毒性水肿,扩散受限,病理表现为轴突及神经元轻度肿胀;同时激活半胱氨酸蛋白酶降解轴突骨架结构,轴突断裂、运输中断,β-APP异常聚集,故阳性轴突数增多(P<0.05)[10]。部分脑区伤后48 h DKI测量值出现一过性减低的“拐点”,β-APP阳性轴突数减少,系轴突断裂处轴浆外溢、代偿性自发修复减轻轴突肿胀,组织微结构扩散受限情况好转;另一方面此阶段激活β-分泌酶限制β-APP生成,间接加速其清除[11]。至伤后72 h 可见较多阳性表达的形态多样受损轴突及神经元,组织微结构复杂性增加,扩散受限显著,导致DKI测量升高。
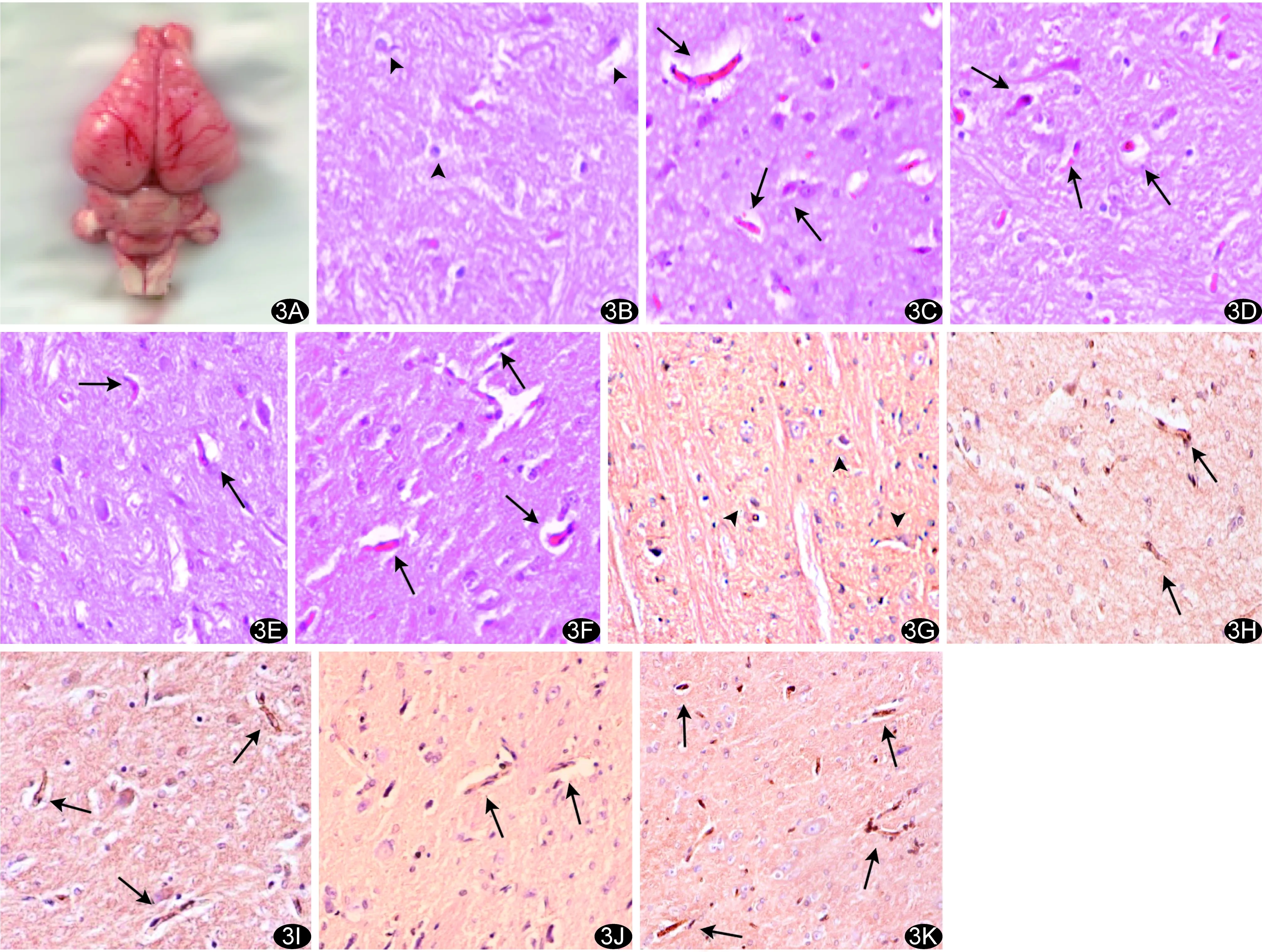
图3兔脑病理学观察 A.正常兔脑组织大体图; B~F.依次为正常、mTBI损伤后6 h、24 h、48 h、72 h 桥脑HE染色病理图(×400); G~K.依次为正常、mTBI损伤后6 h、24 h、48 h、72 h桥脑β-APP染色病理图(×400) (箭示mTBI损伤轴突;箭头示正常轴突)
3.3 DKI测量值与β-APP阳性表达的相关性 本研究中各脑区DKI测量值大多与β-APP阳性轴突数呈正相关,表明其可较好反映组织结构微损伤情况,同时提示脑干对mTBI损伤敏感,与既往研究结果[12]一致。这是由于脑干白质含量丰富、结构复杂,在灰质与白质间存在大面积网状纤维结构交织,包含重要生命中枢,其临床意义在于可通过检测脑干区功能MR测量值变化评估mTBI组织微结构损伤情况。此外,本研究发现中脑、桥脑及延髓DKI测量值变化趋势及其与病理学相关性存在差异,推测与其解剖微结构差异有关。中脑含有红核、黑质等重要神经核团,通过错综复杂的白质纤维与其他中枢神经系统相联系,而桥脑及延髓白质纤维走行相对一致,故承受垂直于脑干长轴方向的剪切力作用后微结构损伤有所差异。
本研究局限性在于:TBI模型不能完全涵盖人TBI时所承受的加速、减速、过负荷等作用,损伤动物存活时间相对较短、数量有限,难以评估TBI远期后遗症。
总之,DKI技术可作为早期定量评估mTBI组织微结构病理损伤的有效检查方式。

