DTI观察难治性抑郁症患者不同脑区微观结构改变
张梅花,余德洪,赵建江,魏文艳,沈 云
(浙江萧山医院放射科,浙江 杭州 311202)
抑郁症是一种严重影响患者身心健康的精神心理疾病,其确切发病机制尚不明确,临床治疗困难,部分患者在经过2种或以上抗抑郁药物足量、足疗程治疗后仍无效或疗效甚微,而逐渐转为难治性抑郁症(treatment-resistant depression, TRD)[1]。目前临床主要通过国内或国际抑郁诊断标准及量表评分等诊断抑郁症,并对其严重度进行判断,这些方法均存在主观性较强、精确性较差等局限性。MR成像设备的更新换代及相关脑功能成像技术的兴起及成熟,为客观评价抑郁症患者的脑结构和功能改变,从而探索其神经病理学机制提供了简单、无创的在体动态监测手段。本研究采用DTI技术研究TRD患者不同脑区域微观结构改变。
1 资料与方法
1.1一般资料 收集2015年8月—2017年10月我院心理卫生科收治的18例TRD患者(TRD组),男8例,女10例,年龄18~65岁,平均(41.4±2.5)岁,平均受教育(13.35±2.22)年;MR检查前2周内均未服用抗抑郁药物。TRD诊断标准:符合ICD-10或CCMD-3抑郁发作诊断标准,且用现有2种或2种以上抗抑郁药,经足够剂量、足够疗程(6周以上)治疗后无效或收效甚微[1]。收集同期年龄、性别、受教育程度相匹配的18名正常志愿者为对照组,男7名,女11名,年龄17~66岁,平均(40.6±3.1)岁,平均受教育 (14.25±1.23)年。排除标准:头部外伤史;精神发育迟滞;严重躯体疾病;MRI发现脑器质性病变;酒精和药物滥用史;一级亲属罹患精神分裂症、心境障碍及其他严重精神疾病。所有受试者均为右利手。本项目经本院伦理委员会批准,受试者均知情并签署知情同意书。
1.2仪器与方法 采用GE Signa HDxt 1.5T全身超导MR扫描仪,头部正交线圈。扫描参数:轴位T1W,TR 420 ms,TE 8.49 ms,FOV 36 mm×36 mm,NEX 2,层厚8 mm;轴位T2W,TR 3 200 ms,TE 102 ms,FOV 24 cm×24 cm,NEX 2,层厚6 mm;轴位T2-液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)序列,TR 8 500 ms,TE 155 ms,FOV 24 cm×24 cm,NEX 1,层厚 6 mm;矢状位T1-FLAIR序列,TR 1 750 ms,TE 24 ms,FOV 24 cm×24 cm,NEX 2,层厚6 mm;轴位EPI序列DWI (b=0、1 000 s/mm2),TR 4 560 ms,最短TE,FOV 24 cm×24 cm,层厚6 mm。DTI扫描:采用单次激发自旋回波平面回波成像序列行全脑轴位扫描,TR 8 000 ms,最短TE,b值为0、1 000 s/mm2,扩散敏感梯度施加方向为15个,FOV 24 cm×24 cm,层厚5 mm。
1.3图像分析 将图像传送输至PACS系统,观察各序列图像有无脑内异常信号。以侧脑室和第三脑室4点等级评定法[2]对所有受试者的侧脑室及第三脑室进行分级:A级为正常;B级为轻度扩张;C级为中度扩张;D级为重度扩张。于矢状位T1-FLAIR图像上胼胝体最大层面测量胼胝体压部、体部和膝部厚度。
采用AW4.6工作站和FuncTool后处理软件包重建DTI图像,获得FA图和ADC图,根据脑解剖结构不同选择合适大小的圆形ROI,分别测量不同脑区的FA值及ADC值,包括双侧额上回、额中回和额下回、胼胝体膝部和压部、右侧内囊前支、膝部和后支、扣带回前部、双侧海马、右侧中央前回和中央后回以及双侧丘脑。
1.4统计学分析 采用SPSS 13.0统计分析软件。计量数据用±s,2组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
所有受试者常规T1WI、T2WI、FLAIR及DWI均未见异常信号。对照组侧脑室及第三脑室大小正常,均为A级;TRD组中16例侧脑室及第三脑室为A级(图1A),2例略扩张为B级(图1B)。TRD组与对照组胼胝体各部的厚度差异均无统计学意义(P均>0.05,表1)。

图1 侧脑室分级图 A.患者女,36岁,TRD组,侧脑室分级为A级; B.患者女,57岁,TRD组,侧脑室分级为B级

组别胼胝体压部胼胝体体部胼胝体膝部TRD组9.94±2.205.41±1.6710.42±1.98对照组10.87±1.205.62 ±1.319.98±2.21t值-1.575-0.4200.629P值0.1230.6770.534
TRD组与对照组各脑区ADC值差异均无统计学意义(P均>0.05);TRD组双侧额中回和额下回、胼胝体膝部和压部、扣带回前部、双侧海马的FA值低于对照组,差异均有统计学意义(P均<0.05),其他脑区两组间FA值差异均无统计学意义(P均>0.05)。见表2,图2、3。
3 讨论
表2 不同脑区TRD组与对照组ADC值及FA值比较(±s)

表2 不同脑区TRD组与对照组ADC值及FA值比较(±s)
脑区ADC值(×e-10 mm2/s)TRD组对照组t值P值FA值TRD组对照组t值P值右侧额上回8.23±1.128.65±1.18-1.0950.2810.37±0.050.38±0.05-0.6000.553右侧额中回7.55±5.50.7.49±4.900.0350.9730.31±0.070.42±0.07-5.062<0.001右侧额下回7.94±2.787.67±3.520.2550.8000.27±0.070.34±0.04-3.6830.001左侧额上回7.98±2.238.09±3.09-0.1230.9030.32±0.030.33±0.06-0.6330.531左侧额中回8.01±1.307.96±1.710.0990.9220.32±0.030.42±0.06-6.325<0.001左侧额下回7.94±2.787.52±2.020.5190.6070.28±0.030.39±0.07-5.789<0.001胼胝体膝部9.37±1.288.99±3.40-0.4440.6600.76±0.050.82±0.04-3.7770.001胼胝体压部7.90±7.927.91±2.83-0.0050.9960.70±0.060.75±0.02-3.939<0.001右侧内囊前支7.76±3.807.71±5.640.0310.9750.50±0.030.52±0.05-1.4550.155右侧内囊膝部7.54±2.487.24±2.120.3900.6990.55±0.060.56±0.07-0.4600.648右侧内囊后支7.48±3.027.59±3.46-0.1020.9200.71±0.050.72±0.03-0.3540.472扣带回前部7.58±4.458.06±2.26-0.4080.6860.34±0.050.44±0.05-6.000<0.001左侧海马8.51±4.348.77±2.24-0.2260.8230.09±0.020.12±0.05-2.3630.002右侧海马7.63±1.948.43±2.31-1.5330.1340.08±0.010.12±0.04-4.116<0.001右侧中央前回8.26±3.618.46±5.19-0.1340.8940.31±0.050.32±0.11-0.3510.728右侧中央后回8.20±7.648.16±4.320.0190.9850.30±0.010.31±0.02-1.8970.066左侧丘脑7.40±2.717.66±3.03-0.2710.7880.22±0.040.23±0.06-0.5880.560右侧丘脑8.29±2.908.40±5.64-0.0740.9420.26±0.020.27±0.04-0.9490.350
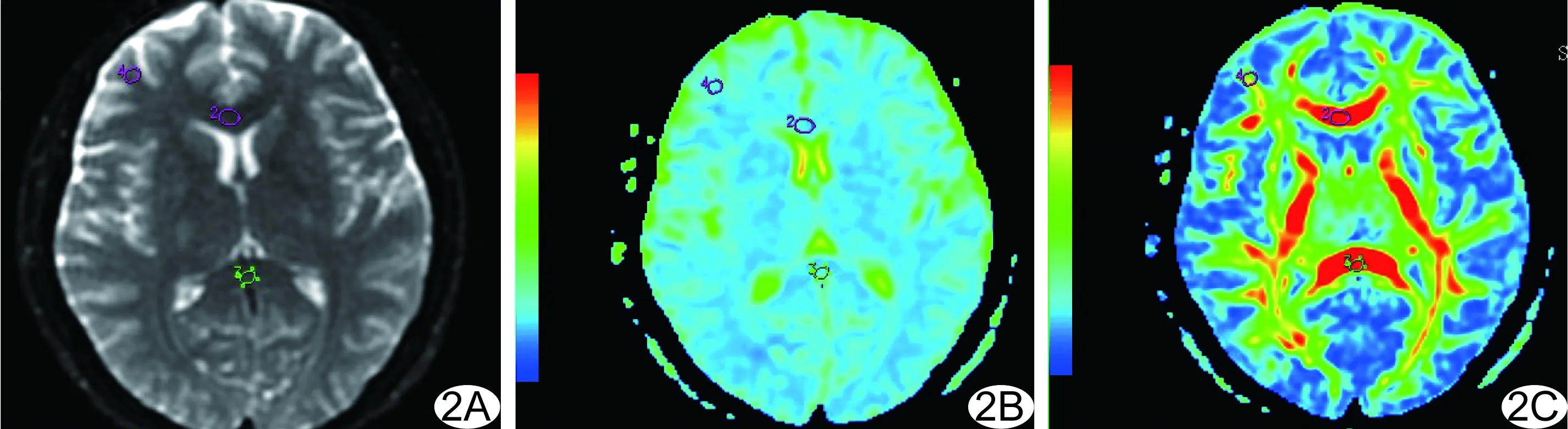
图2 患者女,33岁,TRD组 A.DTI图; B.ADC图; C.FA图

图3 志愿者男,34岁,对照组 A.DTI图; B.ADC图; C.FA图
TRD给患者家庭和社会带来巨大的经济负担。MRI技术的快速发展,使对TRD的神经病理学研究成为可能。目前临床主要以CT和MRI观察各种精神类疾病患者的脑结构。CT扫描时间短,多用于不能配合MR扫描的患者,如精神分裂症、躁狂症等。抑郁、失眠等疾病患者配合良好,可进行常规MRI及fMRI,以获得更加全面的脑结构和功能信息。
Shah等[3-4]发现TRD患者脑室扩大、灰质体积缩小。本研究中,对照组的侧脑室及第三脑室大小正常,均为A级;TRD组16例侧脑室及第三脑室为A级,仅2例患者脑室略扩张,为B级,其与TRD间的关系还需进一步研究。本研究TRD组和对照组常规MRI表现均未见异常,且2组间胼胝体各部厚度差异无统计学意义,提示常规MRI并不能发现TRD患者脑结构的细微改变。
1996年,Basser等[5]首次提出DTI技术。DTI可在活体内无创检测神经纤维的完整性和连通性,其原理是通过测量水分子的弥散运动来重建白质纤维束的轨迹,并可提供定量特征性参数,如ADC值和FA值,ADC值反映水分子的整体扩散水平。脑白质的髓鞘和纤维限制了水分子在垂直方向上的扩散,因而平行于髓鞘和纤维走向的水分子的扩散程度大于垂直方向,即水分子扩散存在各向异性。FA值用来评价脑白质内水分子扩散的各向异性改变,FA值大,表明纤维走向较为一致、紧密,髓鞘发育正常;FA值降低则提示纤维微细结构受损。作为脑的高级功能区之一,额叶主要参与情感、记忆、专注、自制力等高级精神活动。额中回和扣带回前部是默认模式网络(default-mode network, DMN)的重要组成部分[6],额中回的异常自主神经活动可导致自上而下调控的失能,这可能是抑郁症患者情感、行为、认知和内分泌改变的发病基础[7]。扣带回前部与情绪、心境、自我控制等有关[8]。认知控制网络(cognitive control network, CCN)包括前额叶皮层背外侧和前扣带回膝部,与注意的上下调节、情感反应的调节、工作记忆和认知控制功能有关;额下回对于认知功能非常重要,额下回三角部是反应控制的关键脑区,主要包括对刺激的辨别、冲突察觉及反应选择等。本研究中,TRD组额下回、额中回及扣带回前部FA值下降,提示TRD患者DMN和CCN存在微观结构异常或损伤。
胼胝体是连接两侧大脑半球的主要神经纤维束,与大脑各脑叶、透明隔和穹窿之间均有纤维联系,其纤维呈扇形向两侧半球投射,形成胼胝体辐射,在脑正中矢状面上由前向后分为嘴部、膝部、体部和压部;其功能与执行两侧大脑半球的协调功能有关,损伤后会引起两侧大脑半球失连接的症状,导致认知及情感障碍。Guo等[9]发现TRD患者胼胝体FA值降低。本研究于轴位胼胝体膝部和压部显示最佳层面上测量FA值,发现TRD患者胼胝体膝部和压部FA值下降,提示胼胝体白质完整性缺失可能与TRD的发病机制有关。
海马是边缘系统中最为重要的灰质核团,参与情感、记忆及情绪调节,与抑郁症的发生、发展有密切联系。邹可等[10]发现TRD患者右侧海马代谢增强,双侧海马NAA/Cr不对称性消失;赵亮等[11]对首发单相抑郁症患者的海马组织代谢及回流静脉进行分析,发现抑郁症患者双侧海马NAA/Cr和Cho/Cr显著降低,且侧脑室下静脉直径、长度及分支数目明显减少。上述研究均印证了海马异常在抑郁发生、发展中的关键作用。本研究发现TRD患者双侧海马的FA值均较对照组降低,提示海马微结构损伤可能参与TRD的发生、发展。Kochanski等[12]采用DTI识别深部脑刺激手术中的靶向部位丘脑髓纹,以研究TRD患者的病理生理机制,发现丘脑髓纹是外侧缰核的主要传入白质束,而外侧缰核则是与TRD的病理生理密切相关的丘脑核团。在今后的研究中,将DTI与临床非药物治疗手段(如深部脑刺激、迷走神经刺激和重复经颅磁刺激等)相结合,观察治疗效果,或有望解决TRD药物治疗抵抗的问题。
总之,DTI参数FA值可反映TRD患者多个脑区微结构的损伤,不同脑区微结构损伤的联合作用可能有助于解释TRD的发生机制。本研究为回顾性研究,忽略了TRD初始起病的生物学异常。TRD初始起病的生物学标记、不同脑区血流灌注的变化[13]将是今后进一步研究的方向。

