DNS-Cl对含氮药物的荧光标记方法及光学性质研究
成 昭,周 磊,苗延青,梁 飞
(西安医学院 药学院/药物化学研究所,陕西 西安 710021)
药物分子标记与示踪可实现药物代谢的可视化,对于药物浓度和药代动力学研究、药效评价具有重要意义。传统的同位素标记法需借助于放射显影技术实现药物分布部位(定性)和分布量(定量)实时研究,或借助采集血样、尿样等代谢样本,再进一步联用气相色谱-质谱进行分析,因而活体应用受限,更适用于血药浓度动力学、组织分布及排泄物分析等。借助光学定性与定量分析手段示踪药物分子、研究其分布与代谢,能够有效避免活体损伤、简化分析手段。将荧光衍生技术应用于药物分子的荧光标记、借助荧光成像即时示踪药物分子,直观可视地监测其分布、转运及利用的变化,可揭示药物作用路径、进行药理学分析,进一步评价药效,对研究药物作用的信号通路、进行疾病治疗具有重要意义。
本论文设计了以荧光衍生试剂特异性标记药物分子的某些原子或基团,以共价结合、弱作用力吸附等方法实现待分析物的可视化标记[1-2]。选择蛋白质N-端标记试剂丹磺酰氯(N,N-二甲氨基-5-萘磺酰氯,Dimethylamino Naphthalene Sulfonyl Chloride,DNS-Cl),经过以简单含氮物建立反应条件、复杂含氮物确立衍生条件、实现药物分子中非活性氨基标记的递进式实验方案,检出DNS-Cl特征荧光信号,进行药物分子的定性及定量考查;并进一步借助荧光成像技术示踪药物分子[3-4],为药物作用路径研究提供了一种直观可视的方法。分析药物代谢周期内标记物的光稳定性,并对标记产物进行光学性质分析与体外活细胞评价实验,探究标记物在体外活细胞实验中的作用效果。实验方案具有操作简便、取样量少、标记稳定性高等优势,且能够对分析物进行多参数考查,如荧光强度、量子产率、荧光寿命、标记光稳性能等,可应用于多种生物样品[5-9]和环境样品的分析。
1 实验部分
1.1 仪器与试剂
紫外可见分光光度计(UV-2102 PCS,广州沪瑞明仪器有限公司),荧光分光光度计(LS55,铂金埃尔默股份有限公司),倒置荧光显微镜(U-LH 100 hG IX73,成贯仪器有限公司),多功能酶联检测仪(1510 Mwltiskan Go,赛默飞世尔科技有限公司)。
丹磺酰氯(HPLC,阿拉丁试剂公司),邻苯二胺(AR,阿拉丁试剂公司),对苯二胺(AR,阿拉丁),邻氨基苯酚(AR,阿拉丁试剂公司),N-(1-萘基)乙二胺二盐酸盐(AR,阿拉丁试剂公司),阿莫西林胶囊(0.25 g,哈药集团制药总厂),硝苯地平缓释片(I)(10 mg,扬子江药业集团江苏制药股份有限公司),叶酸(400 μg,美国健安喜营养食品公司),克拉霉素分散片(0.25 g,广东怡康制药有限公司),奥美拉唑肠溶胶囊(20 mg,沈阳圣元药业有限公司)。
1.2 荧光衍生标记
DNS-Cl的衍生标记反应需在碱性条件下进行[10-11],本文将 DNS-Cl分别应用于硝苯地平、阿莫西林、叶酸、克拉霉素、奥美拉唑等含氮药物中非刚性氮原子的荧光标记(图1)。
1.2.1 简单含氮物 将1.0 mg DNS-Cl,3.4 mg邻苯二胺,25.0 mg碳酸钾及2.5 mL乙酸乙酯加入50 mL圆底烧瓶中,进行衍生标记,薄层板监测反应。分别考查了60℃及80℃的反应温度,确定衍生反应时间为20 min、反应温度为80℃。并进行80℃下的重复实验,反应重现性良好。
上述条件也适用于简单含氮物对苯二胺及邻氨基苯酚的荧光衍生反应。
1.2.2 复杂含氮物 将1.0 mg DNS-Cl,3.4 mg N-(1-萘基)-乙二胺二盐酸盐,25.0 mg碳酸钾,2.5 mL乙酸乙酯加入50 mL圆底烧瓶中,80℃下回流反应35 min,薄层板监测。
1.2.3 含氮药物 实验中所用含氮药物均为药店购入药品,应去除辅料干扰。药物辅料一般使用淀粉、糖粉等作为稀释剂或崩解剂,或可溶性枸橼酸作为pH调节辅料,利用其不溶于有机溶剂的特性,根据平均片重及每片有效含量计算药物分子含量、进行药物片剂或胶囊内剂的准确称重,使用有机溶剂进行充分溶解,再离心取上清液,即可去除干扰。
准确称取5.8mg阿莫西林,于离心管中加3 mL甲醇振荡溶解,6 000 r/min离心5 min取上清液,去除辅料干扰;将1.0 mg DNS-Cl,阿莫西林甲醇提取液,50.0 mg碳酸钾及5 mL乙酸乙酯加入50 mL圆底烧瓶中,80℃油浴加热回流2 h,薄层板监测反应。
同理,阿莫西林、叶酸、克拉霉素、奥美拉唑等含氮药物进行荧光衍生反应的试剂用量分别为143.9 mg硝苯地平,3.5 mL甲醇,4.0 mg DNS-Cl,100 mg碳酸钾及10 mL乙酸乙酯(80℃回流2 h);1.1 g叶酸,15 mL甲醇,1.0 mg DNS-Cl,25.0 g碳酸钾及2.5 mL乙酸乙酯(80℃回流1.1 h);34.6 mg克拉霉素,3 mL甲醇,2.0 mg DNS-Cl,25.0 mg碳酸钾及5 mL乙酸乙酯(80℃回流2.5 h);67.1 mg奥美拉唑,3.0 mL甲醇,1.0 mg DNS-Cl,25.0 mg碳酸钾,5 mL乙酸乙酯(80℃回流1.6 h)。
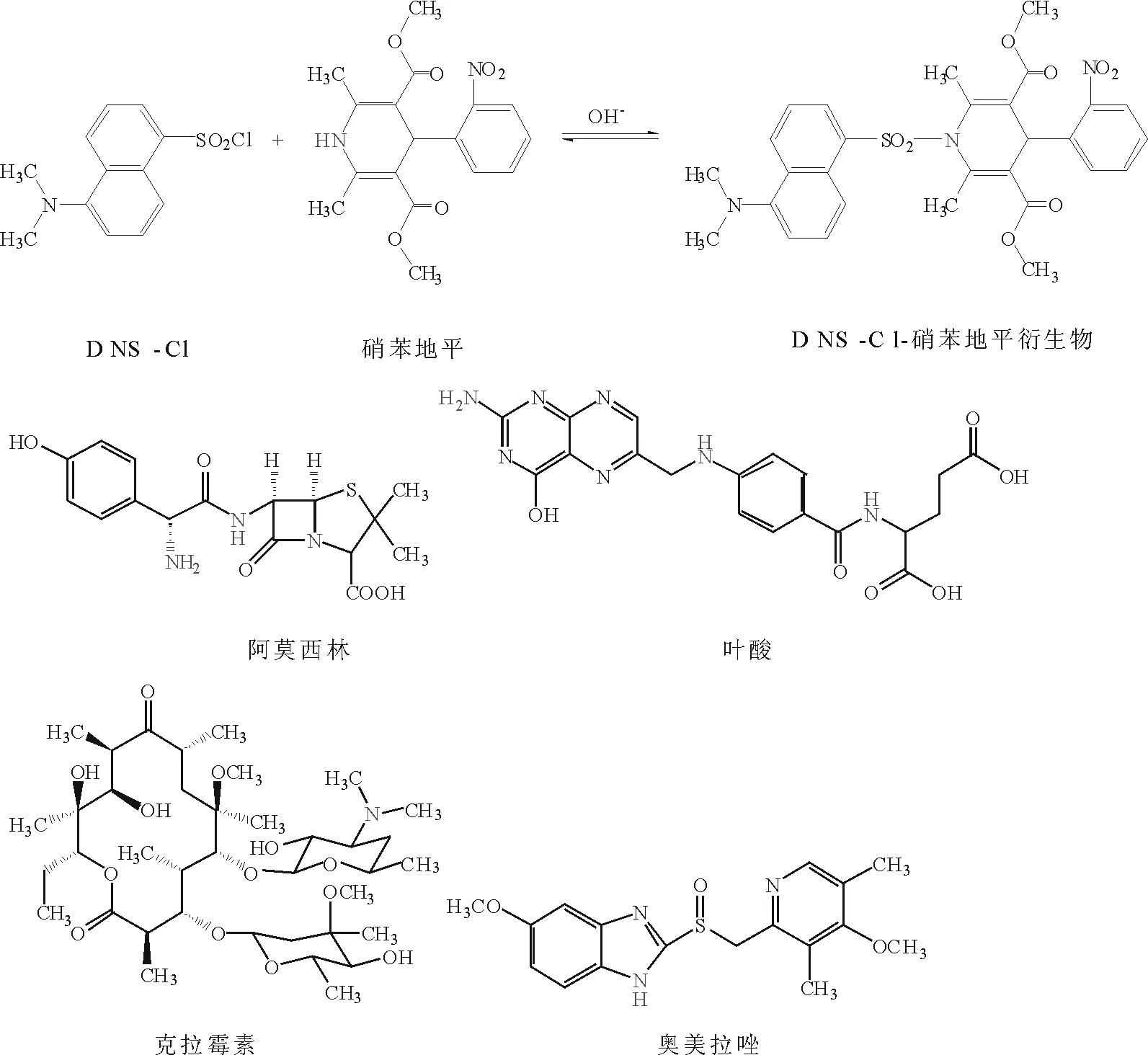
图1 荧光衍生路线Fig.1 Fluorescence derivatization route
1.3 荧光衍生标记稳定性分析
保持DNS-Cl-阿莫西林衍生物反应液恒温37℃下,分别在0,2,20,24,31,44,48,52 h取样,蒸馏水定容,得到浓度为1×10-4mol/L的溶液,分析DNS-Cl荧光最大发射波长462 nm处荧光强度随时间的稳定性。评价阿莫西林体内半衰期及药物完全代谢排出体外之前,DNS-Cl能否有效标记药物分子,实现药物代谢周期内直观可视的代谢路径示踪。
另对DNS-Cl-硝苯地平(0,3,5,17,25,42,48,49,77 h),DNS-Cl-叶酸(0,3,6,18,21,24,28,51,67 h),DNS-Cl-克拉霉素(0,3,7,21,46,49,52,55,69 h)及DNS-Cl-奥美拉唑(0,7,21,25,29,45,57,69 h)等荧光衍生产物进行了相似间隔取样分析。
1.4 细胞评价实验
1.4.1 细胞毒性评价 采用MTT法[8]对DNS-Cl-硝苯地平、DNS-Cl-克拉霉素衍生产物进行体外细胞毒性评价。取对数生长期的受试细胞(ECV304人脐静脉内皮细胞株)制备细胞悬液,密度约为5×104个/mL,加入96孔板中,每孔细胞数8 000~10 000个。待细胞贴壁后,各样品按起始浓度倍数稀释加入各自组中,每组为2个平行孔,设定体积分数0.1% DMSO为溶剂对照。加药后置于37℃,体积分数5% CO2的细胞培养箱中培养24 h。实验终止前4 h每孔加入100 μL浓度为5 mg/mL的MTT溶液,再培养4 h。测定前,彻底弃去培养液,每孔加入150 μL DMSO,使用酶标仪在490 nm处测定OD值,利用下式计算细胞增殖抑制率,抑制率%=[(1-OD药液/OD对照)×100%][9]。
1.4.2 细胞荧光标记 取对数生长期的受试细胞(ECV304人脐静脉内皮细胞株)制备细胞悬液,密度约为5×104个/mL,加入6孔板中,每孔细胞数8 000~10 000个,待细胞贴壁后,各样品按起始浓度倍数稀释(5 000,10 000,20 000 μmol/L)加入各孔中,加药后置于37℃,体积分数5% CO2的细胞培养箱中培养30 min后用PBS buffer清洗3次,用倒置荧光显微镜观察,可看到蓝色荧光发射通道内细胞有绿色荧光表达。在明场中拍摄聚集生长且形态完整良好的细胞,并在暗场中拍摄荧光成像。
2 结果与讨论
2.1 荧光衍生标记及稳定性分析
配制浓度为1×10-5mol/L 的DNS-Cl-邻苯二胺衍生产物水溶液,以314 nm波长激发,得到荧光光谱(图2(a))。结果显示,60℃及80℃的反应温度考查、及80℃下的重复实验,衍生产物荧光强度稳定、重现性良好。相同条件下进行了DNS-Cl与对苯二胺、邻氨基苯酚的荧光衍生,实验结果同邻苯二胺。
80℃下,DNS-Cl-N-(1-萘基)-乙二胺二盐酸盐荧光衍生反应重现性良好(图2(b)),进一步验证了荧光衍生条件。
进行1×10-4mol/L浓度DNS-Cl-硝苯地平衍生物荧光光谱分析(图2(c)),可知DNS-Cl可标记硝苯地平分子中含氮杂环上的仲胺基。同理,DNS-Cl可有效标记阿莫西林分子中的伯胺基、仲胺基,叶酸伯、仲、叔胺基,克拉霉素叔胺基,奥美拉唑伯胺基、仲胺基。
间隔取样法分析37℃恒温下DNS-Cl对阿莫西林衍生标记的稳定性,以DNS-Cl荧光最大发射波长462 nm处的荧光强度对时间作图,得到光稳定曲线图3(a)。各时间点荧光强度波动较小,说明在阿莫西林体内半衰期61.3 min时间范围内,及其完全代谢排出体外之前,DNS-Cl均能有效标记药物分子,实现其代谢周期内直观可视的代谢路径示踪。
同理,硝苯地平体内有效作用时间持续12 h,叶酸体内半衰期约为40 min,克拉霉素缓释片半衰期约为7 h,完全代谢时间需5 d,奥美拉唑体内半衰期为0.5 h~1 h,有效血药浓度可维持24 h。上述药物代谢周期内,丹磺酰氯均能实现药物分子的有效标记及全程示踪(图3(b)~(e))。
2.2 细胞评价实验
2.2.1 细胞毒性评价 计算DNS-Cl-硝苯地平及DNS-Cl-克拉霉素衍生产物对体外人脐静脉内皮细胞株ECV304增殖抑制率,得到表1及表2。
得到IC50回归方程[12]为
Y=2.746 438 66+0.575 664×X(Y表示概率单位,X表示lgc),Y=5即抑制率为50%时, 反应物浓度c=8 217 μmol/L,则IC50=8 217 μmol/L。
表2得到的IC50回归方程为Y=2.633 155+0.544 912×X(Y表示概率单位,X表示lgc),Y=5,即抑制率为50%时,反应物浓度c=22 056 μmol/L,则IC50=22 056 μmol/L。
由表1,2可知,硝苯地平、克拉霉素荧光标记物在体外活细胞环境中毒性低,可用于活体研究中,在生物学、医学研究中具有良好的应用前景。
2.2.2 细胞荧光标记 分别进行DNS-Cl-硝苯地平、DNS-Cl-克拉霉素衍生产物与人脐静脉内皮细胞株ECV304体外共孵育,低、中、高浓度梯度加样,荧光共聚焦显微镜下拍摄成像,得到图4,5。
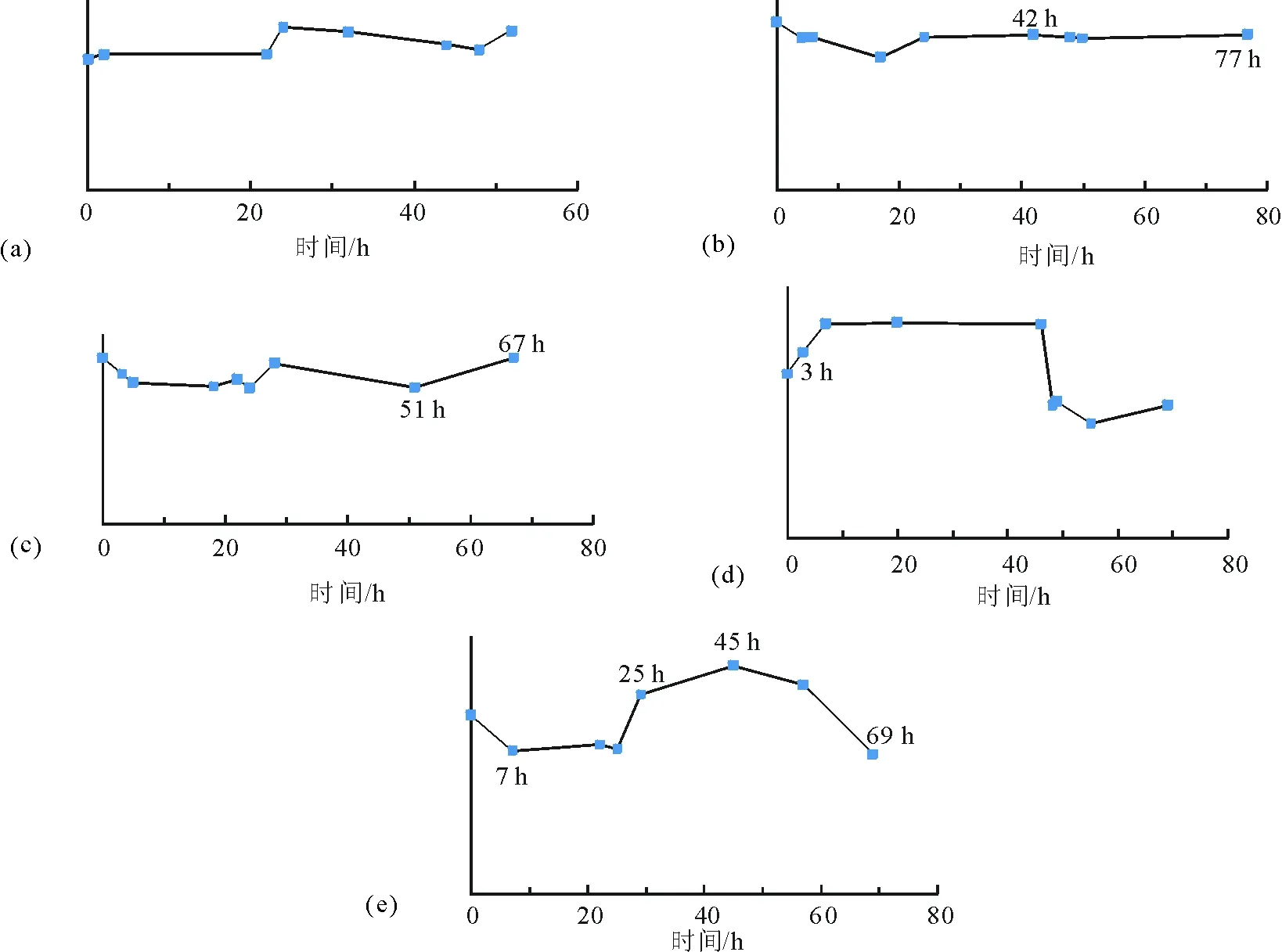
图3 荧光衍生产物光稳定性(a) 丹磺酰氯-阿莫西林 (b) 丹磺酰氯-硝苯地平 (c) 丹磺酰氯-叶酸 (d) 丹磺酰氯-克拉霉素 (e) 丹磺酰氯-奥美拉唑(462 nm)Fig.3 Fluorescence Stability of (a) DNS-Cl-Amoxicillin, (b) DNS-Cl-Nifedipine, (c) DNS-Cl-Folic Acid, (d) DNS-Cl-Clarithromycinand (e) DNS-Cl-Omeprazole at 462 nm
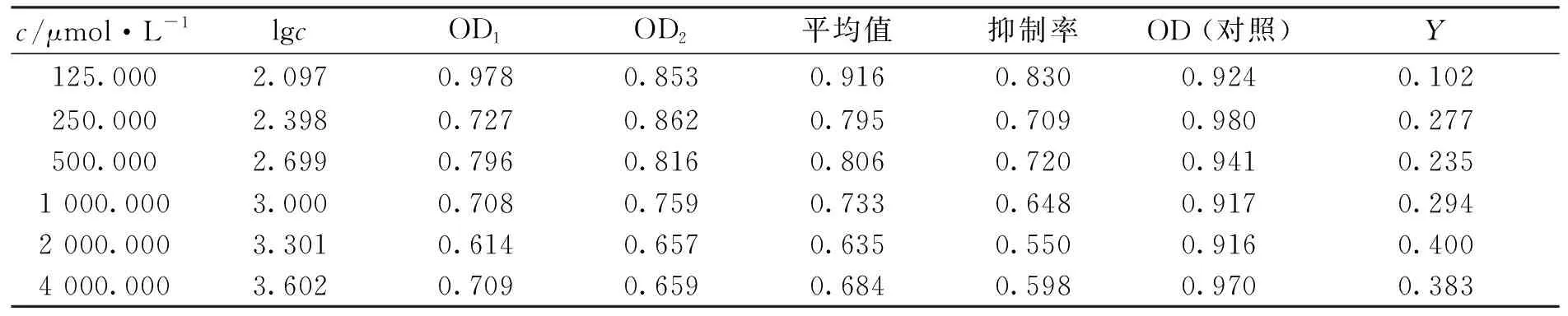
c/μmol·L-1lgcOD1OD2平均值抑制率OD (对照)Y125.0002.0970.9780.8530.9160.8300.9240.102 250.0002.3980.7270.8620.7950.7090.9800.277 500.0002.6990.7960.8160.8060.7200.9410.235 1 000.0003.0000.7080.7590.7330.6480.9170.294 2 000.0003.3010.6140.6570.6350.5500.9160.400 4 000.0003.6020.7090.6590.6840.5980.9700.383
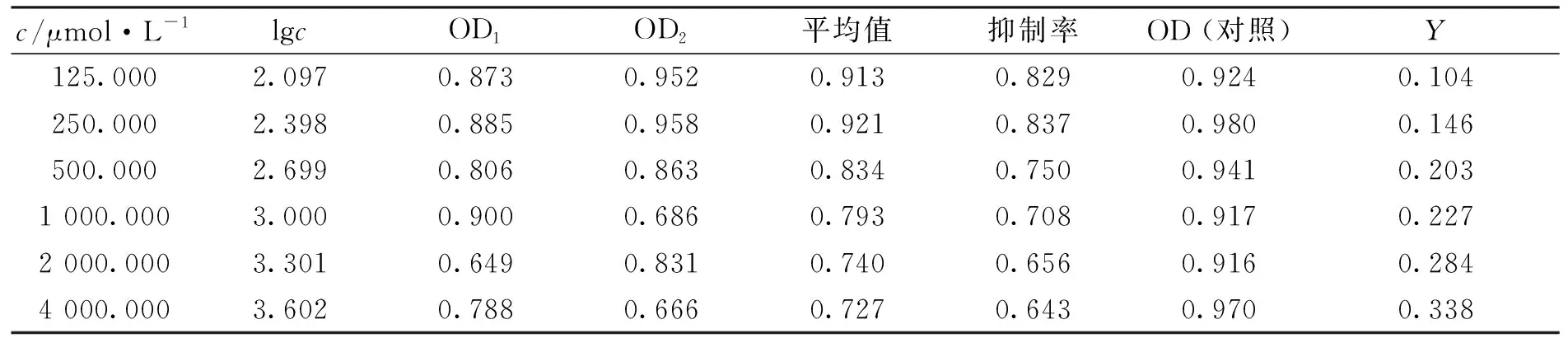
表2 DNS-Cl-克拉霉素衍生产物MTT数据Tab.2 MTT Experimental Data of DNS-Cl-Clarithromycin

图4 丹磺酰氯-硝苯地平荧光衍生产物活细胞成像Fig.4 Living cells imaging of DNS-Cl-Nifedipine
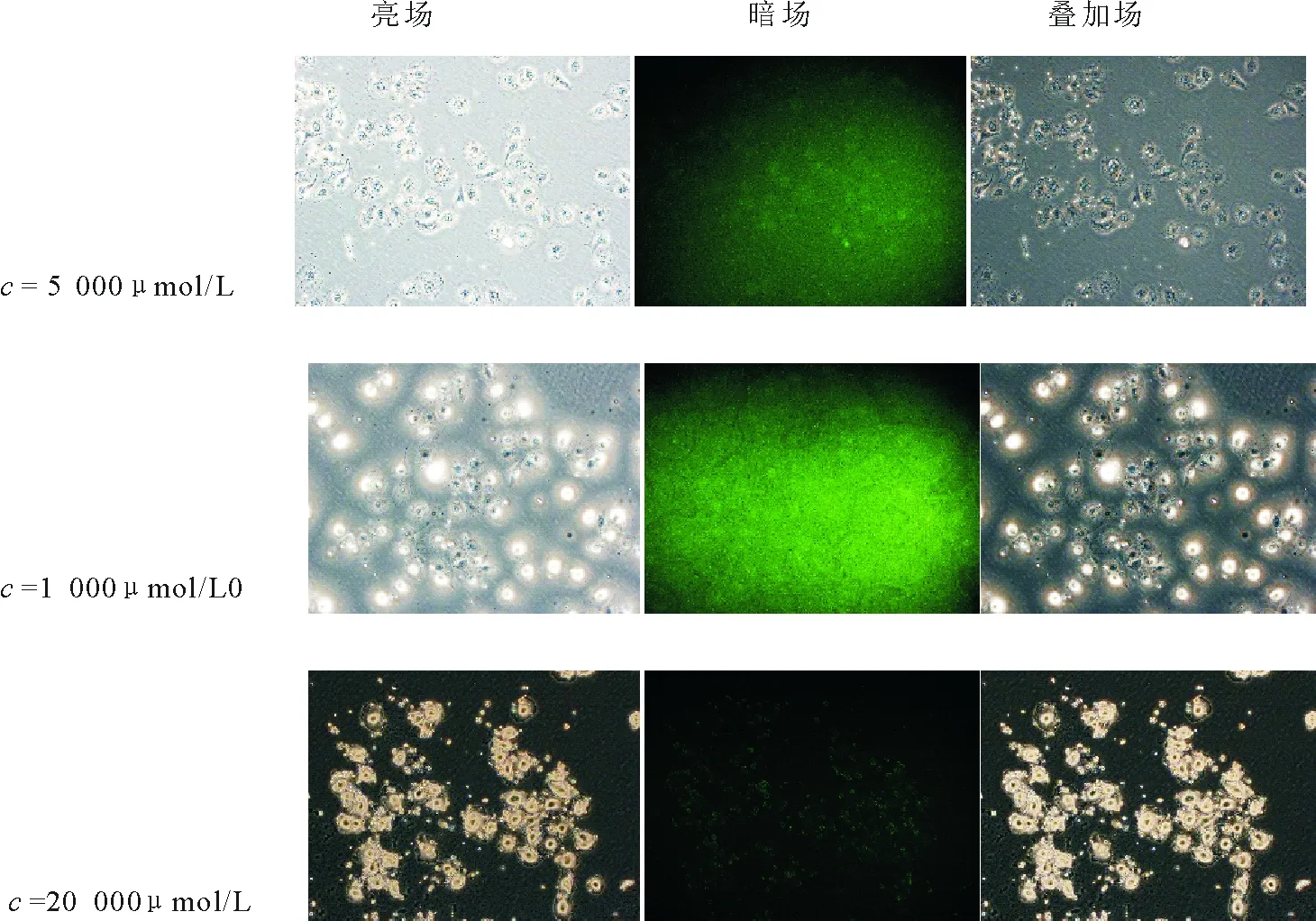
图5 丹磺酰氯-克拉霉素荧光衍生产物活细胞成像Fig.5 Living cells imaging of DNS-Cl-Clarithromycin
由图4,5可看出,明场下细胞形态完整,暗场下荧光衍生产物进入细胞,且荧光成像良好,可用于药物在体内代谢路径示踪,通过荧光成像技术,为药物分子的代谢路径研究提供了直观可视、安全有效的实验方法。
3 结 论
设计了递进式、多层次的实验方案,经过简单含氮化合物、复杂含氮化合物、含氮药物分别与DNS-Cl进行衍生反应的实验设计,建立了一种普遍适用的对含氨基药物荧光标记的方法。进行丹磺酰氯与含氮药物或化合物的衍生反应时,不需要添加催化剂,反应条件温和,反应时间短、适用性广、操作简便快速。通过光稳定性实验及细胞评价实验评价DNS-Cl对含氮化合物及药物分子荧光标记的稳定性[10-11]及低毒性[8-9,12-15],DNS-Cl不仅可以实现药物分子半衰期内或代谢期内的荧光稳定标记,而且可以实现细胞水平、分子水平的药物作用代谢示踪等,荧光标记产物在体外活细胞环境中安全有效,反应检测直观可视,具有较好应用前景。未来工作将进一步联用色谱技术,表征药物作用效果、研究药物作用机制、进行药物筛选等。

