胃神经鞘瘤的MSCT表现
卢东霞,李文华,张凤翔
(内蒙古鄂尔多斯市中心医院影像科,内蒙古 鄂尔多斯 017000)
胃神经鞘瘤(gastrointestinal schwannomas,GS)起源于平滑肌间Auerbach神经丛的神经鞘Schwan细胞,非常少见,占消化道间叶性肿瘤的1%~2%[1]。由于其和胃间质瘤均起源于间叶组织,且临床症状、影像表现相似,临床工作中常被误诊为胃间质瘤,但两者的治疗方式不同,因此术前诊断尤为重要。笔者收集我院2012年3月至2016年5月收治的8例经手术病理证实的GS患者,分析其临床及MSCT表现,旨在提高对该病的认识,为临床诊断及治疗提供帮助。
1 资料与方法
1.1 一般资料 8例中,男1例,女7例;年龄32~60岁,平均52岁,其中6例(75.0%)发病年龄在40岁以上。临床症状:7例腹部疼痛,其中4例伴恶心呕吐,2例伴左背部放射痛,1例伴食欲不振;1例单纯腹胀,进食后加重。
1.2 仪器与方法 所有患者均行MSCT平扫+增强扫描。采用GE Discovery HD75064排螺旋CT机。扫描参数:120 kV,400~500 mAs,矩阵 512×512,层厚5 mm,层距 1 mm。检查前禁食8~10 h,口服500~1000 mL水以充盈胃和小肠,对比剂采用非离子型对比剂碘海醇(300 mgI/mL),剂量1.5 mL/kg体质量,注射流率2.5~3 mL/s,分别于注射对比剂后25~30、60~70 s行动脉期、门静脉期扫描。
1.3 图像分析 由2名工作超过6年的高年资放射科医师在PACS对图像进行观察分析,肿瘤评估内容包括:①大小(以肿瘤最大径为标准);②部位(胃大弯、胃小弯、胃窦、胃底);③形状、内部结构(均匀、出血、坏死、钙化)、生长方式(腔内生长、腔外生长、腔内外生长)、强化模式(强化均匀、强化欠均匀)及程度(欠佳、中等、明显);④对邻近结构的侵犯及有无淋巴结转移。
2 结果
2.1 肿瘤部位、大小 8例均为单发,胃体大弯侧5例,小弯侧2例,胃窦部1例。肿瘤直径1.5~6.5 cm,1例位于黏膜表面,2例位于胃壁肌层,1例位于黏膜下,4例累及固有肌层。均无神经纤维瘤病史。
2.2 MSCT表现 8例中,7例表现为圆形或类圆形肿块,其中1例边缘可见小凹陷;另1例肿块较大,边缘可见浅分叶。3例向腔内生长,2例向腔外生长,3例腔内外生长。平扫CT值 30~60 HU,增强扫描:1例在动脉期明显均匀强化(图1);2例肿块内部发现小片状低密度区,增强扫描强化不均匀(图2);5例均呈均质密度,动脉期轻度强化,静脉期轻中度强化。1例伴胃周淋巴结肿大(图3),病理证实肿大淋巴结为反应性增生,并非转移。所有患者均未发现钙化灶、出血、邻近结构侵犯及腹水等情况。
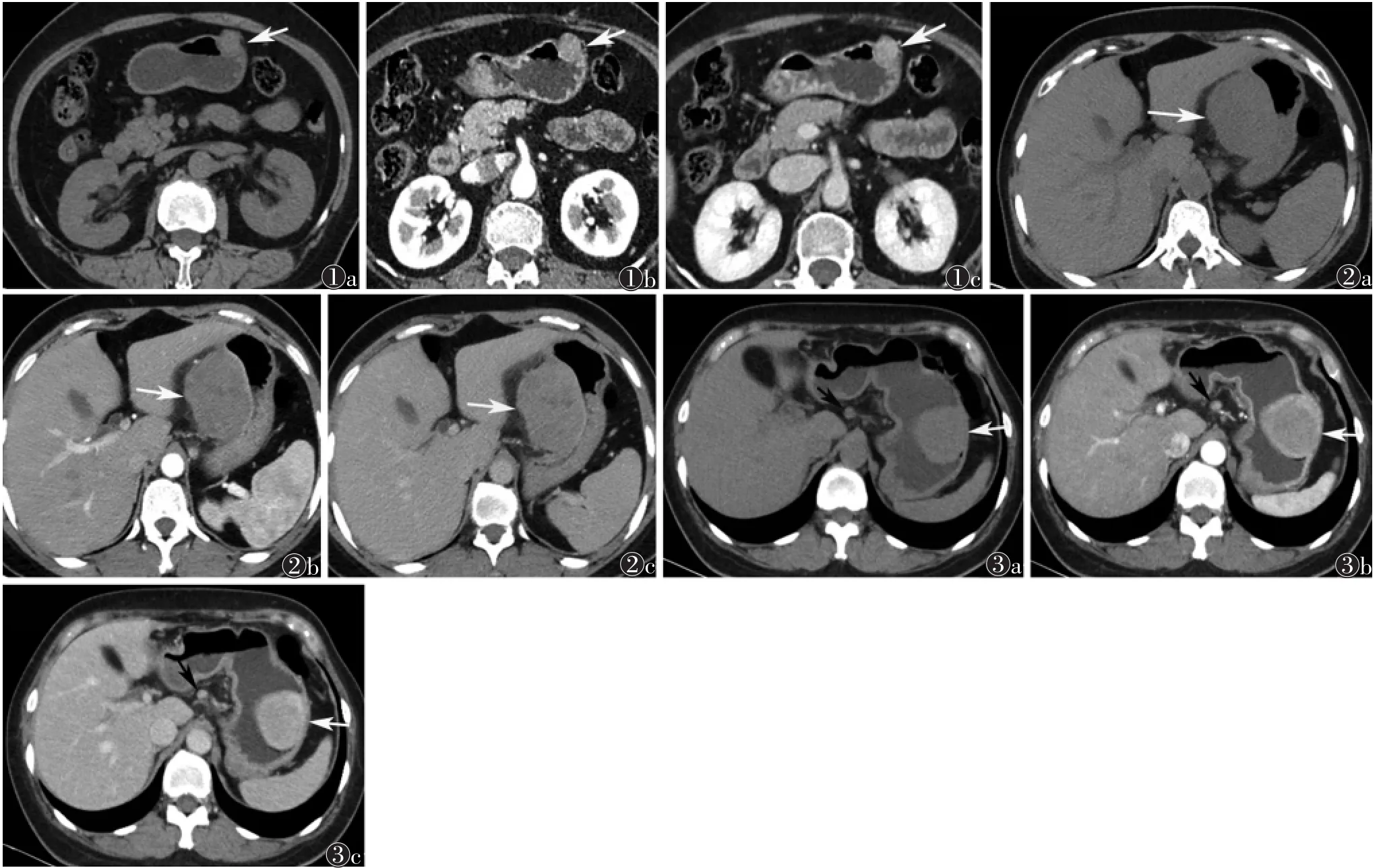
图1 女,40岁 图1a CT平扫示胃大弯侧类圆形软组织密度结节影,病灶密度均匀,边界清晰(箭头)图1b 增强扫描动脉期明显强化(箭头) 图1c 静脉期强化程度较动脉期变化不大(箭头) 图2 男,51岁 图2a CT平扫示胃小弯侧类圆形软组织密度肿块影,腔外生长,胃壁侧可见局限性小凹陷,瘤体密度欠均,边界尚清(箭头) 图2b 增强扫描动脉期轻度强化,其内见小片状低密度区(箭头) 图2c 静脉期强化仍可见小片状低密度区(箭头) 图3 女,48岁 图3a CT平扫示胃大弯侧类圆形软组织密度肿块影,腔内生长,密度尚均匀,边界清晰(白箭) 图3b 增强扫描动脉期不均匀轻度强化(白箭)图3c 静脉期瘤体强化更明显(白箭);腹膜后肿大淋巴结,强化均匀(黑箭)
3 讨论
3.1 临床与MSCT表现 GS是一种极为少见的起源于胃肠道肌间Auerbach神经丛的神经鞘Schwan细胞的良性神经源性肿瘤,最早由Daimaru等于1988年报道[2]。可发生于身体任何部位[3-4],好发于胃体,其次为胃底和胃窦[5],好发于40岁以上,以50~60岁女性多见[6]。 本组 7例(87.5%)发生于胃体部,6例(75.0%)年龄在40岁以上,与文献报道相符。GS最常见的临床表现是反复消化道出血,其次为肠梗阻[7]。 但大部分报道[8-10]多为反酸、饱胀、腹痛、腹部不适,部分患者可出现呕血、黑便等症状。本组7例腹部疼痛,其中4例伴恶心呕吐,1例伴食欲不振;另1例为单纯腹胀。因此,笔者更支持腹痛为最常见症状。MSCT表现可反映肿瘤的组织学特征[11],结合相关文献及本研究,笔者总结以下几点:①肿瘤多呈圆形或类圆形,体积较小,直径一般不超过5 cm,肿瘤密度较均匀,少见坏死、出血及囊变,边缘光滑,分叶少见。Agaimy等[12]研究认为,GS不会出现退行性改变坏死、囊变、出血及钙化等现象,认为这是GS的一个特点。但也有文献[13]表明,GS可合并出血、坏死及囊变。本组1例可见浅分叶,2例密度欠均匀,中心可见小片状低密度区,可能是瘤体较大,生长过程中供血不均匀,从而导致各方向瘤细胞生长速度不同,中心出现坏死而致,其中1例,病理活检可见坏死区域。②肿瘤平扫表现为软组织密度,CT值30~60 HU,增强扫描多为轻中度强化,这可能与肿瘤内部含Antoni A型细胞较多有关。本组仅1例表现为动脉期明显强化,其余均为静脉期强化较动脉期明显。Levy等[10]研究中,2例GS门脉期无或轻度强化,而平衡期肿瘤明显均匀强化,认为胃间质瘤增强扫描的强化峰值很可能出现在平衡期。③本组1例肿瘤边缘可见小凹陷,超声内镜可见肿瘤表面小溃疡形成,与MSCT表现一致,也与潘卫星等[6]的研究相符。④据多数文献[13-16]报道,神经鞘瘤良性居多,恶性罕见,Qayyum[14]发现,神经鞘瘤在 DWI上呈高信号,ADC值1.47×10-3mm2/s,表明神经鞘瘤存在恶性的潜能。本组1例胃周可见肿大淋巴结,术后证实为反应性增生,而非恶性肿瘤的转移性淋巴结,与He等[13]的研究结果一致。关于淋巴结肿大的原因,有学者[15]认为是炎性反应性肿大,而 Hou 等[16]认为是肿瘤细胞释放细胞毒素,刺激淋巴结致其增生。
3.2 鉴别诊断 GS术前诊断困难,本组5例术前MSCT误诊为胃间质瘤,3例正确诊断,原因是GS与胃间质瘤均为胃肠道间叶组织肿瘤,临床及影像表现均有很多相似之处。笔者结合文献总结两者的鉴别诊断如下:①临床症状方面,胃间质瘤常见于老年男性,40岁以前少见,男女性别无差别。临床上起病隐匿,患者多以腹痛、便血、呕血、腹部肿块就诊,由于肿块沿胃壁的垂直方向生长,具有瘤体大但附着点局限的生长特点,很少沿胃壁浸润蔓延,因此很少出现消化道梗阻的表现。而GS主要发生于40岁以上的女性,临床症状主要表现为腹痛、反复消化道出血,其次为肠梗阻,部分患者可无症状,仅在体检或影像检查中偶然发现。②影像表现方面,胃间质瘤瘤体通常较GS大,且绝大多数为富血供肿瘤,倾向于外生性生长,多表现为分叶状或不规则形,增强扫描呈中度或明显强化,若强化不均匀,则提示肿瘤中心出血、坏死、囊变,这通常是恶性间质瘤的MSCT征象[17-19]。而GS通常是良性,肿瘤瘤体较小,质均,强化程度轻且较均匀,出血及囊变少见,周围可见反应性肿大淋巴结,但这些表现与低度恶性的胃间质瘤较难区分,鉴别仍需病理及免疫组化来确诊[20]。③病理及免疫组化,胃间质瘤光镜下肿瘤细胞呈梭形或上皮样多边形,但其免疫组织化学中c-KIT原癌基因(c-kit protocol-oncogene CD117)、CD34 阳性,神经源性标志物中S-100蛋白、神经特异性烯醇化酶(NSE)、神经纤维细丝蛋白(NF)、胶质纤维酸性蛋白(glial fibrillary acid potein,GFAP)等表达阴性。 而GS镜下肿瘤由梭形细胞构成,呈束状、编织状排列,周边可见“淋巴袖套征”,有时生发中心和梭形细胞瘤微梁网架模式并存,免疫组化:GS为S-100表达阳性,CD117、CD34、c-KIT 表达阴性。 S-100(+)为施万细胞标志物,其阳性可作为病理鉴别诊断的依据。另一个需要鉴别的是肿块型胃癌,该病病程较短,患者短期内体质量减轻明显,MSCT上肿块形态多不规则,肿块多向腔内生长,肿瘤密度不均,液化坏死较常见,增强扫描明显不均匀强化,肿块与周边器官常分界不清、周围淋巴结转移性肿大,远处器官可见转移或腹水。而GS通常为良性,病程较长,即使恶性病变者也很少出现转移征象[6]。
综上所述,GS是一种起源于施万细胞的罕见肿瘤,由于缺乏特异的临床及影像学特征,常规影像学检查较难与胃间质瘤鉴别,但部分患者的MSCT表现能够起到提示性诊断的作用。MSCT虽能清晰显示GS肿瘤与邻近结构关系,明确肿瘤位置、初步判断良恶性及术前评估、术后随访,但确诊仍依靠术后病理学检查。

