UPLC法测定不同加工方式鹿茸中的生物胺成分
王燕华,孙印石*,王玉方,陈 宝,霍晓慧,刘 畅,张 磊
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林农业大学 中药材学院,吉林 长春 130118)
鹿茸是鹿科动物梅花鹿CervusnipportTemminck或马鹿CervuselaphusLinnaeus的雄鹿未骨化密生茸毛的幼角,前者习称“花鹿茸”,后者习称“马鹿茸”。夏、秋二季锯取鹿茸,经加工后,阴干或烘干[1-2]即得。鹿茸的加工可分为排血加工和带血加工,按照干燥方式又可分为沸水煮炸和冷冻干燥。根据组织结构特征,整枝鹿茸由尖部至基部可分为蜡片、粉片、纱片、骨片4个部位。生物胺是一类具有生物活性、含氨基的低分子量化合物,主要由微生物氨基酸脱羧酶作用于氨基酸脱羧或经胺化醛和酮的转氨基作用而生成[3-4]。生物胺广泛存在于鱼及其制品、发酵食品及饮料中[4-6],是合成激素、碱基、核苷酸、蛋白质等的前体物质,适量摄入生物胺可促进生长、加速代谢、增强免疫力、清除自由基等,但摄入过量则会引起头疼、腹部痉挛、呕吐等不良生理反应[5-11]。富含蛋白质的水产品、肉类及其制品中生物胺的含量与其品质密切相关,对产品的感官特性也有一定影响[6],生物胺有望成为评价此类食品新鲜程度的一个指标[11-13]。李可强等[14]对不同加工方式的马鹿茸中腐胺的含量进行了对比分析,发现传统煮炸茸中腐胺的含量高于冻干茸,排血加工的腐胺含量高于带血加工,蜡片中含量最高,但未见有关不同加工方式或不同部位花鹿茸中生物胺含量差异的文献报道。本研究采用超高效液相色谱法(UPLC)同时检测鹿茸中的10种生物胺组分,并对不同加工方式及不同部位的花鹿茸中生物胺的含量进行对比分析,旨在为鹿茸的加工及质量控制提供科学依据。
1 实验部分
1.1 仪器与试药
ACQUITY UPLC H-Class超高效液相色谱仪(美国Waters公司);EX125DZH电子天平(奥豪斯仪器有限公司);MS204S电子分析天平(瑞士Mettler Toledo公司);Milli-Q Advantage A10超纯水器(美国Millipore公司);XW-80A微型旋涡混合仪(上海沪西分析仪器厂有限公司);JP-100ST超声清洗机(广州市洁盟超声波清洗设备有限公司);QYC-2102C恒温培养摇床(上海福玛实验设备有限公司);TGL-16G高速台式离心机(上海安亭科学仪器厂)。
盐酸、无水碳酸钠、丙酮、氨水(分析纯,北京化工厂);乙腈(色谱纯,美国Fisher公司);丹磺酰氯(上海源叶生物科技有限公司);高氯酸(分析纯,成都金山化学试剂有限公司)。
对照品购自上海源叶生物科技有限公司。色胺(批号即LOT为:KM0522YB14),2-苯乙胺(LOT:T28M6C1),腐胺(LOT:L05D6S7162),尸胺二盐酸盐(LOT:P1069349),组胺(LOT:Y22F8J29786),5-羟色胺盐酸盐(LOT:BO1022DA14),酪胺盐酸(LOT:XJ0704XA14),亚精胺(LOT:A29M7L12090),多巴胺盐酸盐(LOT:S05J6G2),精胺(LOT:B10D7L26660)。
对照品溶液的配制:准确称取色胺、腐胺、尸胺二盐酸盐、组胺、5-羟色胺盐酸盐、酪胺盐酸、亚精胺、多巴胺盐酸盐、精胺各5 mg,移取2-苯乙胺100 μL,置于10 mL容量瓶中,以0.1 mol/L盐酸溶解并定容,配制成单标储备液。准确量取各单标溶液2 mL于25 mL容量瓶中,用0.1 mol/L盐酸定容,配制成混合标准液母液。
1.2 实验材料
鲜鹿茸购自吉林省双阳区鹿乡镇,经中国农业科学院特产研究所李春义研究员鉴定,为梅花鹿(CervusnipportTemminck)的茸角(二杠)。参考文献方法[15],随机取3副鲜鹿茸进行煮炸与冻干的对比加工,加工完成的鹿茸分别称为“煮炸茸”(CCP with boiling process,Boil)和“冻干茸”(CCP with freeze-drying technology,Freeze);取3副鲜鹿茸进行排血与带血的对比加工,加工完成的鹿茸分别称为“排血茸”(blood-drained CCP,Drain)和“带血茸”(blood-filled CCP,Fill)。每种加工方式的鹿茸按蜡片(Wax slice)、粉片(Powder slice)、纱片(Gauze slice)、骨片(Bone slice)、整枝(Entire)分为5个样品。
1.3 样品处理
1.3.1鹿茸样品生物胺试液的制备参考文献方法[16],准确称取鹿茸样品粉末0.20 g,置于4 mL离心管中,加入0.4 mol/L高氯酸2.0 mL,静置过夜,超声10 min,10 000 r/min离心10 min。
1.3.2生物胺的衍生化参考文献方法[16],准确吸取鹿茸生物胺提取液0.5 mL于4 mL离心管中,加0.9 mL饱和碳酸钠溶液、0.5 mL丹磺酰氯溶液(10 g丹磺酰氯/L丙酮),涡旋混匀,置于控温摇床,40 ℃避光振摇1 h。振摇结束后,加100 μL氨水终止反应,用1.0 mL乙腈萃取目标物,6 000 r/min离心5 min,上层液过0.22 μm滤膜,上机备用。
1.4 色谱条件
色谱柱:ACQUITY UPLC@BEH C18(2.1 mm×100 mm,1.7 μm)。流动相:乙腈(A)-水(B)。洗脱程序:0~5 min,55%~95% A;5~6 min,95% A;6~7 min,95%~55%A;7~9 min,55%A。柱温35 ℃,流速0.4 mL/min,进样量3 μL,检测波长217 nm。
2 结果与讨论
2.1 色谱条件的优化
2.1.1流动相的选择生物胺属于有机碱,部分组分呈现一定的碱性,进行色谱分析时可能会出现拖尾。乙酸铵溶液与甲醇、乙腈等常见流动相混溶,具有较强的缓冲能力,常被用作改良剂添加到分析不同pH值化合物的流动相中,以减少次级保留,改善峰形,提高积分准确度。但高浓度乙腈洗脱易导致乙酸铵出现盐析现象,造成铵盐残留在色谱柱中。进一步考察了未添加乙酸铵的乙腈-水作为流动相时的效果,结果显示,10种生物胺组分能基线分离,拖尾现象不明显。原因可能是通过衍生化反应,生物胺转化为酰胺类成分,碱性变弱甚至消失,且反应副产物及过量的衍生试剂不干扰目标物的分离。因此,本实验选择未添加乙酸铵的乙腈-水作为流动相。

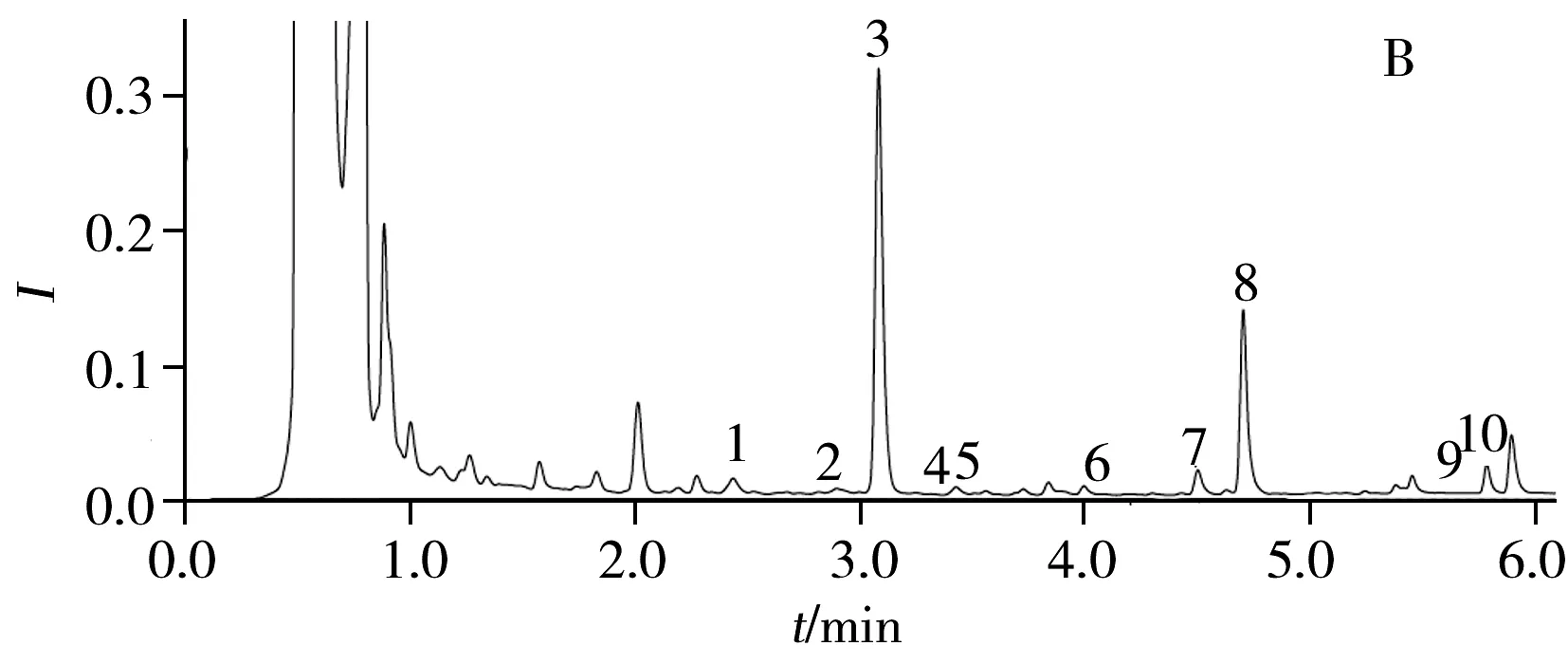
图1 生物胺对照品(A)与鹿茸样品(B)的色谱图Fig.1 UPLC chromatograms of biogenic amine standard reference substances(A) and CCP sample(B)1.Try;2.2-Phe;3.Put;4.Cad;5.His;6.5-HT;7.Tyr;8.Spd;9.Dop;10.Spm
2.1.2洗脱程序的确定实验尝试采用50%、55%、60%乙腈作为初始洗脱梯度,结果表明,以50%乙腈作为初始条件时出峰杂乱,不能将10种生物胺成分分开;55%乙腈初始洗脱时,10种生物胺组分可基线分离,且无明显拖尾;60%乙腈作为初始梯度时,虽然整体保留时间提前,10种组分全部洗脱出峰,且峰宽均匀一致,但尸胺与组胺的分离效果不佳。因此,最终采用55%乙腈作为初始洗脱梯度。
2.1.3检测波长的选择10种生物胺衍生物的最大吸收波长为215.6~218.0 nm,选择217 nm作为检测波长,可使10种生物胺组分的峰高达到最大,易于观察和分析生物胺对照品谱图及鹿茸样品的色谱图(见图1)。
2.2 方法学考察
2.2.1线性范围与检出限混合标准母液中10种生物胺的质量浓度分别为25.00、38.49、22.24、35.80、23.88、30.16、21.64、16.00、31.28、23.56 mg/L。分别准确吸取20 mg/L生物胺混合标准溶液母液0.1、0.2、0.5、1.0、1.5、2.0 mL,置于5 mL容量瓶中,用0.1 mol/L盐酸稀释定容,按“1.3.2”方法进行衍生化并上机测定。以10种生物胺的质量浓度为横坐标,对应峰面积为纵坐标,绘制标准曲线。10种生物胺具有良好的线性关系,相关系数为0.997 8~0.999 9。将最低浓度的各生物胺标准溶液逐级稀释,以3倍噪音响应值对应的浓度作为检出限,10倍噪音响应值对应的浓度为定量下限(见表1)。
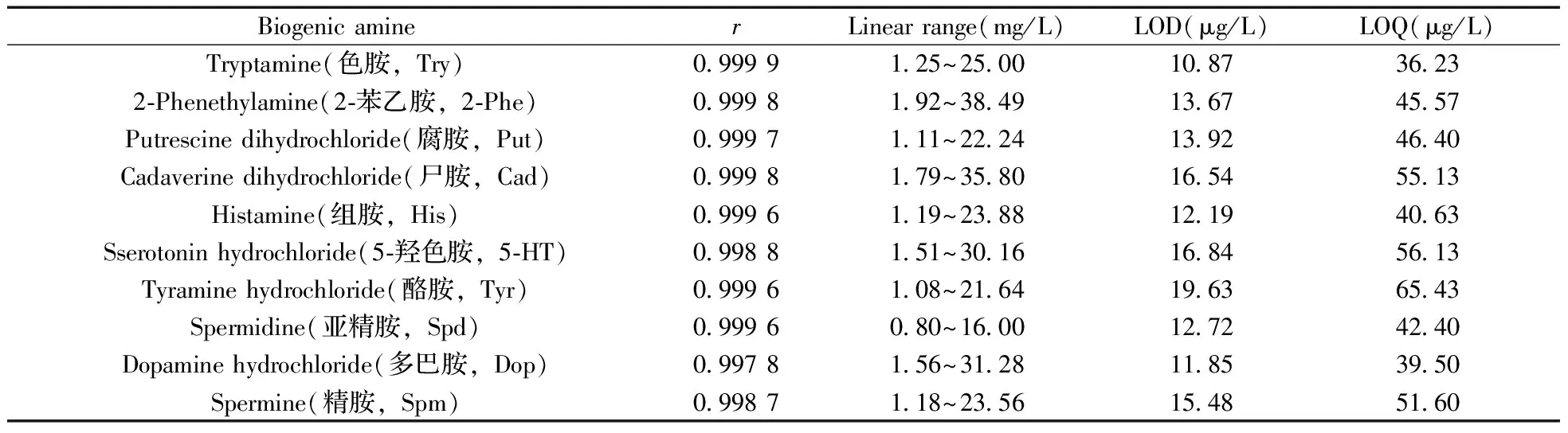
表1 10种生物胺的相关系数(r)、线性范围、检出限及定量下限Table 1 Correlation coefficients(r),linear ranges,limits of detection(LODs) and limits of quantitation(LOQs) of ten biogenic amines
2.2.2精密度、稳定性与重复性取4 mg/L混合标准溶液,连续进样6次,按“1.4”色谱条件上机测试,各成分峰面积的相对标准偏差(RSD)为0.10%~1.2%,说明仪器精密度良好。取排血茸纱片的供试样品溶液,按“1.4”色谱条件分别于0、2、4、6、8、10、12、16 h进样,对各成分峰面积积分,计算得RSD为0~1.9%,说明样品的稳定性良好。准确称取0.20 g排血茸纱片各6份,按“1.3”方法制备供试样品溶液,按“1.4”色谱条件上机测试,对各成分峰面积积分,得RSD为0~4.2%,说明样品的重复性良好。
2.2.3回收率试验向鹿茸样品中分别添加2、4、8 mg/L 3个水平的生物胺混合对照品溶液,每个水平做5个平行,按“1.3”方法制备供试品溶液,按“1.4”色谱条件上机测试,计算加标回收率及RSD(表2)。样品加标回收率为71.6%~101%,RSD为0.70%~11.4%。表2中部分化合物的回收率偏低,可能是由于样品的制备需经衍生化,增加了标准物质的损失概率。
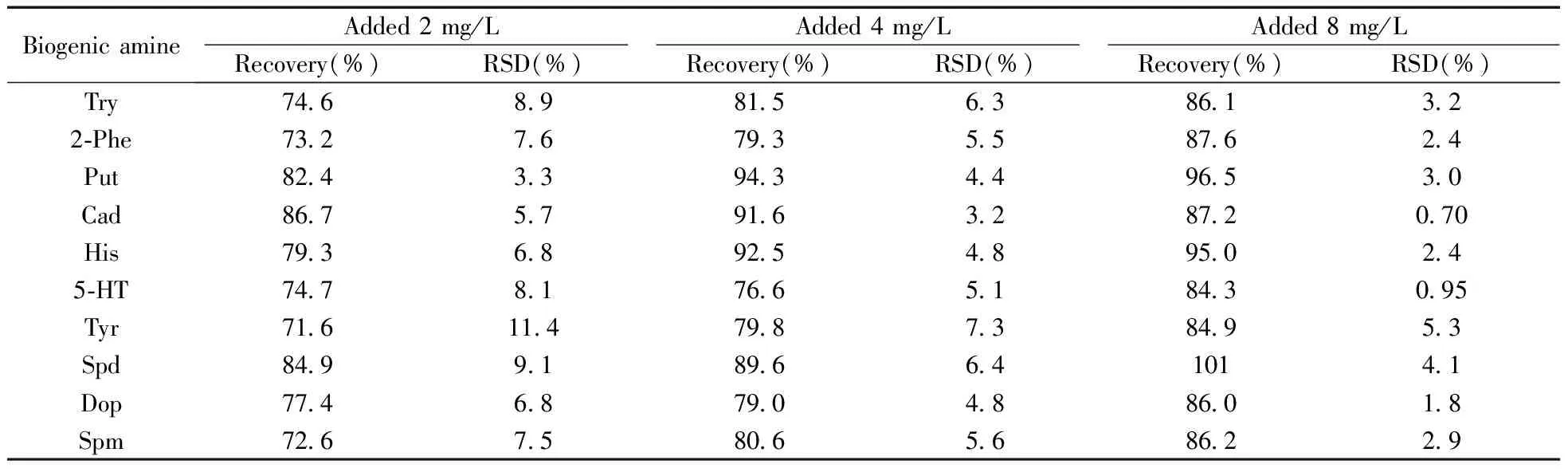
表2 10种生物胺的加标回收率及相对标准偏差Table 2 Spiked recoveries and RSDs of 10 biogenic amines
2.3 实际样品的检测
准确称取鹿茸样品0.20 g,平行3个,按“1.3”方法制备供试样品溶液,按“1.4”色谱条件上机测试。
2.3.1煮炸茸与冻干茸中生物胺的对比分析由表3可知,煮炸茸蜡片、粉片、纱片、骨片部位腐胺的含量依次为102.75、119.04、74.49、32.84 mg/kg,均高于冻干茸,且分别为冻干茸相应部位的1.66、1.73、1.69、1.53倍。煮炸茸与冻干茸蜡片部位亚精胺含量分别为114.20 mg/kg和107.96 mg/kg,二者差异不显著(P>0.05);冻干茸粉片、纱片、骨片部位中亚精胺含量依次为43.05、32.75、25.06 mg/kg,高于煮炸茸的20.77、1.62、2.63 mg/kg,且均差异显著(P<0.05)。冻干茸蜡片、粉片、纱片、骨片部位精胺的含量依次为96.62、22.41、20.90、15.82 mg/kg,显著高于煮炸茸,且分别为煮炸茸相应部位的1.47、2.26、7.04、3.90倍。煮炸茸蜡片、粉片、纱片、骨片部位的酪胺含量分别为15.18、10.05、7.75、5.70 mg/kg,高于冻干茸相应部位,且均差异显著(P<0.05)。煮炸茸不同部位多巴胺的含量在7.97~11.57 mg/kg之间,冻干茸在8.36~9.57 mg/kg之间。组胺、色胺、2-苯乙胺在煮炸茸与冻干茸中的含量均很少,且在不同部位间的分布规律不明显。5-羟色胺与尸胺在冻干茸中未检出,其中5-羟色胺仅在煮炸茸蜡片和纱片中测出,含量分别为1.36 mg/kg和1.56 mg/kg,尸胺仅在煮炸茸纱片中测出,含量为0.96 mg/kg。
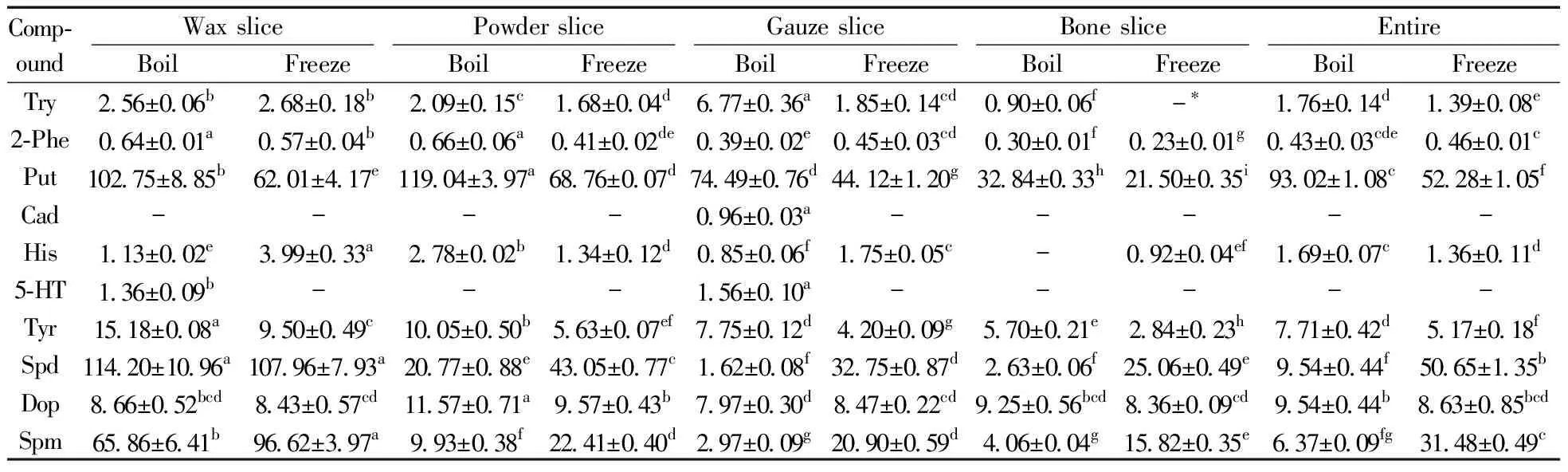
表3 煮炸茸和冻干茸中的生物胺含量(mg/kg)Table 3 Biogenic amine content in CCP with boiling process and freeze-drying technology(mg/kg)
*:content is below the detection limit or the quantitative limit;a-h:the significant difference at the level ofP=0.05;the same number on the same line with the same letter means no significant difference(P>0.05),otherwise it means that there is a significant difference(P<0.05)
所测10种生物胺总量在煮炸茸与冻干茸不同部位的分布趋势一致,即蜡片>粉片>纱片>骨片,煮炸茸与冻干茸蜡片部位的生物胺总量分别为312.33 mg/kg和291.77 mg/kg,二者差异显著(P<0.05)。煮炸茸粉片部位的生物胺总量为176.88 mg/kg,显著高于冻干茸的152.85 mg/kg(P<0.05)。两种加工方式鹿茸纱片部位的生物胺总量分别为105.31 mg/kg和114.49 mg/kg,二者无显著性差异(P>0.05)。煮炸茸骨片部位的生物胺总量为55.674 mg/kg,低于冻干茸的74.73 mg/kg,差异显著(P<0.05)。整体上,煮炸茸中生物胺总量低于冻干茸,且差异显著(P<0.05),与李可强等[14]的结论不一致。可能与样品群体差异性或储藏环境有关,有待进一步分析证明。
2.3.2排血茸与带血茸中生物胺的对比分析由表4可知,排血茸中检测到9种生物胺,其中5-羟色胺只在蜡片中检出,含量为2.08 mg/kg;本实验所测10种生物胺均在带血茸中检出,与排血茸相同,只在蜡片中检测到5-羟色胺,含量为1.58 mg/kg。尸胺在鹿茸中的含量很低,仅测出带血茸骨片中含有0.02 mg/kg。腐胺、亚精胺、精胺的含量较高。腐胺在排血茸与带血茸中的分布均以粉片部位最高,分别达155.63 mg/kg和147.23 mg/kg,二者差异显著(P<0.05);蜡片、纱片、骨片部位的腐胺含量依次减少。排血茸蜡片部位的腐胺为125.24 mg/kg,分别是纱片、骨片部位的1.28和2.28倍。带血茸蜡片部位的腐胺为118.62 mg/kg,与排血茸蜡片部位差异显著(P<0.05);纱片、骨片部位分别含腐胺92.47 mg/kg和51.93 mg/kg。亚精胺在排血茸与带血茸中的分布呈现蜡片、粉片、骨片、纱片依次减少的趋势。两种加工方式下鹿茸蜡片部位的亚精胺含量分别为122.18 mg/kg和114.61 mg/kg,二者差异显著(P<0.05)。精胺在不同部位的分布规律与腐胺一致。排血茸蜡片、粉片、纱片、骨片部位的精胺含量分别为71.44、11.63、2.95、3.12 mg/kg。带血茸蜡片部位含精胺74.55 mg/kg,高于排血茸,且差异显著(P<0.05)。精胺在带血茸粉片、纱片、骨片部位的含量与排血茸无显著性差异(P>0.05)。酪胺在蜡片、粉片、纱片、骨片部位的含量逐渐减少,排血茸中依次为15.49、11.53、7.74、6.57 mg/kg,带血茸中分别为14.93、10.23、7.77、6.35 mg/kg;同种加工方式不同部位之间均有显著性差异(P<0.05)。与酪胺相比,多巴胺在排血茸与带血茸不同部位的分布相对均匀。排血茸蜡片、粉片、纱片、骨片中多巴胺的含量分别为10.42、11.52、10.12、9.27 mg/kg,带血茸中相应部位依次为9.40、11.67、9.76、11.61 mg/kg;带血茸骨片部位的多巴胺含量高于排血茸,差异显著(P<0.05)。排血茸与带血茸骨片部位均未检出组胺,在排血茸和带血茸蜡片、粉片、纱片中组胺的含量依次为4.12 mg/kg和4.19 mg/kg、2.42 mg/kg和2.05 mg/kg、0.59 mg/kg和0.28 mg/kg,均呈现蜡片、粉片、纱片、骨片依次减少的趋势。2-苯乙胺在鹿茸不同部位的分布无明显规律,且含量较少。
对生物胺总量进行分析发现,排血茸蜡片、粉片、纱片、骨片部位的总量分别为357.07、226.26、125.18、77.74 mg/kg,均高于带血茸相应部位的含量343.42、216.72、125.15、76.16 mg/kg。排血茸的生物胺总量高于带血茸,二者差异显著(P<0.05),与李可强等[14]的结论一致。两种加工方式鹿茸的生物胺总量在不同部位的分布均表现为蜡片、粉片、纱片、骨片逐渐减少,不同部位之间差异显著(P<0.05)。
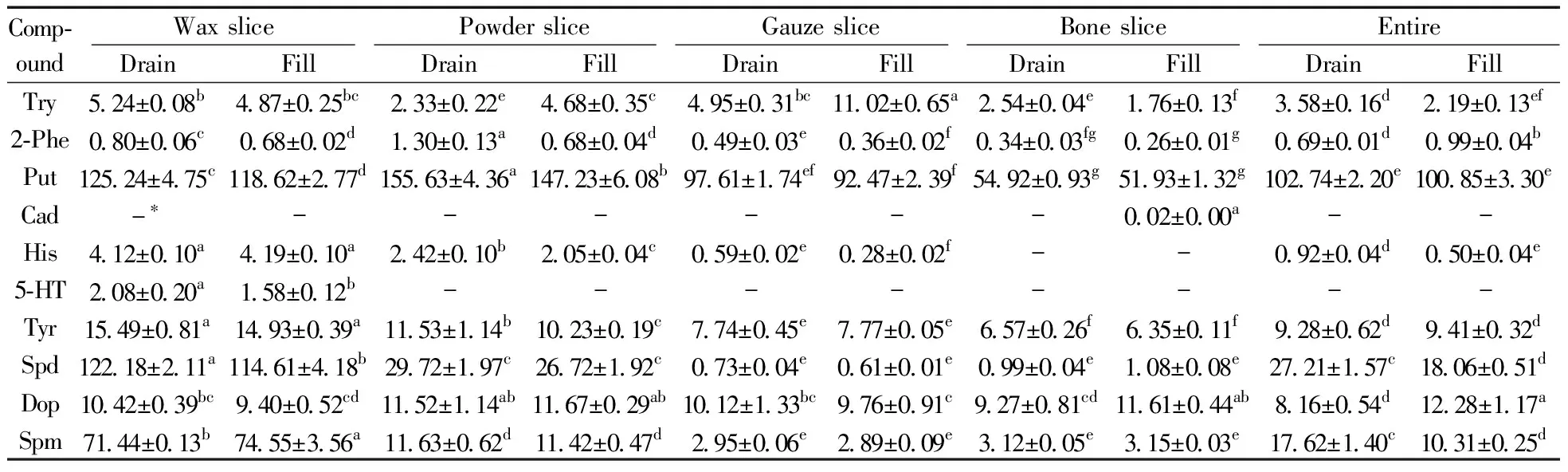
表4 排血茸和带血茸中的生物胺含量(mg/kg)Table 4 Biogenic amine content in blood-drained CCP and blood-filled CCP(mg/kg)
*:the content is below the detection limit or the quantitative limit;a-h represent the significant difference at the level ofP=0.05;the same number on the same line with the same letter means no significant difference(P>0.05),otherwise it means that there is a significant difference(P<0.05)
2.3.3鹿茸中的生物胺组分鹿茸中含有本实验所测10种生物胺组分,但尸胺和5-羟色胺的含量很低,仅在1×100mg/kg数量级甚至更低,冻干茸中未检出。腐胺含量最高,达1×102mg/kg,与李可强等[14]的报道一致。精胺、亚精胺次之,含量在(1~5)×102mg/kg。鹿茸中酪胺、多巴胺的含量在1×101mg/kg左右。色胺、2-苯乙胺、组胺的含量仅在(0~0.5)×101mg/kg。不同加工方式的鹿茸中生物胺总量在129.16~170.20 mg/kg之间,整体表现为冻干茸高于煮炸茸,排血茸高于带血茸。
2.4 生物胺的限量标准
联合国粮食和农业组织(FAO)和世界卫生组织(WHO)于2012年联合公布了水产品中生物胺的风险会议报告。美国规定水产品中组胺的含量不得超过50 mg/kg;欧盟规定食品中组胺的含量不得超过100 mg/kg,酪胺含量不得超过100~800 mg/kg;我国规定鲐鱼中组胺的含量不得超过1 000 mg/kg,其他海产鱼类中不超过300 mg/kg。根据以上标准,鹿茸中的组胺和酪胺均远低于限量值。目前尚无鹿茸中生物胺的限量标准,原因可能是生物胺更易在发酵食品中生成,鹿茸中的生物胺含量远低于生物胺的危害值,即在安全范围内。
3 结 论
本文对不同加工方式花鹿茸中的10种生物胺按不同部位分别进行了考察,结果显示,鹿茸中的生物胺总量在不同部位具有明显的分布规律,即蜡片部位>粉片部位>纱片部位>骨片部位,整体表现为冻干茸高于煮炸茸,排血茸高于带血茸。研究结果有望为鹿茸质量标准的建立及鹿茸产品开发提供理论依据。

