生物法合成左旋多巴的研究进展
,,
(浙江工业大学 生物工程学院,浙江 杭州 310014)
帕金森病(Parkinson disease,PD)是老年人群中常见的慢性、进行性、运动障碍性疾病,其临床表现主要为静止性震颤、运动迟缓、认知损害和运动反射障碍等[1].目前全世界帕金森病患者约400万,约270万患者生活在中国[2].随着现代社会生活压力的增加、环境的恶化以及人口老龄化的加剧,帕金森病患者数目将日益增加[3].美国Rochester大学的Dorsey等[4]的研究表明:到2030年,美国患者数量将比现在增加80%,中国患者数量或将超过500万.帕金森病主要是由于大脑中缺乏多巴胺引起的[5].左旋多巴又名左多巴(Levodopa,L-DOPA),是多巴胺前体,为目前治疗帕金森病的主要药物.多巴胺不能够通过血脑屏障到达大脑治疗帕金森病,而L-DOPA能够通过血脑屏障,到达中枢神经系统,并在体内脱羧酶的作用下转变为多巴胺,从而治疗帕金森病[6-7].常见的治疗帕金森病的药物多为L-DOPA及其与其他药物的复合物,如美多芭、息宁等[8].
L-DOPA目前主要的制备方法包括植物提取法、化学合成法和生物合成法3 种.由于植物提取法的局限性和化学合成法的环境不友好性,目前越来越多的研究转向于生物法合成L-DOPA.
1 L-DOPA植物提取合成方法
L-DOPA存在于许多天然植物中.1913年,生物化学家Guggenheim首次从蚕豆的荚膜中分离提取到L-DOPA.在此之后,在很多植物中均发现L-DOPA的存在,如猫豆、藜豆等[9].其中猫豆是提取L-DOPA最主要的原料,L-DOPA质量分数高达6%~9%.通过提取技术的改良,猫豆中L-DOPA的提取得率已从1.5%提高到3.4%,纯度达到99.9%[10].虽然从植物中直接分离提取L-DOPA是制备L-DOPA的传统方法,但是由于受到原料来源较少、提取步骤复杂繁琐等因素的限制,产量小、生产成本高,难以实现大规模生产,远不能满足市场需求.
2 L-DOPA化学合成方法
1911年,Funk在实验室中首次利用3,4-碳酰二氧苯甲醛为原料成功合成D,L-DOPA[11].1960年,Hoffmann La-Roche公司用脱氢松香胺作为手性拆分剂生产L-DOPA[12].1970年Knowles基于不对称氢化作用理论,发现双膦配体(PhospHine ligand, DIPAMP)的催化氢化,可以取得比较高的对映选择性,而且摩尔分数为0.005%的DIPAMP就能够使脱氢氨基酸不对称氢化取得e.e.值大于95%的高对映体选择性.该思路应用于L-DOPA的不对称合成,产物e.e.值大于97.5%,并于1974年由美国孟山都公司(Monsanto)投入生产[13-14].目前,工业化生产L-DOPA多以乙内酰脲与香草醛为原料,经过8步反应合成[15].化学法主要通过不对称合成法合成L-DOPA,但化学合成过程中需要大量金属催化剂,并且反应条件苛刻,产物转化率及对映体选择性低,同时存在成本高、环境不友好等问题[16],在工业生产上受到限制.
3 L-DOPA生物合成方法
生物法合成左旋多巴的生物催化剂主要包括酪氨酸酶、转氨酶、氨基酰化酶及酪氨酸酚裂解酶等.
3.1 酪氨酸酶法合成
酪氨酸酶(Tyrosinase,EC.1.14.18.1)以酪氨酸为底物,催化合成L-DOPA.此外,该酶还同时具有单酚氧化酶和二酚氧化酶的氧化还原作用,其中单酚氧化酶催化单酚羟基化,二酚氧化酶可将二酚类化合物氧化为醌类化合物.由于酪氨酸酶的二酚氧化作用,L-DOPA会被继续氧化生成多巴醌.为防止L-DOPA被氧化,通常需要引入化学还原剂,如抗坏血酸、NADH或者羟胺等,从而向多巴醌供应电子使其重新还原为L-DOPA.Krishnaveni等[17]发现真菌Acremoniumrutilum具有较高的酪氨酸酶生产能力,用该来源的酪氨酸酶转化酪氨酸合成L-DOPA,L-DOPA的最大产量为0.89 mg/mL.Valdes等[16]将酪氨酸酶固定于含铜离子的海藻酸钠中,运用填充床方法生产L-DOPA,产量达1.2 mg/L.经进一步条件优化,L-DOPA生产效率达到110 mg/(L·h).该方法的最大问题在于L-酪氨酸与L-DOPA的结构和理化性质很相近,因而使得后续L-DOPA的分离纯化变得困难,且需要消耗大量还原剂,因此无法投入工业化生产.酪氨酸酶催化酪氨酸合成L-DOPA反应式为
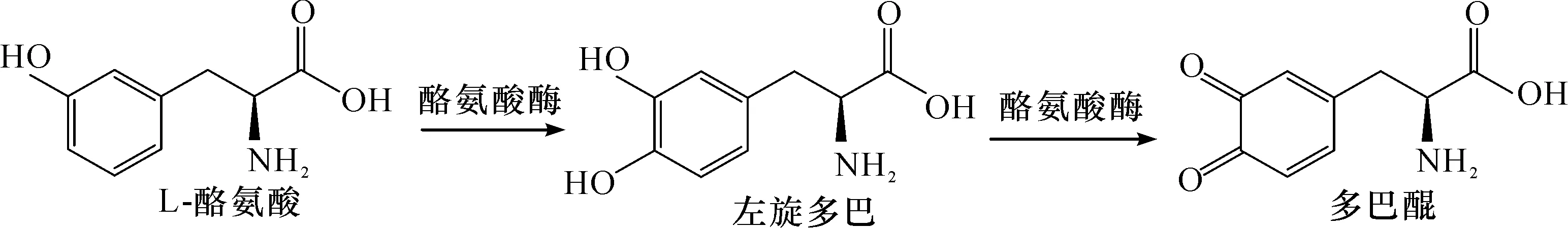
3.2 转氨酶法合成
转氨酶(Transaminase,EC.2.6.1.5)可利用L-天冬氨酸或L-谷氨酸为底物,将L-天冬氨酸或L-谷氨酸上的氨基转移至3,4-二羟基苯丙酮酸,从而生成L-DOPA.Nagasaki等[18-19]对来源于EnterobactercloacaeNB320,Alcaligenesfaecalis的转氨酶合成L-DOPA的能力进行了研究,发现源于粪产碱杆菌(Alcaligenesfaecalis)的转氨酶合成L-DOPA,其产量达4 mg/mL,转化率为80%.然而转氨酶法合成L-DOPA存在前体物质具有毒性、生产过程复杂及操作要求高等许多问题,随后相关的研究报道比较少见.转氨酶合成L-DOPA反应式为
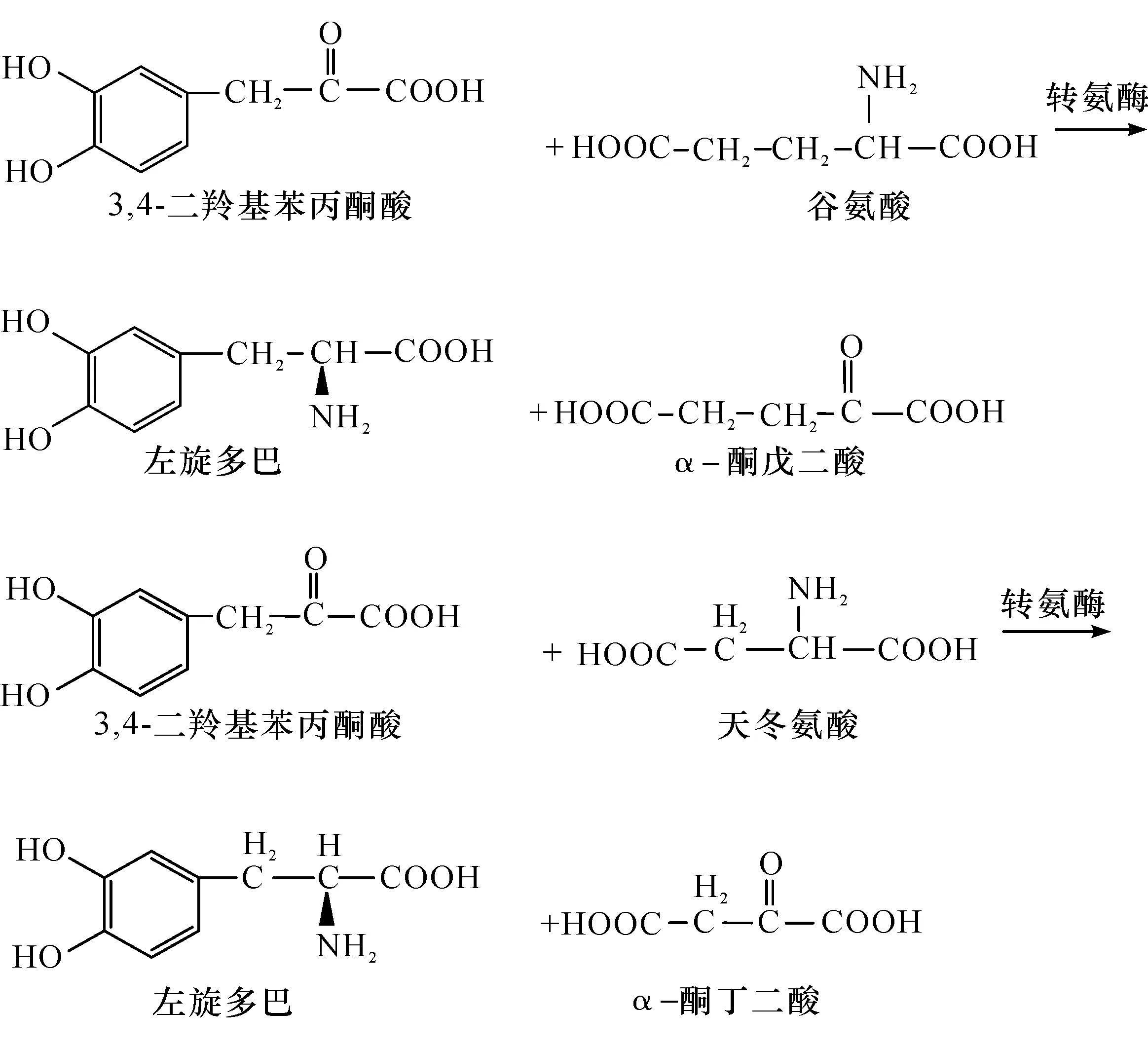
3.3 氨基酰化酶法合成
氨基酰化酶(Aminoacylase,EC.3.5.1.14)是一类能专一水解N-乙酰-L-氨基酸中酰胺键的酶,对映体选择性强.1957年,Chibatal等[20]首次发现米曲霉中含有大量的氨基酰化酶.其后研究表明:氨基酰化酶广泛存在于动物、植物和微生物中,而来自微生物的氨基酰化酶更稳定、经济,且底物专一性更强.1972年Robert首次发现N-乙酰-3,4-二甲氧基苯丙氨酸能被酰化酶立体专一性水解[21].Robert利用从米曲霉中提取得到的氨基酰化酶处理N-乙酰基-3-(3,4-二甲氧基)苯丙氨酸,质量浓度为107 g/L的底物于37 ℃,pH 7.3条件下,反应4 d,L-(3,4-二甲氧基)苯丙氨酸的光学纯度达到99%,收率为84.8%.然而,用于生产L-DOPA的氨基酰化酶大部分是从米曲霉中直接提取而来,提取过程繁琐复杂.为了提高酶的稳定性和使用效率,工业上多使用固定化酶.1998年日本Sankyo公司建立了完整的氨基酰化酶催化合成L-DOPA的路线,并于2008年投产.我国新华制药也用该法生产L-DOPA[22-23]量约为300 t.然而该方法酶提取复杂、合成步骤多,并且HBr的取代步骤会产生大量的臭氧层破坏物MeBr,环境污染严重.氨基酰化酶催化合成L-DOPA反应式为
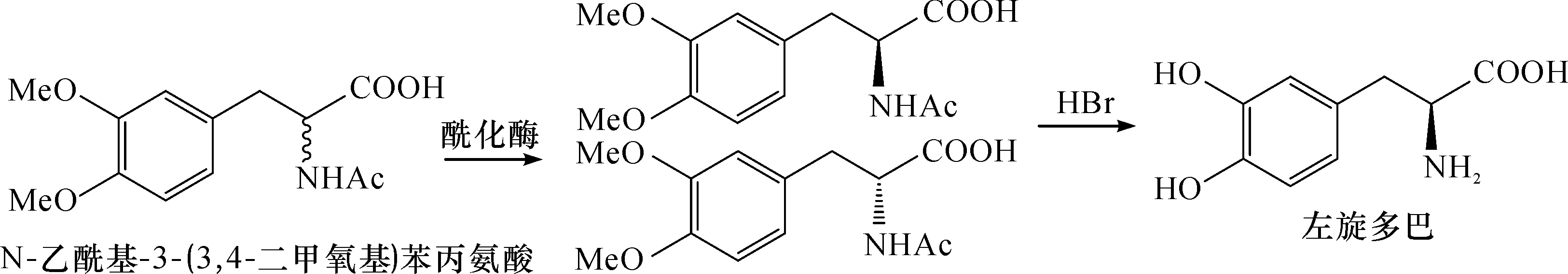
3.4 酪氨酸酶法合成
酪氨酸酚裂解酶(tyrosine phenol lyase, TPL, EC.4.1.99.2),又名β-酪氨酸酶,是一类磷酸吡哆醛(pyridoxal-5′-phosphate, PLP)依赖型裂解酶.TPL能够催化L-酪氨酸发生α,β-消去反应生成丙酮酸、苯酚和氨.由于这个反应是可逆的,将邻苯二酚替代苯酚后,TPL可催化邻苯二酚、丙酮酸和氨合成L-DOPA[24-25].TPL广泛存在于多种微生物如假单胞菌属[26]、真菌[27]和链霉菌[28]等中,其中草生欧文氏菌(Erwiniaherbicola)和弗氏柠檬酸菌(Citrobacterfreundii)中的TPL活性较高[29-30].
3.4.1 TPL的催化机理
TPL分子由4个分子量约为50 kDa的相同大小亚基组成,每个亚基都分别有1 个PLP结合位点[31].其催化机理包括如下步骤:1) 酶活性部位Lys257的ε-氨基与PLP共价结合形成内醛亚胺;2) 内醛亚胺与底物L-酪氨酸作用形成外醛亚胺;3) Lys257夺取外醛亚胺(底物)的Cα质子产生醌型中间物;4) 经底物Cγ质子化及Cβ-Cγ键断裂生成α-氨基丙烯酸中间物;5) α-氨基丙烯酸中间物进一步受与PLP结合的Lys257 ε-氨基攻击再生TPL全酶.TPL催化β-消除的推测反应机理为

Antson等[32]研究确定了TPL分子与PLP的结合位点位于Lys-257.Phillips等发现,在TPL分子结构上的Tyr-71,Arg-381,Thr-124和Phe-448几个位点对酶活性高低起着重要作用[32-36].这些位点的发现为TPL的分子改造提供了重要的理论基础.TPL分子与PLP的结合位点为
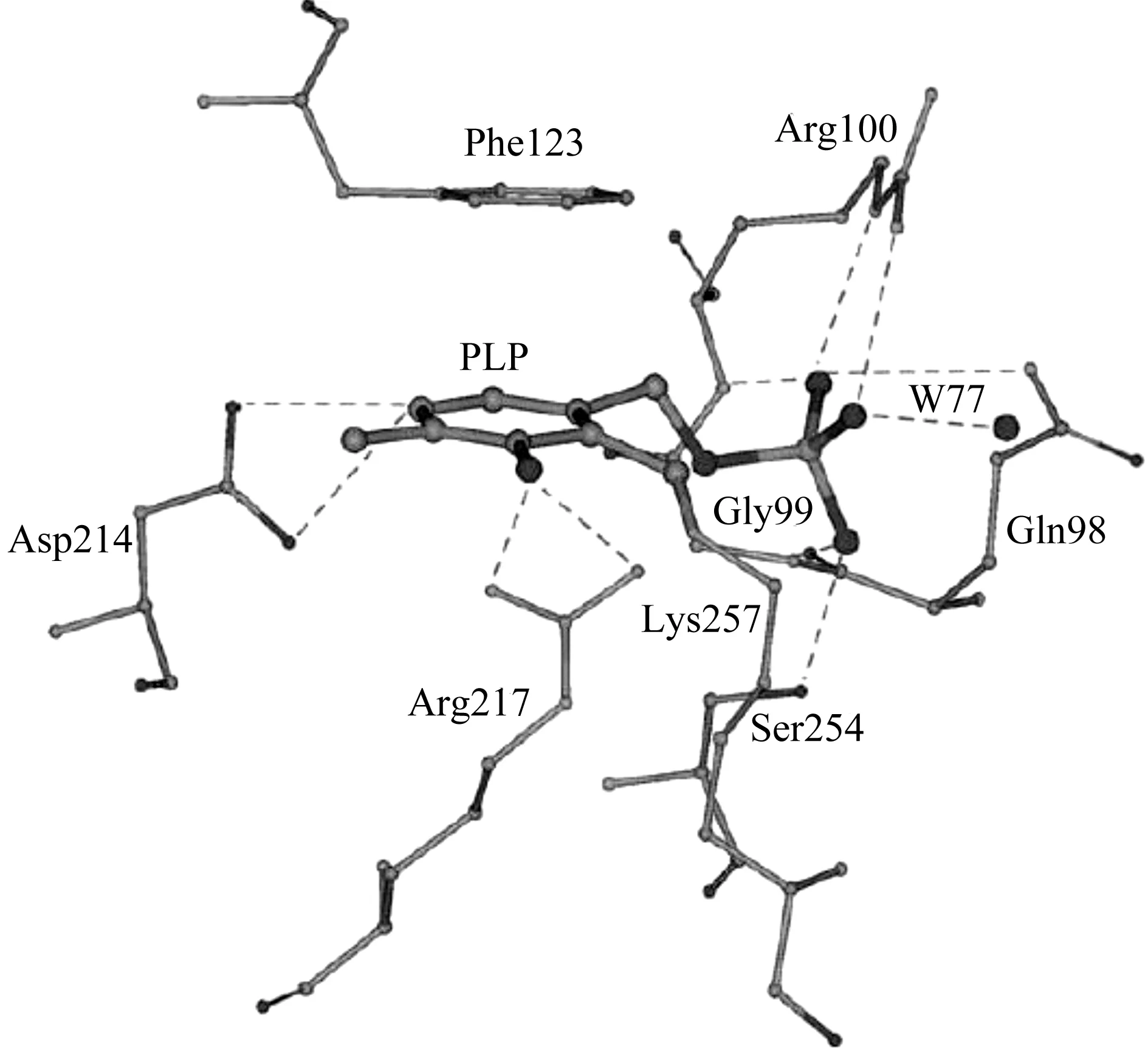
3.4.2 TPL法合成L-DOPA研究进展
L-DOPA在水中的溶解度较低,在反应过程中大部分会结晶析出,使反应平衡朝着有利于合成L-DOPA的方向进行,达到较高的转化率和产率.相比于其他催化合成L-DOPA的氨基酰化酶、酪氨酸酶和羟化酶等[37-38],TPL具有更高的活性和催化效率,工业化成本较低,适用于L-DOPA的工业化生产.但是E.herbicolaTPL需要以L-酪氨酸作为诱导剂才能表达,而L-酪氨酸与L-DOPA的结构和理化性质十分相似,导致产物L-DOPA分离纯化难度增加[39].Koyanagi等[40]发现TPL的诱导表达受TyrR蛋白的调节,因此对TyrR基因进行了突变,得到了对L-酪氨酸依赖性降低的突变体.但想要提高TPL表达量仍需添加一定量L-酪氨酸.1993年,Foor等[41]将来源于E.herbicola的TPL目的基因,导入到Escherichiacoli中,使用乳糖代替L-酪氨酸进行诱导,但TPL在E.coli中可溶性表达差.用价格低廉的乳糖代替酪氨酸诱导TPL在大肠杆菌中进行外源表达,使得诱导和分离成本大大降低,为利用重组菌合成L-DOPA的工业化应用打下了基础.TPL催化合成L-DOPA的反应式为
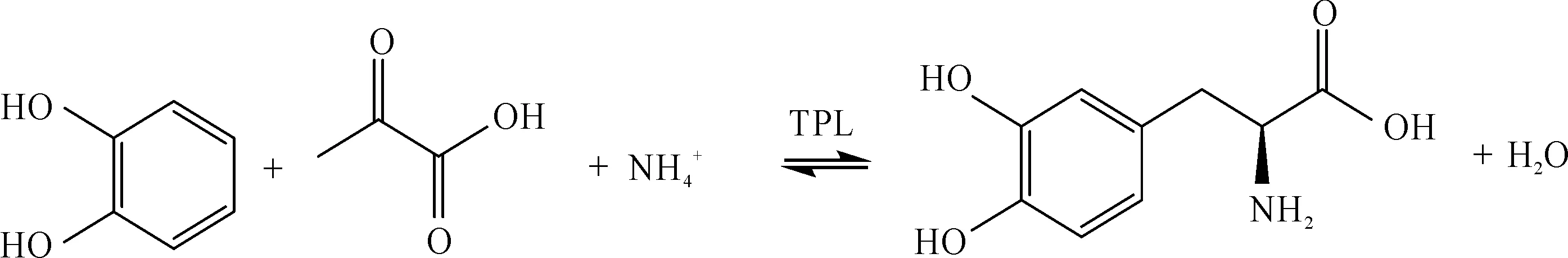
邻苯二酚属于蛋白质变性剂[42],在高强度工业生产环境压力下,高浓度邻苯二酚会使TPL发生不可逆失活,导致TPL的活性大幅降低[43-44].Lee等[43]发现嗜热菌Symbiobacteriumsp. SC-1 TPL对酚类物质的耐受性要比E.herbicola及其他嗜温菌来源的TPL更高.在高浓度邻苯二酚反应体系中,来源于嗜热菌Symbiobacteriumsp. SC-1的TPL依旧保持有较高的活性[45].然而,该TPL的催化活力远低于E.herbicola来源TPL[46].因此,要提高TPL催化合成L-DOPA的能力,必须要克服高浓度邻苯二酚对TPL的抑制作用.目前对TPL进行分子改造提高TPL对邻苯二酚耐受性的报道较少.研究表明:向反应体系中添加硼酸可以与邻苯二酚络合形成可溶性复合物,降低邻苯二酚的抑制作用[47],但是L-DOPA与硼酸也会发生络合作用,使得反应体系中L-DOPA的溶解度增加,从而影响合成反应的继续进行[42].在目前的相关报道中,能有效解决高浓度邻苯二酚抑制作用的方法为底物分批补料法.Enei等[42,48]在合成L-DOPA的过程中采用了底物分批补料的方法.该方法在一定初始底物浓度的基础上,通过分批次向反应体系中补加邻苯二酚与丙酮酸维持底物的浓度,使L-DOPA产量达到58.5 g/L.随后大量关于L-DOPA合成的研究都是在该补料方法的基础上进行的.
2005年,李华钟等[47]用来源于弗氏柠檬酸杆菌(C.freundii)的TPL催化合成左旋多巴,能使左旋多巴产量达55 g/L .2010年,日本味之素公司(Ajinomoto)[12]利用草生欧文菌(E.herbicola)的TPL崔化合成左旋多巴,能使左旋多巴产量达110 g/L.2017年,Zheng等[49-50]利用来源于具核梭杆菌(F.nucleatum)的TPL催化合成L-DOPA,使其最终产量达到120 g/L,为目前文献报道最高产量水平.他们首先通过基因挖掘技术,从数据库中筛选到来自具核梭杆菌的具有高活力的TPL目的基因(Fn-TPL),通过PCR以及分子克隆表达技术,将筛选获得的基因序列首先克隆表达于大肠杆菌宿主细胞中;然后对重组菌进行诱导表达条件的优化和酶学性质的研究;最后对Fn-TPL催化合成L-DOPA的反应条件进行了优化,构建了一条新的生物催化合成L-DOPA的工艺路线,为酪氨酸酚裂解酶法合成左旋多巴的大规模工业生产提供了基础.在该研究中,以大肠杆菌为宿主菌,避免了使用L-酪氨酸作为诱导剂,减少了后期产物分离纯化的难度,并且相比于野生菌,工程菌生长迅速,极易培养,能在廉价的培养基中生长,缩减了工业生产的成本.通过构建分批补料方法,解除了高浓度邻苯二酚对底物的抑制作用,降低了副产物的产生.在进行工艺放大的过程中,通过外源添加L-DOPA作为晶种,引导反应液中L-DOPA定向结晶析出,有效减轻了L-DOPA包裹细胞引起的传质阻力.最终在3 L反应体系中,邻苯二酚转化率达95%,L-DOPA产量达120 g/L,产物e.e.值>99%.
4 结 论
随着人口老龄化的到来,我国帕金森病患者数量迅速增加,带动了对左旋多巴的旺盛需求.由于传统制备左旋多巴的方法如植物提取法和化学合成法存在较多问题,不利于长远发展应用,而生物法合成左旋多巴具有反应条件温和、过程高效、高度立体、区域和化学选择性高等优点,已逐渐更多地应用到工业生产左旋多巴中.其中,酪氨酸酚裂解酶法催化合成左旋多巴具有原子经济性高、反应条件温和以及转化率高等优势,为建立高效、绿色的左旋多巴生产路线奠定了基础.

