SERPINA 3在舌鳞状细胞癌组织中表达及临床意义
王圣娣,熊 莉,郭 艳
(1. 鄂东医疗集团黄石市中心医院 湖北理工学院附属医院 口腔科,湖北 黄石 435000;2. 中国医科大学第四医院 口腔科,辽宁 沈阳 110000)
舌鳞状细胞癌(简称舌癌,tongue squamous cell carcinoma,TSCC)作为口腔科常见的恶性肿瘤,发病率呈不断上升趋势[1],由于该肿瘤生长快、侵袭力强,多数患者临床确诊时已发生转移,是导致患者预后不佳的主要因素[2],近年来虽然临床诊疗手段不断进步,但患者5年生存率提高有限[3]。研究发现[4],TSCC发生进展涉及多个癌基因或抑癌基因。但其具体发生机制尚未完全清楚。因此,深入探讨TSCC发生的分子机制对改善患者预后具有重要意义。丝氨酸蛋白酶抑制因子A类3(serpin peptidase inhibitor clade A member 3,SERPINA 3)作为丝氨酸蛋白酶抑制剂超家族重要成员,是一种急性炎症反应蛋白,在炎症反应及细胞增殖、凋亡、黏附等过程中发挥重要作用[5],与多种恶性肿瘤发生及进展关系密切[6]。本研究拟检测TSCC组织中SERPINA 3蛋白表达,探讨其与临床病理特征之间的关系及对预后的影响,以期为TSCC机制研究提供基础资料。
1 资料与方法
1.1 一般资料 选取2010年3月~2012年4月在黄石中心医院口腔科择期行手术治疗的63例TSCC患者,均经术后病理学检查确诊,术前均未行放化疗治疗。其中,男性38例,女性25例,年龄41~76岁,平均年龄(53.7±10.2)岁,分化程度:低分化7例,中分化36例,高分化20例;TNM分期:Ⅰ期12例,Ⅱ期23例,Ⅲ期17例,Ⅳ期11例;发生颈淋巴结转移39例。同期留取45例因舌外伤或舌部良性病变行手术切除的正常舌黏膜组织作为对照,其中男性25例,女性20例,年龄38~75岁,平均年龄(52.5±9.8)岁,两组患者性别、年龄差异无统计学意义(P>0.05),均衡可比。所有入选对象均由同一医院同一组医师完成手术操作。本研究通过医院伦理委员会批准,所有患者均行知情同意。
1.2 主要试剂和设备 免疫组化试剂盒购自武汉博士德生物工程公司,兔抗人SERPINA 3多克隆抗体购自美国Abcam公司,总RNA提取试剂盒(Trizol法)购自美国Invitrogen公司,反转录和PCR试剂盒购自美国Promega公司,SERPINA 3和内参引物均由上海生工生物公司设计合成,实时荧光定量PCR仪购自德国AJ公司。
1.3 方法
1.3.1 免疫组化法检测TSCC和对照组的组织中SERPINA 3蛋白表达 分别将TSCC和对照组的组织用甲醛固定,石蜡包埋,切片,厚度约3 μm,脱蜡,梯度乙醇至水,置于10 mmol/L柠檬酸盐缓冲液(pH 6.0)中,95℃水浴20 min,加入0.3%过氧化氢15 min,以阻断内源性过氧化物酶,PBS冲洗3次,用1%山羊血清于室温下封闭60 min,将一抗兔抗人SERPINA 3多克隆抗体(1∶1000稀释)加入,4℃过夜孵育,加入二抗,37℃孵育60 min,DAB显色,苏木素复染,中性树胶封片,以PBS代替一抗作为对照。结果判定:SERPINA 3主要表达于细胞质,以胞质中出现黄色或棕黄色染色为阳性。随机取5个高倍视野,以染色强度和阳性细胞比例综合评价[7],①染色强度:0分,无染色;1分,淡黄色;2分,黄色;3分,棕黄色;②阳性细胞比例:0分,<5%;1分,5%~25%;2分,26%~50%;3分,51%~75%;4分,≥75%;③根据染色强度和阳性细胞比例得分之和进行判定:0~分,阴性(-),2~7分,阳性(+)。所有切片均由2位病理科具有主任医师职称的医师单独双盲完成,并取得一致结果。
1.3.2 实时荧光定量PCR技术检测TSCC和对照组组织中SERPINA 3基因表达 取TSCC或对照组组织,研磨后加入细胞裂解液,提取细胞中总RNA,并用紫外分光光度计检测纯度。用反转录试剂盒将总RNA反转录为cDNA,以cDNA为模板,用PCR试剂盒对目的基因进行扩增。SERPINA 3基因序列:上游为5′-AAGAGGTAGAGGATAGGG-3′,下游为5′-ATACTATAAACACTCTCCTCT-3′;GAPDH基因:上游为5′-AAGATCATCAGCAATGCCTCC-3′,下游为5′-TGGACTGTGGTCATGAGTCCTT-3′。PCR反应条件:95℃ 5 min,92℃ 30 s,92℃ 30 s,60℃ 30 s,75℃ 30 s,连续进行38次循环,每个样品设3个平行反应复孔。用2-△△Ct法计算TSCC和对照组组织中SERPINA 3 mRNA相对表达量。
1.3.3 病例随访 对所有患者治疗后进行随访,随访形式包括电话、门诊,随访中失访3例,随访截止至2017年4月30日。
1.4 统计学方法 采用SPSS 21.0软件进行统计学分析,计量资料采用均数±标准差表示,计数资料采用率值表示,组间比较采用χ2检验,生存分析采用Kaplan-Meier法,利用Cox比例风险回归模型分析TSCC患者生存的影响因素,P<0.05为差异有统计学意义。
2 结果
2.1 两组SERPINA 3的蛋白表达 TSCC组织中SERPINA 3蛋白阳性表达率为71.43%(45/63),对照组则为33.33%(15/45),差异有统计学意义(χ2=15.429,P=0.000),见图1。
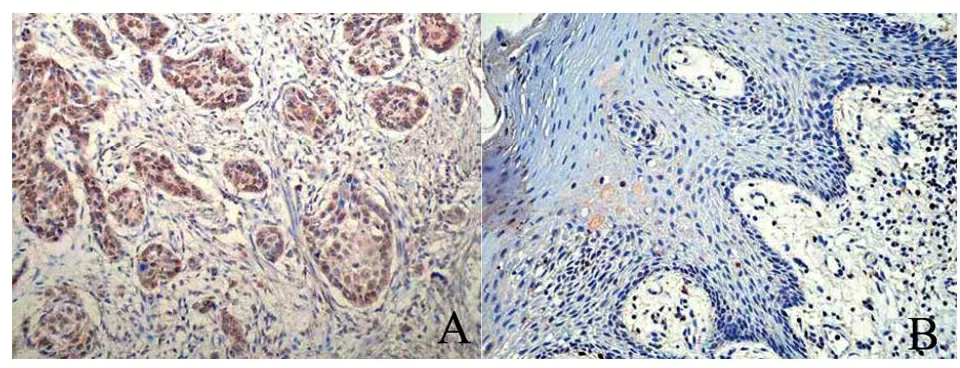
A.SERPINA 3蛋白在TSCC组织中呈高表达;B.SERPINA 3蛋白在对照组组织中呈低表达,SP×200。
图1 两组SERPINA 3蛋白表达
2.2 两组SERPINA 3的基因表达 TSCC组织中SERPINA 3 mRNA相对表达量为2.08±0.12,对照组则为1.16±0.08,差异有统计学意义(t=44.711,P=0.000)。
2.3 TSCC组织中SERPINA 3蛋白和基因表达与临床病理特征之间的关系 TSCC组织中SERPINA 3蛋白和基因表达均与性别和年龄无关(P>0.05),而与分化程度、TNM分期和颈淋巴结转移有关(P<0.05),见表1。

表1 TSCC组织中SERPINA 3蛋白和基因表达与临床病理特征之间的关系
2.4 TSCC组织中SERPINA 3蛋白表达对预后的影响 Kaplan-Meier生存分析结果显示,SERPINA 3蛋白阳性表达组患者5年总体生存率为34.88%,中位生存时间36.30个月,阴性表达组则分别为64.71%和51.24个月,Log-Rank检验差异有统计学意义(χ2=4.830,P=0.028),见图2。
2.5 TSCC患者预后影响因素分析 Cox比例风险回归模型分析结果显示,SERPINA 3蛋白阳性表达、TNM分期Ⅲ~Ⅳ期、发生颈淋巴结转移是TSCC患者预后的独立影响因素,见表2。

图2 TSCC组织中SERPINA 3蛋白表达对预后的影响
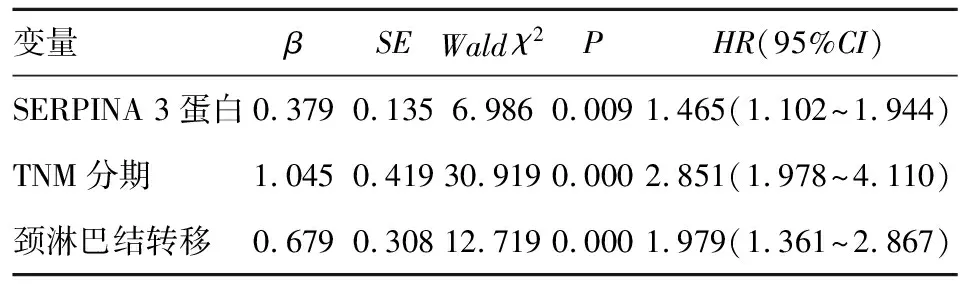
表2 TSCC患者预后影响因素的Cox比例风险回归模型
3 讨论
TSCC作为一种侵袭力强、生长迅速、恶性程度高的恶性肿瘤,可导致舌肌运动受限,对患者言语、吞咽、进食等功能造成影响[8],而且该肿瘤早期转移率较高[9],多数患者预后不良。目前,TSCC发病机制尚未完全清楚,因此,深入探讨影响该肿瘤侵袭、转移的机制对改善患者预后具有重要意义。SERPINA 3基因位于人染色体14q32.1,是一种炎症反应相蛋白,在机体发生炎症反应时表达增加具有抗炎功能[10],但一旦出现SERPINA 3基因大量异常表达时,可抑制细胞凋亡、减少细胞间黏附,而参与了恶性肿瘤发生及进展过程[11]。已有研究表明,其在子宫内膜癌[12]、结直肠癌[13]、肝癌[14]等多种恶性肿瘤组织中表达上调。本研究结果显示,TSCC组织中SERPINA 3蛋白阳性表达率和基因表达量均高于对照组,说明SERPINA 3在TSCC组织中呈高表达,可能参与了TSCC发病过程。
本研究结果显示,TSCC组织中SERPINA 3蛋白和基因表达均与分化程度、TNM分期和颈淋巴结转移有关,中低分化、Ⅲ~Ⅳ期和发生颈淋巴结转移患者组织中表达量增加,表明SERPINA 3可能参与了TSCC进展过程,与肿瘤恶性进展及转移过程有关。有研究指出[15],SERPINA 3高表达与黑色素瘤患者高病死率有关。本研究结果显示,SERPINA 3蛋白阳性表达组患者5年总体生存率和平均生存时间均低于阴性表达组,说明SERPINA 3蛋白高表达影响患者预后,Cox比例风险回归模型分析结果进一步显示,SERPINA 3蛋白阳性表达是TSCC患者预后的独立影响因素,因此,SERPINA 3蛋白阳性表达可能是患者预后不良的标志。
综上所述,TSCC组织中SERPINA 3蛋白和基因呈高表达,且与分化程度、TNM分期和颈淋巴结转移有关,是影响患者预后的因素之一,有望成为预测患者预后的生物学标志物。

