四氯化锡催化酮、胺、醛三组分“一锅法”Mannich反应
李晓峰,石利红,华宇鹏
(1.太原学院,山西 太原 030032;2.山西大学,山西 太原 030006;3.鄂尔多斯应用技术学院,内蒙古 鄂尔多斯 017000)
Mannich 反应是从上世纪初逐步发展起来的一个重要的有机合成反应,许多化学家都对其进行了研究[1-5]。Mannich 反应是指在酸的催化作用下,含有 α 活泼氢的化合物与醛和胺发生缩合反应而脱去一水分子,进而得到 Mannich 碱(或盐),即 β-胺基酮类化合物。故而 Mannich 反应也称作胺基化反应。其反应机理如式 1 所示。
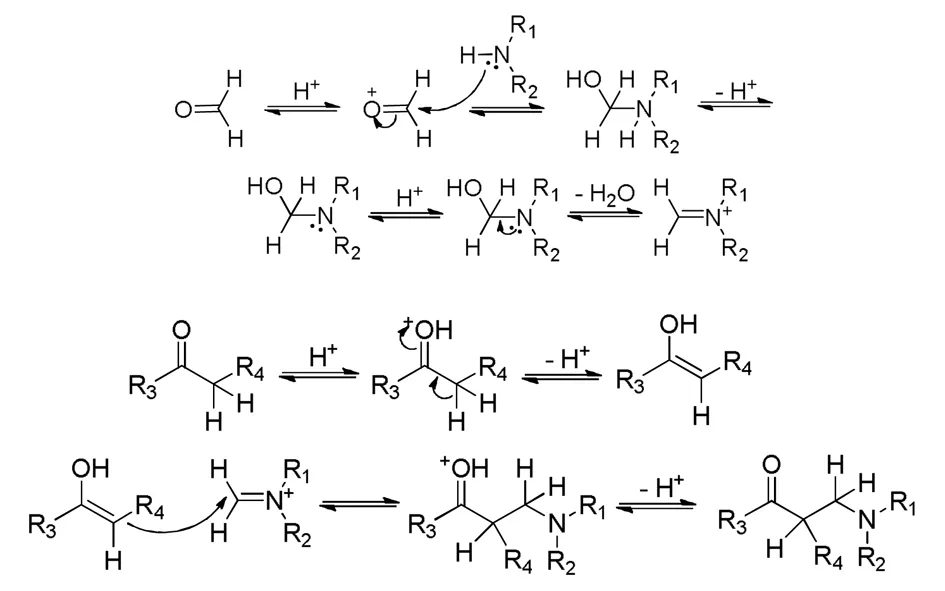
式1 Mannich反应机理示意图
鉴于 Mannich 反应的自利用性、所用催化剂的高效性及无明显副反应等优点,Mannich 反应已经成为化学界新的重点研究方向之一。Mannich 反应已越来越多地被广泛应用于各个领域,无论是无机还是有机化学家都对其产生了浓厚的兴趣,对 Mannich 反应催化剂的研究也成为近些年来金属有机催化领域中的新焦点。
随着对Mannich反应的深入研究,Mannich反应催化剂的种类也与日俱增[6],陆续出现了一些新型的催化剂,其中有代表性的是金属卤化物催化剂。金属卤化物Mannich反应催化剂有NbCl5[7]、InCl3[8]、AlCl3[9]等。我们希望能探索出一种新的Mannich反应高效金属卤化物催化剂。本文使用SnCl4催化酮、胺、醛三组分“一锅法”Mannich反应,一步合成了一系列β-胺基酮衍生物,同时对各种具有不同取代基官能团的芳香类酮、胺、醛的三组分“一锅法” Mannich 反应的催化性能进行了研究。
1 实验部分
1.1 实验试剂
溶剂(乙醚、无水乙醇、乙酸乙酯)纯化过程中所有的操作均在标准的、无水条件下,采用标准的Schlenk技术来进行的。反应物(苯胺、苯甲醛、苯乙酮、对硝基苯甲醛、对甲氧基苯甲醛、对硝基苯胺、对甲氧基苯胺)在无水硫酸镁干燥后减压蒸馏备用。无水乙醇重结晶备用。金属卤化物SnCl4(分析纯)可以直接从市场购买。
1.2 仪器及设备
电子分析天平、磁力搅拌器、圆底烧瓶、胶头滴管、玻璃棒、布氏漏斗和滤瓶,循环水式真空泵型号:SHZ-D(Ⅲ)、旋转蒸发仪型号:BÜCHI Rotavapor R-200和核磁共振仪型号:德国布鲁克-600兆-NMR。
1.3 实验内容
1.3.1催化剂用量的筛选
首先以苯乙酮、苯胺、苯甲醛作为反应起始底物。三者的用量摩尔比为苯乙酮:苯胺:苯甲醛=1.2:1:1,用剂量为3 mol% 的SnCl4作催化剂。并以无水乙醇(20 mL)作为溶剂,常温条件下对苯乙酮、苯胺、苯甲醛三组分进行一锅法的Mannich反应。具体实验步骤如下:
取苯乙酮12 mmol(1.443 g)、苯胺10 mmol(0.932 g)、苯甲醛10 mmol(1.062 g),三组分依次加入50 mL圆底烧瓶(内加磁子)中,然后加入20 mL无水乙醇并常温搅拌;迅速加入无水SnCl4催化剂(1.5 mol%)/(3 mol%)/(6 mol%)/(9 mol%),继续搅拌,半小时后白色固体出现;反应7小时后出现大量固体产物,做TLC跟踪反应进程,显示反应尚未完全;待反应10小时后做TLC跟踪,显示反应各组分的含量不再变化时,用新配制的6.0% 的Na2CO3水溶液滴入反应的圆底烧瓶内,调节反应环境的酸碱度至pH等于7,继续搅拌15分钟;停止搅拌,用旋转蒸发仪除去反应物中的有机溶剂,得白色粘稠固体;后采用减压抽滤得到粗产品,并分别用水和石油醚洗涤产品(2×10 mL),再抽干;待产品干燥后用乙醇-丙酮溶解重结晶提纯得所需白色固体产品;产品真空干燥后称量,计算其产率。
按照上述实验方法步骤用SnCl4催化剂分别在1.5 mol%、3 mol%、6 mol%、9 mol%四种剂量下完成苯乙酮、苯胺、苯甲醛三组分一锅法Mannich催化反应。对催化效果进行分析比较如表1所示。

表1 不同剂量SnCl4催化三组分Mannich反应
由表1可见,SnCl4剂量增大时,反应时间缩短了,产率提高了。由此得出,催化剂的用量对催化反应的产率有明显影响,产率与催化剂的剂量成正增长关系。由实验对比分析后,综合考虑催化剂(SnCl4)剂量6mol% 为最佳。
1.3.2溶剂的筛选
采用三种较为常见的有机溶剂:乙酸乙酯、乙醚、无水乙醇,分别作为Mannich催化反应的反应溶剂,并且对溶剂的用量进行了10 mL和20 mL的两种剂量的平行分组实验。同时,选用催化剂路易斯酸——四氯化锡对苯乙酮、苯胺、苯甲醛三组分进行“一锅法”的Mannich催化反应实验。反应的实验相关数据如表2所示。

表2 不同溶剂对三组分Mannich催化反应产率的影响
痕量:由1H-NMR谱或TLC法确定
由表2看出,一是无水乙醇作为溶剂的产率较高;二是当溶剂种类一定时,反应所加溶剂的剂量对反应速率无影响,但与产率成负增长关系。因此,催化反应的理想溶剂是无水乙醇(EtOH),其溶剂合理用量为10 mL。
1.3.3反应温度的筛选
用6 mol%的SnCl4作催化剂,10 mL的无水乙醇(EtOH)作溶剂,对苯乙酮、苯胺、苯甲醛三组分进行“一锅法”的Mannich催化反应,反应温度分别是20℃和40℃。通过实验数据对比分析,提高温度对催化产率没有显著影响。所以选择反应温度为20℃。
1.3.4催化剂对反应底物的适应性
为了进一步研究催化剂无水SnCl4对不同酮、胺、醛三组分反应底物的适应性,我们挑选了一系列不同的胺和醛作为反应底物进行Mannich反应,进而将催化剂无水SnCl4对不同酮、胺、醛三组分反应底物的适应性进行了比较分析。代表性反应的具体实验步骤如下:
1)分别取苯乙酮12 mmol(1.443 g)、苯胺10 mmol(0.932 g)、苯甲醛10 mmol(1.062 g),依次加入50 mL圆底烧瓶(内加磁子)中,再加入无水乙醇10 mL并在常温下开始搅拌;迅速加入催化剂SnCl40.156 g(6 mol%),继续搅拌,30分钟后便有白色固体生成;反应7小时后出现大量白色固体产物,做TLC跟踪反应进程,显示反应尚未完全;待反应8小时后做TLC,显示反应各组分的含量不再改变时用新配制的6.0%的Na2CO3水溶液滴加入反应的圆底烧瓶内,以调节反应环境的酸碱度至 pH等于7,后继续搅拌15分钟;停止搅拌,用旋转蒸发仪除去反应物中的有机溶剂,使产物浓缩;后采用减压抽滤得到粗产品,并分别用水和石油醚洗涤产品(2×10 mL),产品进一步除杂、纯化后再抽干;待产品干燥后用乙醇-丙酮等体积混合液溶解重结晶提纯得所需产品;真空干燥后称量得白色固体2.57 g,产率83.1%,熔点:166-169oC。1H NMR (CDCl3, 600 MHz, δ/ppm): 3.33-3.51 (m, 2H, COCH2), 4.51 (s, H, C6H5NH), 4.95-4.98 (m, H, C6H5CHNH), 6.50-6.53 (m, 2H, C6H5), 6.59-6.64 (m, H, C6H5), 7.02-7.07 (m, 2H, C6H5), 7.16-7.30 (m, 3H, C6H5), 7.40 (m, 4H, C6H5), 7.50-7.54 (m, H, C6H5), 7.85-7.88 (m, 2H, C6H5)。
2)取对苯乙酮12 mmol(1.443g)、苯胺10 mmol(0.933g)、硝基苯甲醛10 mmol(1.53 g),依次加入50 mL圆底烧瓶(内加磁子)中,再加入无水乙醇10 mL并在常温下开始搅拌;接着迅速加入催化剂SnCl40.156 g(6mol%),继续搅拌,半小时后黄色固体出现,继续反应6小时有大量产物生成;做TLC跟踪反应进程,显示反应尚未完全;待反应8小时后做TLC跟踪进程,显示反应各组分的含量不再变化时用新配制的6.0%的Na2CO3水溶液滴入反应的圆底烧瓶内,调节反应环境的酸碱度至pH等于7,继续搅拌15分钟;停止搅拌,用旋转蒸发仪除去反应物中的有机溶剂,使产物浓缩;后采用减压抽滤得到粗产品,并分别用水和石油醚洗涤产品(2×10 mL),进一步产品除杂、纯化,后再抽干;待产品干燥后用乙醇-丙酮等体积混合液溶解重结晶提纯得所需产品;真空干燥后称量得浅黄色固体3.25 g,产率85.8%,熔点:87-89oC。1H NMR (CDCl3, 600 MHz, δ/ppm): 3.53-3.54 (m, 2H, COCH2), 4.70-4.71 (m, H, C6H5NH), 5.12-5.15 (m, H, C6H5CHNH), 6.54-6.55 (m, 2H, C6H5), 6.71-6.74 (m, H, C6H5), 7.11-7.14 (m, 2H, C6H5), 7.47-7.49 (m, 2H, C6H5), 7.51-7.59 (m, 2H, C6H5), 7.60-7.68 (m, 2H, C6H5), 7.80-7.83 (m, 2H, C6H5), 7.92-7.93 (m, H, C6H5)。
3)分别取苯乙酮12 mmol(1.443 g)、苯胺10 mmol(0.932 g)、对甲氧基苯甲醛10 mmol(1.361 g),依次加入50 mL圆底烧瓶(内加磁子)中,再加入无水乙醇10 mL并在常温下开始搅拌;紧接迅速加入催化剂SnCl40.156 g(6 mol%),继续搅拌,6小时后才有固体生成;反应8小时后出现大量黄色固体产物,做TLC跟踪反应进程,显示反应尚未完全;继续反应到11小时后显示反应各组分的含量不再变化时,用新配制的6.0%的Na2CO3水溶液滴入反应的圆底烧瓶内,调节反应环境的酸碱度至pH等于7,继续搅拌15分钟;停止搅拌,用旋转蒸发仪除去反应物中的有机溶剂,使产物浓缩;后采用减压抽滤得到粗产品,并分别用水和石油醚洗涤产品(2×10 mL),进一步产品除杂、纯化,后再抽干;待产品干燥后用乙醇-丙酮等体积混合液溶解重结晶提纯得所需产品;真空干燥后称量得暗黄色固体1.50 g,产率45.2%,熔点:140-142oC。1H NMR (CDCl3, 600 MHz, δ/ppm): 3.41-3.53 (m, 2H, COCH2), 3.79 (s, 3H, C6H5OCH3), 4.52-4.53 (m, H, C6H5NH), 4.98-4.99 (m, H, C6H5CHNH), 6.58-6.59 (m, 2H, C6H5), 6.67-6.69 (m, H, C6H5), 6.87-6.88 (m, 2H, C6H5), 7.10-7.13 (m, 2H, C6H5), 7.37-7.38 (m, 2H, C6H5), 7.45-7.48 (m, 2H, C6H5), 7.57-7.59 (m, H, C6H5), 7.92 (m, 2H, C6H5)。
实验相关数据如表3所示。
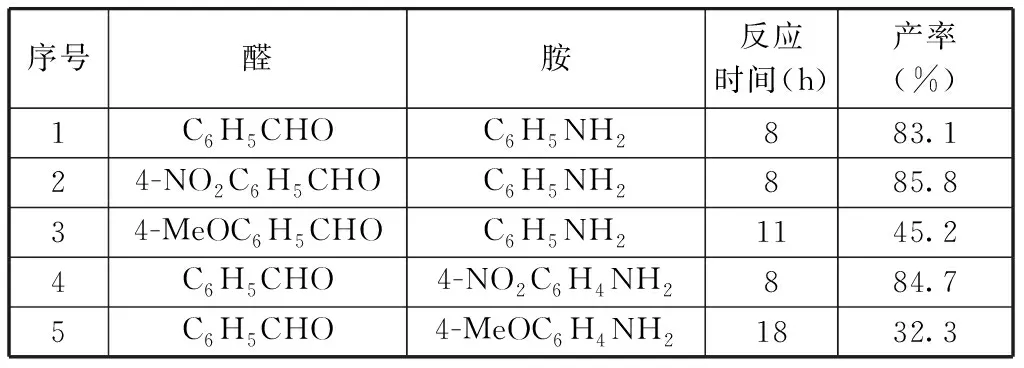
表3 无水SnCl4催化三组分Mannich反应
由上表3可以得出,反应物醛或胺在对位增加硝基取代基后,反应的催化时间不变,但其产率有所提高,说明对位的硝基起到活化醛和胺的作用,有利于Mannich催化反应的进行,最高产率达85.8%(见表3序号2)。当醛或胺在对位连有甲氧基时,Mannich反应的催化反应时间都相应增长,且产率也都有所降低,醛或胺对位上的甲氧基对反应起到钝化作用,不利于Mannich催化反应的进行。
2 结论与展望
本文研究了SnCl4催化酮、胺、醛的三组分“一锅法”Mannich反应,筛选出最佳的催化剂用量、溶剂种类和剂量、温度等条件。然后再利用SnCl4催化各种具有不同取代基官能团的芳香类酮、胺、醛三组分 Mannich 反应。实验证明,芳香胺或醛的对位有硝基取代基时反应时间缩短,产率明显提高。由此可见,SnCl4可以高效地催化芳香类酮、胺、醛三组分 Mannich 反应,对于非芳香类的酮、胺、醛三组分Mannich反应的催化性能有待进一步研究。

