多种植物油中黄酮和角鲨烯分布UPLC研究
罗婷婷,杨 明,熊小平,樊淑宏,毕禄莎,付晓芸,徐小平
(1.四川大学华西药学院,四川 成都 610041;2.四川省体育科学研究所,四川 成都 611731)
0 引 言
黄酮类化合物和角鲨烯是近年来食药领域特别关注的天然组分,其中黄酮类具有2-苯基色原酮结构,广泛分布于植物界中,主要包括黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、查尔酮、异黄酮等。由于其独特的多酚结构,黄酮类化合物具有良好的生理活性,如清除自由基,抗氧化的作用[1]。临床上常用于改善和治疗心血管疾病,降低血脂及胆固醇,抑制血栓等作用[2]。文献表明黄酮类能增强抗生素的抗菌活性[3],抗自由基、提高机体免疫力和阻止脂质过氧化[4-5]。与己烯雌酚结构的相似性使其具有雌性激素样作用,俗称“植物雌激素”,可使甲状腺 C 细胞分泌降钙素的作用加强[6]。由此,食用植物油中的一定含量的黄酮组分将对改善心脑血管疾病和机体的保健具有重要的意义。
角鲨烯是一种高度不饱和的直链三萜烯类化合物,最初是从鲨鱼的肝油中发现的,因此又名为鱼肝油萜、鲨烯、鲨萜,角鲨烯含有 6 个非共轭双键,具有较强的抗氧化活性[7],能够提高体内超氧化物歧化酶(SOD)活性,并具有增强机体免疫能力、改善性功能、抗衰老、抗疲劳、抗肿瘤、抗菌等多种生理功能[8]。角鲨烯能够抑制致癌物亚硝胺的生成,抑制肿瘤细胞的生长,增强机体免疫力,从而增强对肿瘤的抵抗力[9]。将角鲨烯用于化妆品中可以防止皮肤水分散失,抵御紫外线对皮肤造成的伤害[10]。角鲨烯在植物界中分布广泛,主要存在于植物的根、茎、叶和种子等部位,尤其是种子油中,角鲨烯的含量相对较高[11]。
有不少关于植物油中黄酮类化合物和角鲨烯的报道,但大多针对某一特定植物油品的个别指标,而多种植物油中黄酮类或角鲨烯的系统检测尚未见报道。常见的植物油中黄酮的检测方法有UV法、HPLC 法;角鲨烯常用 GC 法[12-15]、GC/MS法[16-21]和HPLC法[22-28]。其中UV法专属性较差,HPLC法分析时间较长。GC法分析角鲨烯的稳定性不如HPLC,为此本文借助UPLC的超高效、高分辨和稳定等特点,以杨梅素、槲皮素、木犀草素、山奈酚、异鼠李素5种常见活性黄酮为目标,拟建立植物油中黄酮定量的UPLC分析法;拟建立皂化前处理植物油后再UPLC法检测角鲨烯分析法。分别对13种植物油中的黄酮和角鲨烯进了分布研究。可为食用植物油的质量监控和油品分级提供黄酮和角鲨烯分析方法和质控依据。
1 仪器与材料
仪器设备与耗材:Acquity超高效液相色谱仪,Acquity UPLC BEH C8色谱柱,Acquity UPLC BEH C18色谱柱(美国Waters公司);XS205电子分析天平(瑞士Mettler Toledo公司);HH数显恒温水浴锅(江苏金坛金城国胜实验仪器厂);移液器(德国Eppendorf公司);涡旋混合器(美国Thermo fisher scientific公司);MTN-2800D氮气吹干仪(天津奥特赛恩斯仪器有限公司);Milli-Q超纯水仪(美国Milli-Q公司);5430离心机(德国Eppendorf公司)。
试剂及材料:角鲨烯(95%,哥伦比亚Matrix Scientific公司);木犀草素,槲皮素,异鼠李素(98%,四川省维克奇生物技术有限公司);山萘酚(98.5%,Chengdu 普思生物),杨梅素 (98%,上海源叶生物科技有限公司);甲醇,正己烷,乙腈(色谱纯,美国Dikma公司);氢氧化钾、磷酸(86%,成都联禾化工医药有限责任公司);小麦胚芽油、橄榄油、青刺果油、火麻籽油、沙棘油、亚麻籽油、牡丹籽油、山茶籽油、葡萄籽油、杏仁油、月见草油、紫苏油、清脉油(均由成都悟道科技有限公司提供)。
2 实验方法
2.1 色谱条件
2.1.1 黄酮类
色谱柱:Acquity UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流动相 A 为甲醇,B 相为 0.8%的磷酸,梯度洗脱条件如表1所示。检测波长:360 nm;流量:0.3 mL/min;柱温:30 ℃;进样量:10 μL。
2.1.2 角鲨烯测定条件
色谱柱:Acquity UPLC BEH C8(2.1 mm×100 mm,1.7 μm);流动相为乙腈-水(97:3),流量为0.25 mL/min;检测波长:210 nm;柱温:30 ℃;进样量:1 μL。
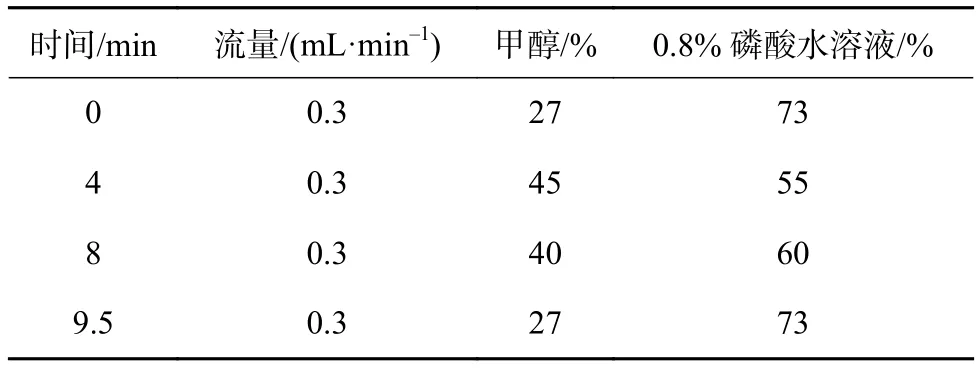
表1 黄酮类物质含量测定流动相梯度程序
2.2 样品前处理
2.2.1 黄酮类
在样品制备中,黄酮类化合物具有难溶于水、易溶于甲醇的理化性质;因具有酚羟基结构而呈酸性,可溶于碱性水液;具有微弱的碱性,可与强无机酸如浓硫酸、盐酸等生成盐,但极不稳定,加水易分解[29-30]。为此,分别从4个方面考察提取净化方法,结果见表2。可以看出甲醇直接萃取效率较弱,正己烷反萃不理想,浓缩后仍然出现残留油迹不易吹干,相比之下,方法4采用70%的甲醇经加热振摇萃取[31-32],离心,上清液挥干,检出效率最高,最后确定为本法的供试品制备方法。

表2 供试品预处理方法的比较
2.2.2 角鲨烯
角鲨烯属于植物油中非皂化部分,因此其提取过程需要皂化。为了考察不同碱液浓度、不同皂化温度以及不同皂化时间对角鲨烯提取效率的影响,以紫苏油为研究对象,设计了关于这3个因素的正交试验,结果表明,最佳皂化条件为:1.5mol/L KOH-C2H6O溶液,于75℃加热30min。
2.3 溶液配制
1)黄酮类化合物对照品溶液的制备:分别称取杨梅素、槲皮素、木犀草素、山奈酚标准品5 mg,溶解于10 mL甲醇中,配制成浓度约为0.5 mg/mL的储备液备用,精密称取异鼠李素5 mg溶于50 mL甲醇中,配制成0.1 mg/mL的储备液备用,用甲醇逐级稀释,得到所需浓度的对照品溶液,置于4 ℃冰箱内保存。对照品色谱图如图1所示。
图1 混合黄酮类物质对照溶液色谱图
2)角鲨烯对照品溶液的制备:称取一定量角鲨烯标准品,用乙腈定容于10 mL容量瓶中,配制成浓度约为0.8 mg/mL的储备液备用,用流动相稀释至所需浓度,放置于4 ℃冰箱内保存,其色谱图如图2所示。
图2 植物油黄酮含量测定色谱图
3)黄酮类供试品溶液的制备:精密称取油样1.5 g,溶于2 mL 70%的甲醇中,75 ℃水浴加热1 h,每10 min振摇一次,取出冷却后,于6000 r/min条件下离心10 min,取上清液1 mL,氮气吹干,用1 mL流动相溶解,0.22 μm膜过滤,待测,其色谱图如图3所示。
图3 角鲨烯对照溶液色谱图
4)角鲨烯供试品溶液的制备:称取0.5 g样品于试管中,加入5 mL KOH-C2H6O溶液,振摇,于一定温度下水浴加热,取出后加入5 mL水,用5 mL正己烷分两次提取,涡旋1 min,静置,取上清液,合并后加入5 mL水,振荡,洗去正己烷中的盐,于6 000 r/min离心6 min,取1 mL上清液,氮气吹干,用1 mL乙腈溶解,0.22 μm膜过滤,待测,其色谱图如图4所示。

图4 13种植物油角鲨烯含量测定色谱图
3 结果与讨论
3.1 专属性试验
3.1.1 黄酮类
分别取空白基质(除不加样品外其过程与样品处理过程相同)以及含有黄酮类物质的4种植物油样品,按照优化的色谱条件进行测定。由黄酮类化合物的专属性测定结果表明,空白基质在主峰位置处不出峰,对本品的含量测定不干扰,如图2所示。
3.1.2 角鲨烯
分别取空白基质(除不加样品外其过程与样品处理过程相同)以及13种植物油样品,按照优化的色谱条件进行测定。由角鲨烯的专属性测定结果表明,空白基质在主峰位置处不出峰,对本品的含量测定不干扰,如前文中图4所示。
3.2 线性范围、检测限与定量限
3.2.1 黄酮类化合物
精密量取杨梅素、槲皮素、木犀草素、山奈酚以及异鼠李素对照品储备液适量,加流动相逐级稀释成浓度分别为 50,100,200,300,500,600 ng/mL的混合黄酮类物质标准系列溶液,经液相色谱测定。以对照品溶液的浓度为横坐标,相应的黄酮主峰的峰面积为纵坐标,进行线性回归,分别得到5个黄酮类化合物的线性方程及其检出限和定量限。结果如表3所示。可以看出在各黄酮的浓度范围内,线性关系良好,检测限在10.1~15.6 ng/mL,定量限在 33.6~48.6 ng/mL。
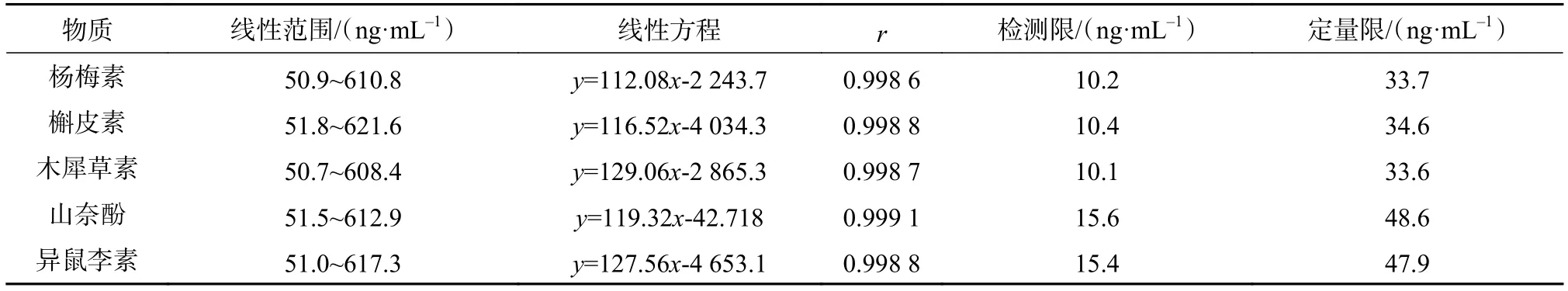
表3 混合黄酮类物质线性方程
3.2.2 角鲨烯
精密量取角鲨烯对照品储备液适量,加流动相逐级稀释为 1,5,10,15,20,100,350 μg/mL 的梯度角鲨烯系列标准溶液,经液相色谱测定,以对照品溶液的浓度为横坐标,相应的角鲨烯主峰峰面积为纵坐标,进行线性回归,得角鲨烯的线性方程,及其检出限和定量限。结果如表4所示。可以看出在各个角鲨烯的浓度范围内,线性关系良好(y=101 350x+445 344,r=0.999 8),检测限 27.3 ng/mL,定量限为81.9 ng/mL。
3.3 回收率试验
3.3.1 黄酮类
黄酮类化合物以不含黄酮的紫苏油为空白,取5种样品9份各1.5 g,均分成3组,分别加入浓度为 600,500,400 μg/mL的 5种黄酮混合对照品溶液,按照2.3的样品溶液制备方法制备,进样测定,结果如表5。由表中回收率试验结果表明,该5种黄酮的平均加样回收率在97.75%~102.2%,表现出良好准确性。
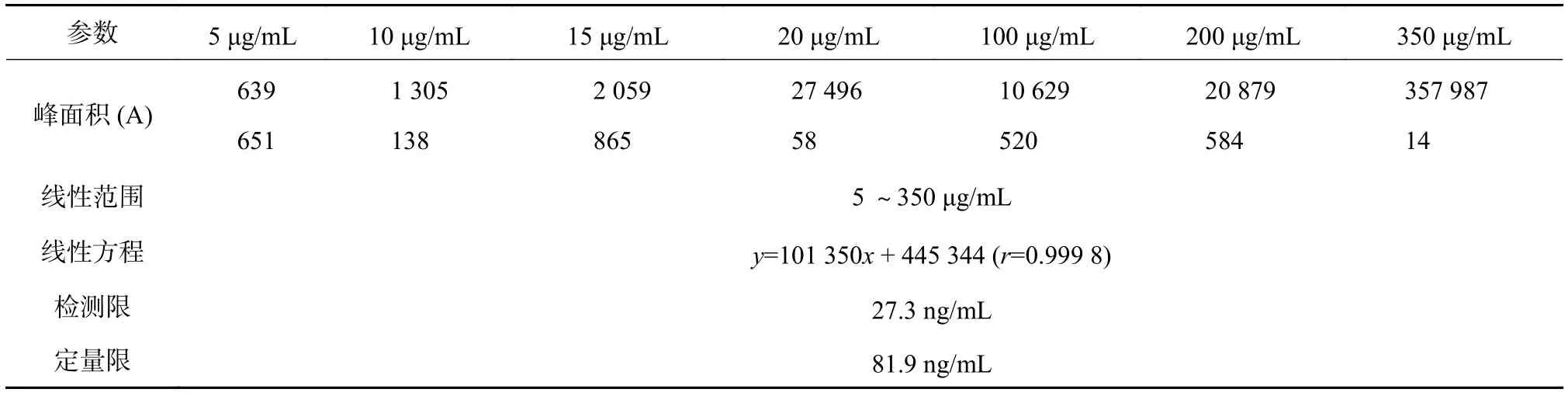
表4 角鲨烯提取正交试验结果
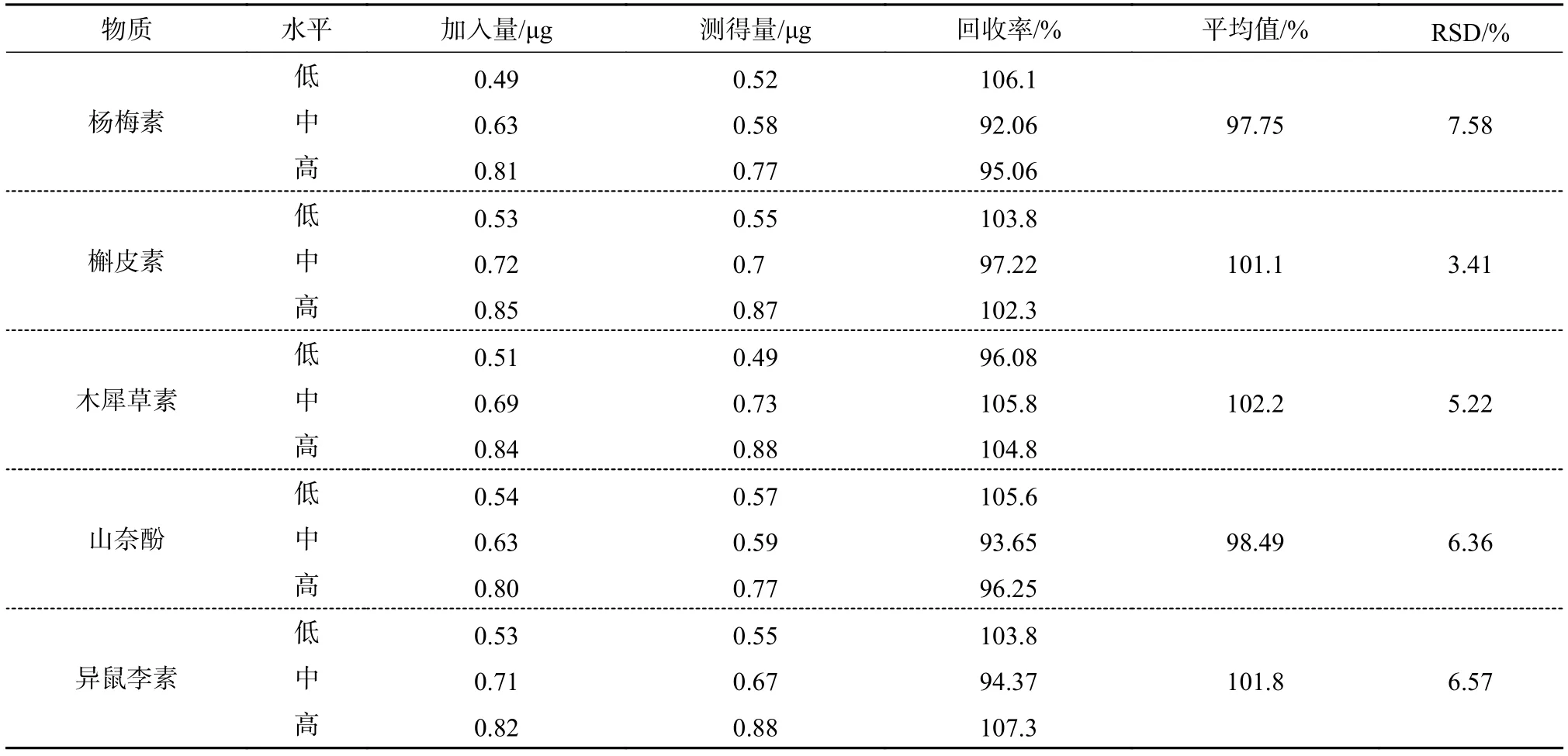
表5 黄酮类物质回收试验结果
3.3.2 角鲨烯
分别精密称取杏仁油(72.12 μg/g)9份各 0.5 g,均分成 3组,分别加入 645,818,980 μg/mL 对照品浓度的角鲨烯对照溶液,按照4.3.2项下条件处理,进样测定,结果如表6。由表中结果表明,角鲨烯的平均加样回收率为88.18%。
3.4 精密度试验
3.4.1 黄酮类
取400 μg/mL的混合黄酮类物质对照品溶液,重复进样6次,以峰面积计算进样精密度;以6份沙棘油分别制成的供试品溶液,重复测定,以各黄酮组分的含量计算得重复性精密度;取上述沙棘油供试品溶液一份,分别由两组人员连续测定6 d,由测得的个黄酮的含量计算中间精密度,结果如表7所示。可以看出进样精密度的RSD为0.86%~1.52%;重复性精密度的RSD为2.79%~7.75%;6 d内的中间精密度RSD为2.25%~14.49%,表现出本方法进样精密度、重复性精密度良好,含量越低,对精密度的影响越明显,其中,中间精密度的杨梅素的精密度较差。
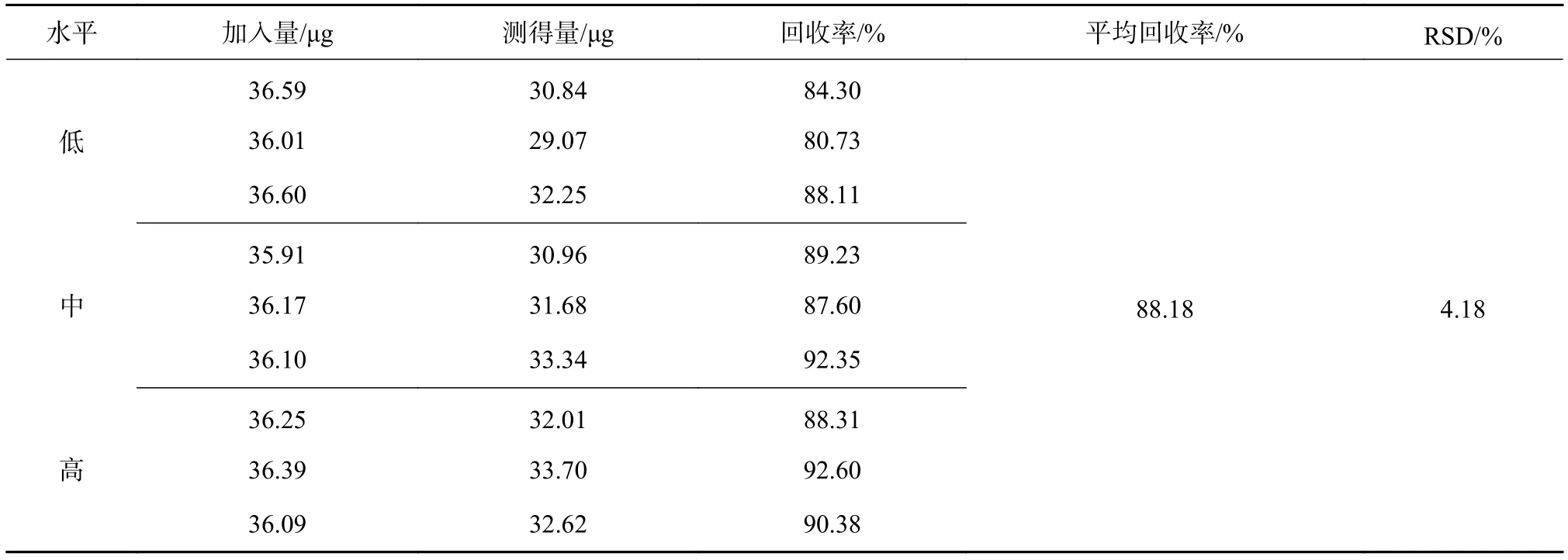
表6 角鲨烯含量测定回收率试验结果
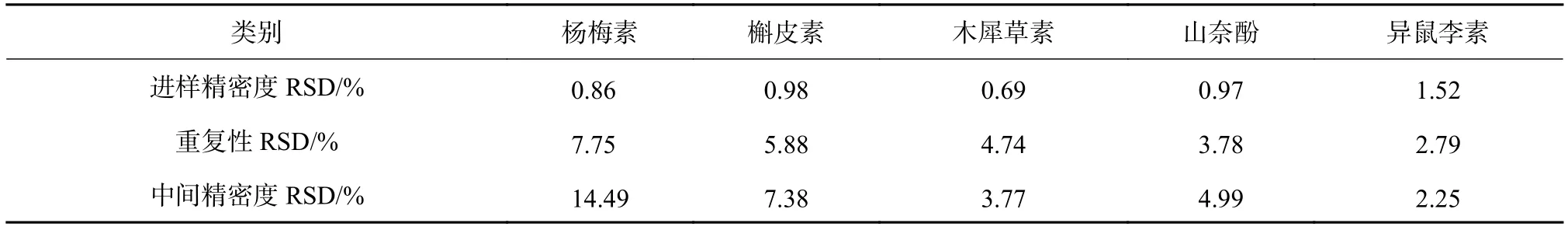
表7 植物油中黄酮检测的精密度试验结果
3.4.2 角鲨烯
取适当浓度的角鲨烯对照品溶液,重复进样6次,以主峰峰面积计算进样精密度;取6份杏仁油分别制成供试品溶液,重复测定,以测定的角鲨烯含量计算重复性精密度;取上述杏仁油供试品溶液一份,分别由两组人员连续测定,以测定角鲨烯的含量计算得中间精密度。由表8可知,进样精密度的RSD为0.2%;重复性和中间精密度的RSD分别为1.96%和3.0%,表现出方法的精密度良好。
3.5 稳定性试验
取沙棘油供试品溶液,分别于 0,1,2,4,8,12,24 h 测定黄酮和角鲨烯的含量,以确定不同时间供试品溶液中黄酮的降解情况。结果表明样品在室温下24 h内稳定。
4 实际样品的测定
4.1 黄酮类
由表9可知,13种植物油中,只有部分检测出黄酮,其中火麻籽油和沙棘油均检测出杨梅素、槲皮素、木犀草素、山奈酚以及异鼠李素这5种黄酮类组分,橄榄油中检出木犀草素和异鼠李素;亚麻籽油中木犀草素和槲皮素;其余小麦胚芽油、青刺果油、牡丹籽油、等9种植物油中未检测到这5种黄酮类组分。这种分布现象提示是否与黄酮的极性较大有关,从而体现出植物油的生产工艺是压榨工艺还是提取工艺,当采用压榨工艺时,黄酮存在可能性较大,而提取型植物油则黄酮因极性影响不易被提取,由此,黄酮的含量或许可以用以区分两种工艺的质控指标。
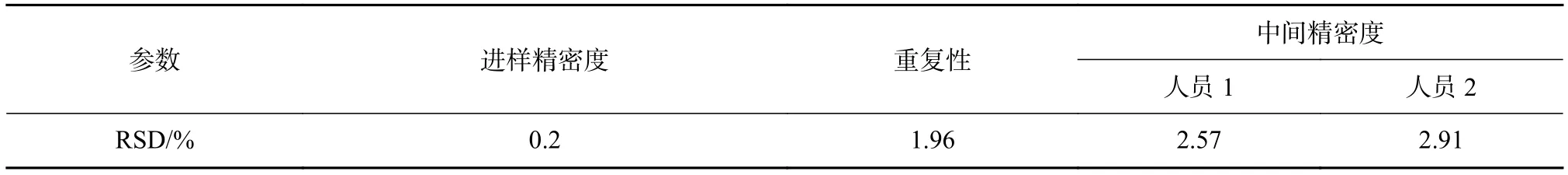
表8 角鲨烯含量测定方法进样精密度、重复性、中间精密度结果试验结果
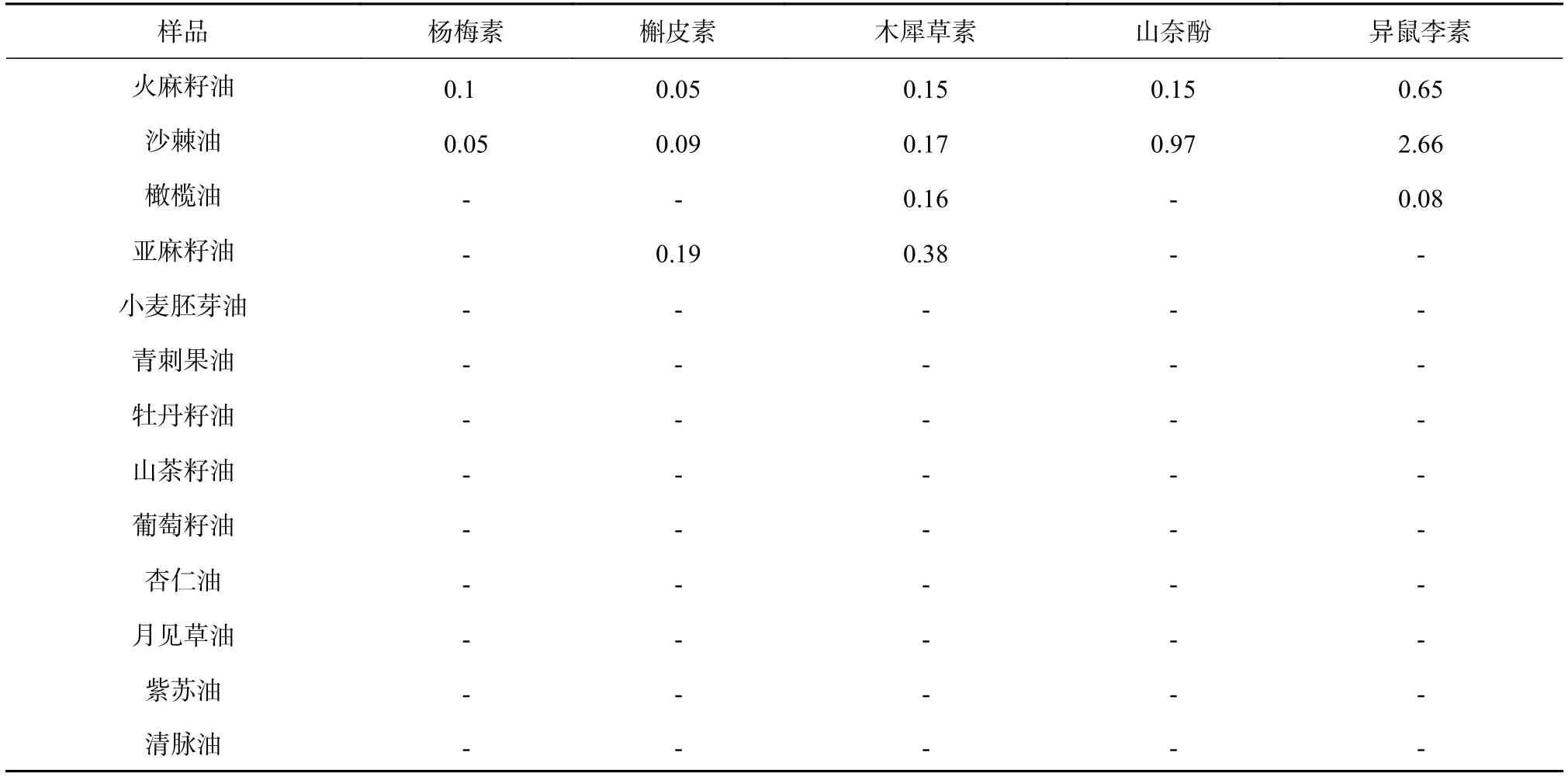
表9 植物油中黄酮类物质含量测定结果1)(n=3) μg/g
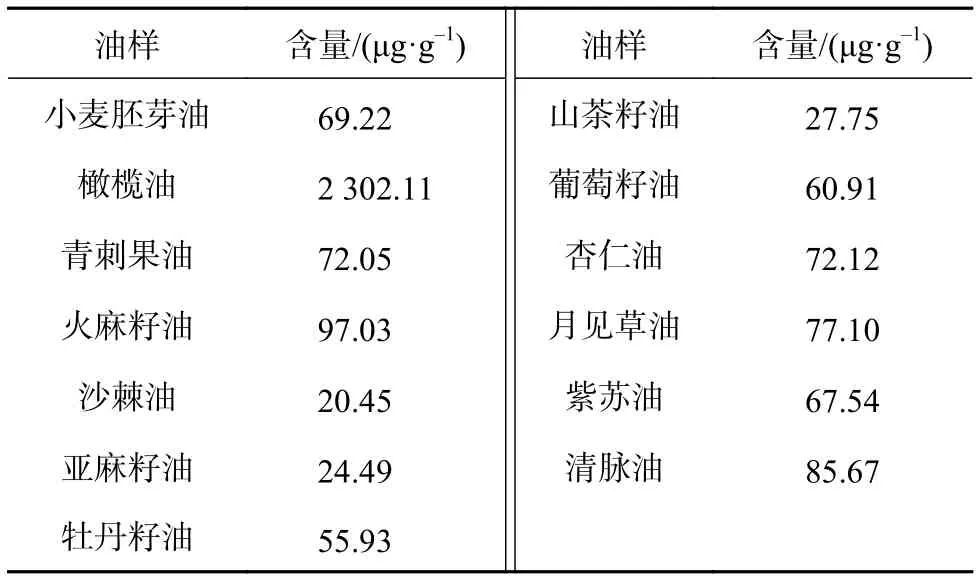
表10 植物油中角鲨烯含量测定结果1)(n=3)
4.2 角鲨烯
植物油中角鲨烯的测定结果如表10所示,大部分植物油中角鲨烯含量相差不大,都不超过100 μg/g。山茶籽油、沙棘油以及亚麻籽油中角鲨烯含量较少,分别只有 27.75 μg/g 、20.45 μg/g 以及 24.49 μg/g。小麦胚芽油、青刺果油、火麻籽油、牡丹籽油、葡萄籽油、杏仁油、月见草油以及紫苏油、清脉油中角鲨烯含量相差不大,为60~100 μg/g。而橄榄油中的角鲨烯含量以远远超出其他植物油的数值高居第一,达到2 302.11 μg/g,是其他植物油中角鲨烯含量的40倍左右。
5 结束语
总之,本文所建UPLC分析为实现多种植物油中的黄酮和角鲨烯的分布情况提供了高效、灵敏、快速的分析方法,为植物油质量的提高提供了一定的方法依据。在所检测的13种食用植物油中,只有火麻籽油和沙棘籽油能正常检出,橄榄油和亚麻籽油检出较少,而其他的油均未检出,甚至清脉油作为其余12种油的混合也没能检测出黄酮类化合物,提示提取油可能是目前的主要工艺。13种食用植物油中所检测的角鲨烯则全部检出,其中橄榄油中的角鲨烯含量尤为高,是其他植物油中角鲨烯含量的40倍左右,沙棘籽油和亚麻籽油中的角鲨烯含量则相对较小,但检出值也相当可观,说明建立的UPLC方法对食用植物油中角鲨烯的检测有效可行。由UPLC对文中黄酮和角鲨烯两种活性成分所建立的检测方法行之有效,也可能适用于植物油中其他重要活性成分的检测。

