贝伐单抗联合亚硝基脲类药物治疗复发高级别胶质瘤的单臂Ⅱ期临床研究
陈迪康,丁骁杰,张振宇,文剑波,耿道颖,姚 瑜
1.复旦大学附属华山医院神经外科,上海 200040;
2.郑州大学第一附属医院神经外科,河南 郑州 450000;
3.复旦大学附属华山医院放射科,上海 200040
瘤具有高侵袭性且预后不良,微血管的级别和数量均与初发或复发GBM的预后相关[3]。复发GBM的治疗手段有限,抗VEGF药物贝伐单抗是常见的挽救治疗用药,且被美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐[4]。亚硝基脲类药物在替莫唑胺(temozolomide,TMZ)成为胶质瘤一线用药前一直是高级别胶质瘤的首选化疗药物[5],目前主要用于胶质瘤进展或复发的患者。国外临床试验表明,贝伐单抗联合伊利替康、洛莫司汀或卡铂可提高部分复发GBM患者的OS,但国内这方面的疗效数据很少。此外,目前仍缺乏可用于提示这类方案对哪一类患者特别有效的肿瘤标志物。因此,我们开展本研究探讨贝伐单抗联合亚硝基脲类药物对复发高级别胶质瘤患者的有效性和安全性,并进一步寻找提示该方案疗效的预测因素。
1 资料和方法
1.1 入组与排除标准
本研究为一项单中心、前瞻性及单臂Ⅱ期的临床研究(编号NCT02698280;复旦大学附属华山医院临床方案KY-2015-289)。入组患者满足以下所有条件:① 胶质瘤患者出现影像学(常规MR增强序列及多体素MRS或PET/CT等)提示肿瘤复发[首次复发或再次复发均可,世界卫生组织(World Health Organization,WHO)Ⅲ~Ⅳ级],病灶直径>10 mm,占据不小于2个层面;② 复发未手术患者,或复发手术后病理证实为高级别胶质瘤,手术结束4周后开始治疗;③ 以往治疗未曾使用贝伐单抗,行基线MRI前7 d内激素用量稳定,诊断为肿瘤复发或进展前3个月内未行放疗,前4周内未行化疗;④ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2分;⑤ 中性粒细胞计数≥1.5×109/L,血小板计数≥100×109/L,血红蛋白≥90 g/L,肝肾功能良好;⑥ 自愿签署知情同意书。如果符合以下任意一项标准,则不能入组本研究:① 收缩压>150 mmHg或舒张压>100 mmHg;② 近6个月内有动脉或静脉血栓史;③ 近期有颅内出血史;④ 有潜在心脏病可能;⑤ 长期服用治疗剂量抗血小板或抗凝药物;⑥研究者认为患者脑瘤病情严重或伴有其他严重内科基础疾病不适合入组(如预计生存期不足2个月);⑦ 其他任何研究者认为不适合入组该研究的情况。
1.2 治疗方案
每6周定义为1个疗程,贝伐单抗每3周静脉滴注1次,每次5 mg/kg,直到影像学提示疾病进展(progression disease,PD);亚硝基脲类药物为ACNU,每6周静脉滴注1次,每次90 mg/m2,最大不超过110 mg/m2。每次使用亚硝基脲类药物前需将血小板调整至100×109/L,中性粒细胞1.5×109/L以上。贝伐单抗剂量调整及停用指征:舒张压>100 mmHg或收缩压>150 mmHg;血小板计数<50×109/L,直到恢复至75×109/L以上再使用贝伐单抗;出现4级非血液性不良反应(如严重出血、过敏反应及蛋白尿等)。当其中1种药物由于不良反应需要停药时,另外1种药物无需停药。当治疗因故推迟4周以上时,患者将被剔除出研究。
1.3 疗效评价与不良反应观察
主要疗效指标为无进展生存期(progressionfree survival,PFS)、6个月无进展生存率(progression-free survival at 6 months,PFS-6)及影像学评价,次要疗效指标为OS。患者每6周行头颅增强MR检查,根据神经肿瘤临床疗效评价(response assessment in neuro-oncology,RANO)标准[6]将影像学反应评估为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和PD。客观缓解率(objective response rate,ORR)为CR和PR患者占所有患者的比例,疾病稳定率为CR、PR和SD患者占所有患者的比例。PFS为入组至出现PD的时间。OS为入组时间至患者死亡或最近1次随访时间。
不良反应监测参考NCI-CTCAE 4.0,评估血液学不良反应(包括血小板、白细胞及红细胞计数)和非血液学不良反应(肝功能、肾功能、血压及蛋白尿)。
1.4 分子标志物检测
对入组患者的肿瘤组织行O6-甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)启动子甲基化、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)及端粒酶逆转录酶(telomerase reverse transcriptase,TERT)启动子状态测序。
1.5 统计学处理
采用SPSS 22.0和GraphPad Prism 7软件进行统计分析和作图。Kaplan-Meier法用于生存时间的对比。Fisher精确检验用于分析ORR的差异。P<0.05为差异有统计学意义。
2 结果
2.1 患者特征
本临床试验于2015年7月—2017年9月共入组23例复发高级别胶质瘤患者,其中2例患者无法评估,1例患者失访,最终对20例患者的治疗结果进行分析(图1)。20例患者的基线信息见表1,中位年龄50岁(24~62岁),男性11例,女性9例,大多数患者在复发时经增强MR及MRS或PET/CT确认为高级别胶质瘤,6例患者再次手术并经病理诊断为GBM(WHO Ⅳ级)或间变型星形细胞瘤(WHO Ⅲ级)。所有患者入组时一般状态良好,卡氏(Karnofsky,KPS)评分60~90分。所有患者中,最终分析时有14例患者界定为PD,5例因各种原因停止使用该方案,1例患者仍在治疗,其PFS达7.6个月。
2.2 治疗效果
中位随访时间为8.2个月(3.2~23.1月),PFS-6达25%,中位PFS为3.7个月(95%CI:1.85~5.55),中位OS为9.2个月(95%CI:7.27~11.13,图2)。所有患者中,6例患者(30%)为PR,9例患者(45%)为SD,5例患者(25%)的最佳反应为PD,没有CR患者。ORR为30%,疾病稳定率达75%。
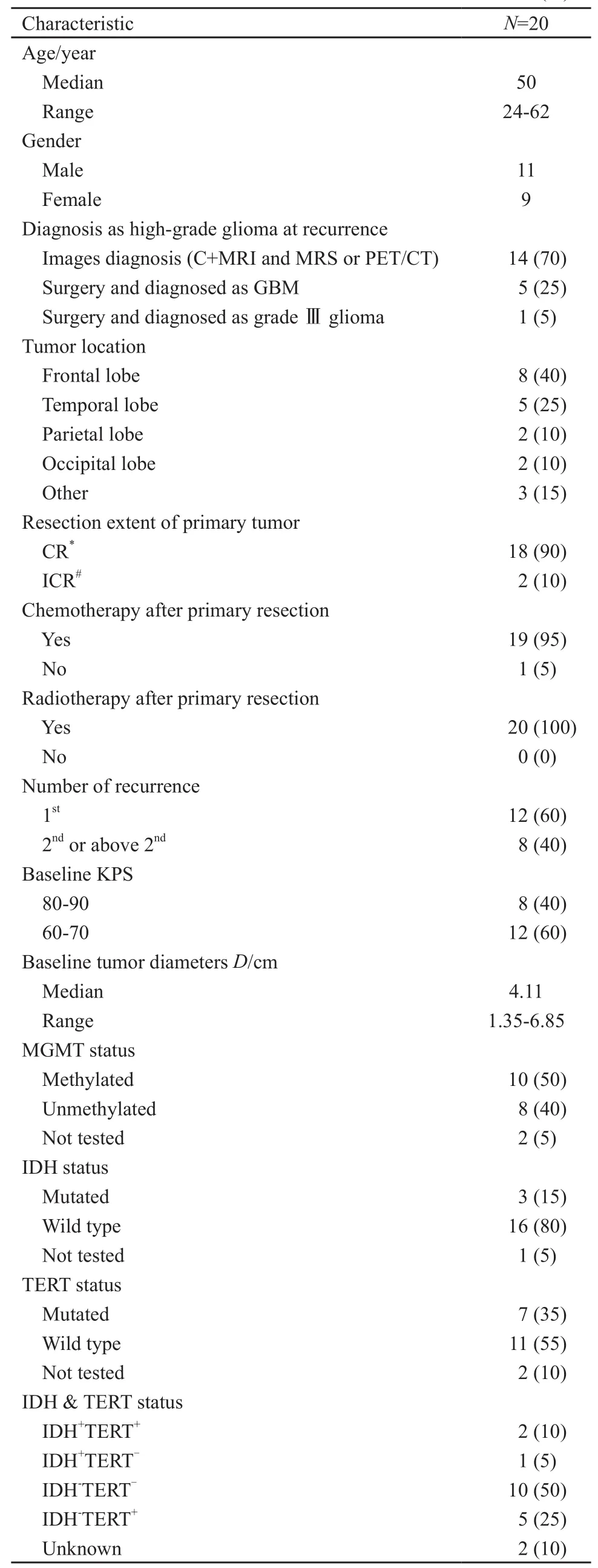
表 1 基线时患者基本临床特征Tab. 1 Patient characteristics at baseline[n (%)]

图 1 入组及随访概况Fig. 1 Overview of enrollment and follow-up
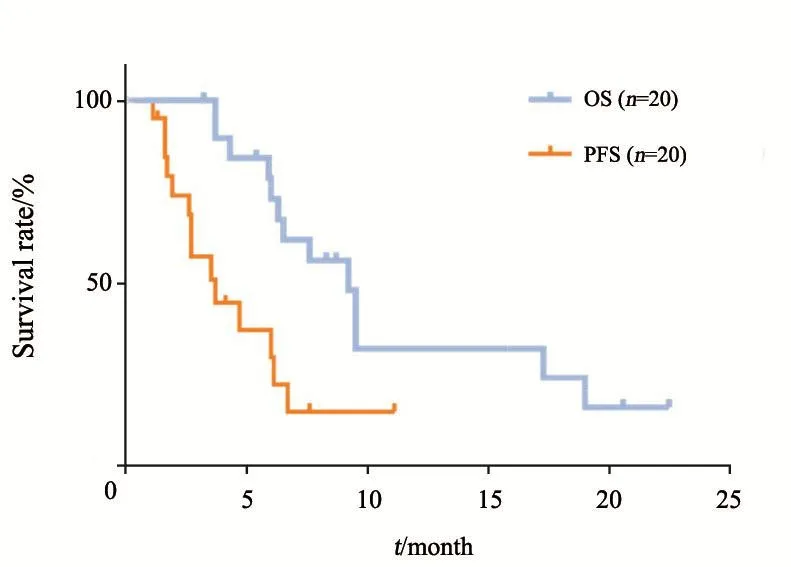
图 2 20例患者的PFS和OS生存曲线Fig. 2 PFS and OS curve for 20 patients treated withbevacizumab+nitrosoureas
2.3 不良反应
治疗相关不良反应见表2,其中血小板减少、乏力和高血压最为常见,但大多数为1级和2级轻度反应,无需临床处理或简单处理即可恢复,不影响治疗。6例患者出现3级或以上的不良反应,其中1例女性患者的血小板降至30×109/L(4级),另1例女性患者评估时发现轻度的颅内血肿(4级),均导致停止治疗,其余经处理后恢复用药。此外,1例男性患者在评估为PD后出现血压高达180/120 mmHg,该不良反应未纳入到最终的不良反应统计中。在所有患者中,未出现贝伐单抗联合亚硝基脲类药物引起的致死事件。
2.4 分子标志物与疗效
大部分临床试验患者进行了分子病理检测,可分析者包括:MGMT启动子甲基化10例,未甲基化8例;IDH野生型(IDH wild type,IDH WT)16例,突变型(IDH mutation,IDH MUT)3例;TERT启动子突变型(TERT promoter mutation,TERTp MUT)7例,野生型(TERT promoter wild type,TERTp WT)11例;IDH/TERT四分型中IDH WT/TERT MUT 5例,IDH WT/TERT WT 10例。分析不同分子标志物状态下生存期和影像学评价的差异,结果显示,TERT WT患者的PFS优于TERT MUT(6.0个月 vs 1.9个月,P=0.02),而OS无明显差异(图3)。MGMT启动子甲基化状态、IDH突变状态及IDH/TERT分型,对试验患者的PFS和OS均无预测作用,但IDH WT/TERT WT的PFS较IDH WT/TERT MUT具有更好的趋势(P=0.06)。影像学评价方面,MGMT启动子甲基化状态、IDH状态、TERT启动子状态和IDH/TERT分型对ORR的影响差异均无统计学意义,但MGMT启动子甲基化患者的ORR较非甲基化具有更好的趋势(30.0% vs 12.5%,P=0.18),TERT WT较TERT MUT的ORR也具有更好的趋势(36.3% vs 14.2%,P=0.32)。
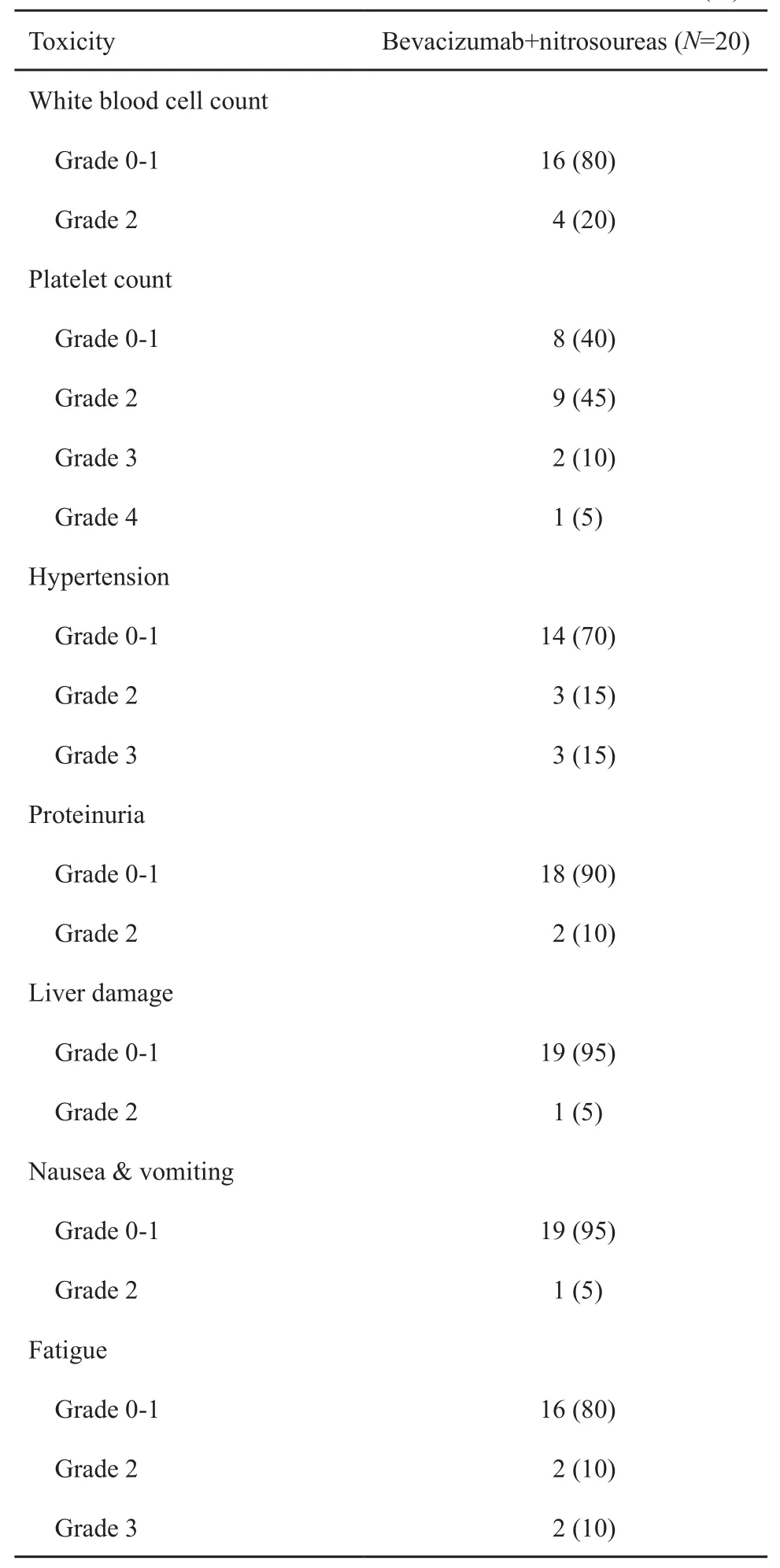
表 2 不良反应Tab. 2 Adverse events[n (%)]
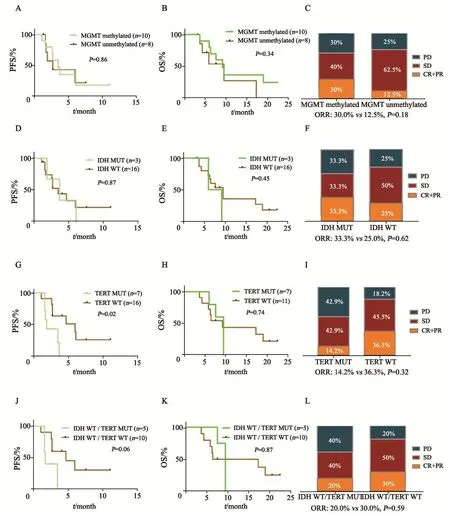
图 3 分子标志物对预后和影像学评价的影响Fig. 3 The impact of molecular biomarkers on prognosis and radiological responses A, B, C: Kaplan-Meier survival analysis and radiological responses of MGMT methylated and unmethylated status; D, E, F: Kaplan–Meier survival analysis and radiological responses of IDH MUT and IDH WT; G, H, I: Kaplan–Meier survival analysis and radiological responses of TERT promoter status; J, K, L: Kaplan–Meier survival analysis and radiological responses of IDH WT/TERT MUT and IDH WT/TERT WT subgroups
3 讨论
贝伐单抗可以抑制负责调节血管形成和新生血管生成的VEGF-A从而抑制肿瘤生长,同时介导肿瘤血管正常化、降低血管的通透性。这一过程可以促进细胞毒性的化疗药物进入肿瘤区域增加化疗效果,这可能是本试验贝伐单抗联合亚硝基脲类药物治疗患者的理论基础。
贝伐单抗早在2009年被美国食品药品管理局(Food and Drug Administration,FDA)批准用于复发GBM。最早期,一项21例复发高级别胶质瘤患者的贝伐单抗联合伊利替康挽救性治疗中,9例(42.8%)患者为PR,11例为SD[7]。基于这个可观的治疗效果,Vredenburgh等[1-2]针对复发高级别胶质瘤开展了贝伐单抗联合伊利替康非随机单臂Ⅱ期临床试验,患者的ORR约60%,GBM和高级别胶质瘤的PFS-6分别达46%和38%。Friedman等[8]开展的贝伐单抗单药对比贝伐单抗联合CPT-11治疗复发GBM的Ⅱ期试验(BRIAN试验)中,ORR分别为28.2%和37.8%,PFS-6达42.6%和50.3%,而中位OS为9.2和8.7个月。后续一些大型临床试验进一步研究了贝伐单抗联合传统化疗药物治疗复发GBM的疗效。Taal等[9]的BELOB Ⅱ期临床试验表明,贝伐单抗单药、洛莫司汀单药及贝伐单抗联合洛莫司汀(90 mg/m2)的影像学ORR分别为38%、5%及34%,PFS-6达16%、13%及41%,中位OS为8、8及11个月。尽管联合用药时洛莫司汀用量为110 mg/m2的情况下生存数据明显提高,但由于不良反应较大而不予以采纳。上述研究提示,联合用药有利于提高复发GBM患者的PFS,并可部分提高患者的OS。Field等[10]对比了贝伐单抗单药和贝伐单抗联合卡铂的效果,ORR分别为6%和14%,PFS-6为18%和15%,中位OS为7.5和6.9个月,该联合用药方案对ORR有所提高,对PFS和OS均无改善作用。2018年《中国中枢神经系统胶质瘤免疫和靶向治疗专家共识》[11]指出,复发GBM推荐使用贝伐单抗,可联用洛莫司汀、伊利替康或TMZ。本研究方案的ORR和PFS-6处于居中水平,低于贝伐单抗联合洛莫司汀或伊利替康,高于联合卡铂方案,OS水平也与上述方案相近,可成为复发高级别胶质瘤患者的用药选择之一。
本方案所出现的不良反应中,血小板下降主要由亚硝基脲类药物对骨髓的抑制所致,但并未增加贝伐单抗所致的出血风险,其中1例颅内轻度出血患者的血小板计数为正常水平。3级及以上的高血压占15%,较BELOB试验的25%~38%低,可能由于本试验所用贝伐单抗剂量为每3周5 mg/kg,低于国外的每2周10 mg/kg。
目前,预测疗效的分子标志物主要应用于传统化疗,如MGMT启动子甲基化提示TMZ化疗的敏感性。而提示贝伐单抗对复发GBM疗效的指标仍不成熟,最近Ellingson等[12]的研究表明,弥散MRI ADCL是复发GBM患者OS的独立预测影像学标志物。BELOB试验指出,MGMT启动子甲基化及IDH MU患者具有更长的OS和PFS,这两个指标本身也是GBM预后较好的标志物,本研究的差异无统计学意义可能是由于样本量较少产生的偏倚。BELOB试验未曾分析TERT对预后的影响,本研究得出,TERTp WT患者的PFS更优,且趋于更好的ORR。这其中的部分原因可能是TERTp WT本身提示预后较好[13-14],同时基础研究也表明,TERT的表达不利于抗VEGF治疗。TERT可激活VEGF通路,具有促血管生成的作用[15],一项肠癌的研究也表明,贝伐单抗可通过TERT再次激活血管生成,共同阻断VEGF和TERT更有利于抗肿瘤效应[16]。因此,若TERT启动子本身处于非活跃状态即TERT WT,抗VEGF治疗可能更加有效,与本研究结果相符。
综上所述,贝伐单抗联合亚硝基脲类药物治疗复发高级别胶质瘤有效且安全,TERTp WT提示更长的PFS。MGMT启动子甲基化和TERTp WT的ORR具有更好的趋势。

