脑脊液D-二聚体评估胶质瘤脑室侵犯和脊髓播散的临床意义
陈建新,康 勋,李 岩,李 珊,康 庄,李文斌
1.首都医科大学附属北京世纪坛医院脑胶质瘤科,北京 100038;
2.首都医科大学附属北京天坛医院神经肿瘤综合治疗科,北京 100050
D-二聚体(D-dimer)是凝血-纤溶系统激活后,纤维蛋白和纤维蛋白原的降解产物之一,是反映体内纤溶活性的标志物,血浆D-二聚体升高常发生于静脉血栓形成、手术、感染、高凝血状态和出血的患者中。多项文献报道,多种实体肿瘤患者出现血浆D-二聚体水平升高,并与肿瘤生长、转移和预后有关,但实际临床意义仍在研究中[1-4]。胶质瘤是最常见的原发中枢神经系统肿瘤,我们在临床工作中发现部分胶质瘤患者脑脊液中D-二聚体水平显著升高,而临床尚未见相关报道。本研究从2013年10月开始检测首都医科大学附属北京世纪坛医院住院胶质瘤患者的脑脊液和血浆D-二聚体,回顾性评价脑脊液和血浆中D-二聚体在胶质瘤中的意义。
1 资料和方法
1.1 一般资料
汇集2013年10月—2016年12月首都医科大学附属北京世纪坛医院住院能够配合接受腰椎穿刺检查或已放置OMMAYA囊的83例胶质瘤患者,男性60例,女性23例,平均年龄45岁(9~72岁),诊断标准采用2007年世界卫生组织(World Health Organization,WHO)中枢神经系统肿瘤分类诊断标准[5],所有患者均有明确病理诊断报告,复发患者诊断标准采用神经肿瘤疗效评价(Response Assessment in Neuro-Oncology,RANO)标准[6],磁共振影像学评估至少包括含有轴位的2个断层方向。根据胶质瘤是否复发分为未复发组15例和复发组68例,未复发患者为颅内或脊髓胶质瘤经过初次肿瘤切除术或活检术,同步放化疗后,替莫唑胺胶囊5/28方案辅助治疗期间无肿瘤进展的患者。根据磁共振成像显示胶质瘤病变范围将患者分为3组:脑实质组(35例)为增强病灶完全位于脑实质内的患者,没有脑室和脊髓侵犯;脑室侵犯(ventricular metastasis,VM)组(26例)为增强病灶侵犯脑实质和脑室系统,尚未发生脊髓播散(spinal cord metastasis,SCM)的患者;SCM组(22例)为脊髓磁共振成像显示肿瘤发生SCM,无论原发病灶是否有进展的患者。根据初发病灶是否原发于脊髓又将SCM组分为原发脊髓播散(primary spinal cord metastasis,PSCM)组(4例)和继发脊髓播散(secondary spinal cord metastasis,SSCM)组(18例)。存在以下情况的患者不能入组:手术后1个月内、同步放化疗期间、肝功能异常、存在静脉血栓、接受抗凝治疗、活动性出血及影像学考虑假性进展和放射性坏死的患者。根据病理报告其类型包括胶质母细胞瘤37例,间变性星形细胞瘤(anaplastic astrocytoma,AA)19例,间变性少突星形细胞瘤(anaplastic oligoastrocytoma,AOA)11例和星形细胞瘤16例;根据肿瘤恶性程度分级为Ⅱ、Ⅲ及Ⅳ级的患者分别为16、30及37例;18例SSCM患者包括Ⅱ级3例、Ⅲ级7例及Ⅳ级8例,4例PSCM患者包括Ⅱ级3例、Ⅲ级1例。对照组为其他脑肿瘤患者17例,包括髓母细胞瘤10例、室管膜瘤3例和原发中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)4例,平均年龄37岁(15~65岁),男性11例,女性6例。所有患者均在同1天采集脑脊液和外周血进行D-二聚体水平检测。
1.2 治疗方法
未复发患者继续替莫唑胺胶囊5/28方案辅助化疗;复发进展患者评估再手术、同步放化疗和替莫唑胺胶囊辅助治疗,VM和SCM不能手术及放疗者或替莫唑胺耐药者给予其他方案联合化疗,联合化疗方案包括顺铂联合替莫唑胺、顺铂联合替尼泊苷、顺铂联合依托泊苷、卡铂联合依托泊苷及替莫唑胺隔周方案等化疗方案,治疗2个周期通过磁共振影像学评估疗效,有效者继续维持治疗至少5~6个周期,无效者更换其他化疗方案,化疗前采集脑脊液和外周血进行D-二聚体检测。VM组和SCM组患者给予化疗同时联合甲氨蝶呤10 mg鞘内注射治疗,治疗期每周1~2次,维持期每个月1~2次,出现白细胞或血小板计数Ⅱ度骨髓抑制时暂停甲氨蝶呤鞘内注射治疗。54例患者接受腰椎穿刺,其中19例VM和SCM患者接受甲氨蝶呤鞘内注射治疗,29例患者放置OMMAYA囊后行甲氨蝶呤鞘内注射治疗。
1.3 仪器和方法
二聚体检测:使用ACL TOP700全自动血凝仪测量D-dimer。血浆样本使用含有枸橼酸钠的真空采血管采集外周血4 mL,采血1 h内进行检测,3 000 r/min离心15 min后上清液经ACL TOP700全自动血凝测量;脑脊液样本使用无菌试管采集脑脊液2 mL,立刻送检,2 000 r/min离心5 min后上清液经ACL TOP700全自动血凝测量,首都医科大学附属北京世纪坛医院的血浆D-dimer标准正常值为≤243 ng/mL。
1.4 统计学处理
资料分析采用SPSS 13.0软件分析,计量资料以中位数表示,采用Kruskal-Wallis H test进行方差分析,两两比较采用Unpaired Welch’s correction秩和检验、Mann Whitney检验。受试者工作特征(receiver operating characteristic,ROC)曲线用于评估D-二聚体水平预测胶质瘤VM和SCM的可能性,P<0.05为差异有统计学意义。
2 结果
2.1 患者一般特点
83例胶质瘤和17例其他脑肿瘤患者的临床特征见表1~2。
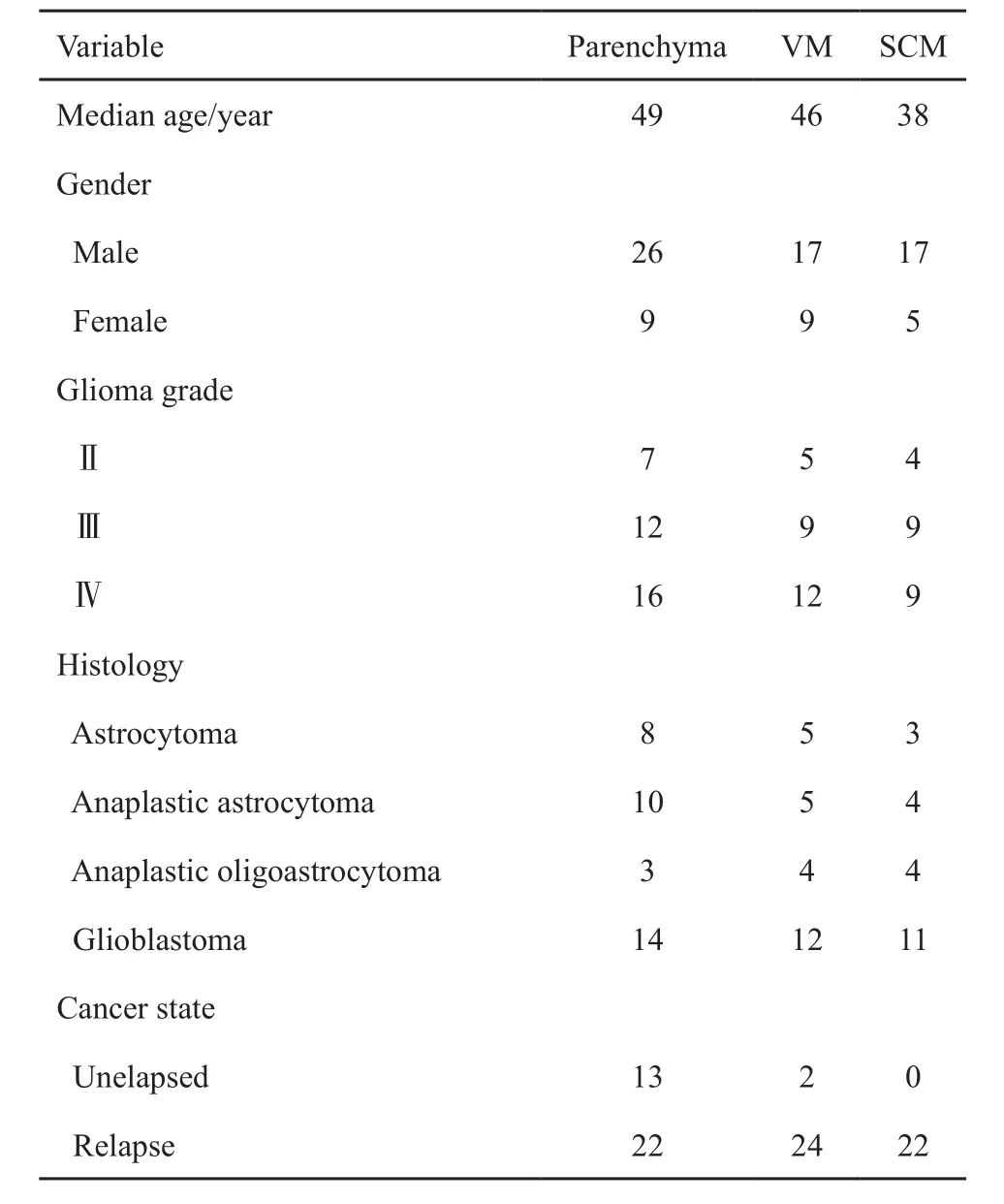
表 1 83例胶质瘤患者的临床特征Tab. 1 Clinical characters of 83 glioma patients(n)

表 2 17例其他脑肿瘤患者的临床特征Tab. 2 Clinical characters of 17 patients with other brain cancer(n)
2.2 未复发组和复发组患者脑脊液和血浆D-二聚体水平
对照组、未复发组和复发组脑脊液D-二聚体中位数分别为27、89和1 823 ng/mL,脑脊液D-二聚体复发组显著高于未复发组和对照组。血浆D-二聚体中位数分别为102、119和163 ng/mL,复发组血浆D-二聚体显著高于对照组,但与未复发组比较差异无统计学意义。脑脊液和血浆D-二聚体未复发组与对照组差异无统计学意义(图1~2)。

图 1 对照组、未复发组和复发组脑脊液D-二聚体水平Fig. 1 Cerebrospinal fluid D-dimer levels of control, unrelapsed and relapse groups
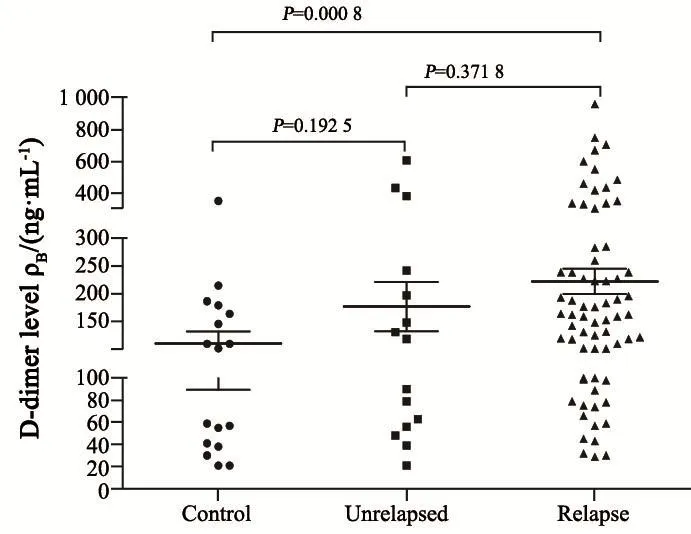
图 2 对照组、未复发组和复发组血浆D-二聚体水平Fig. 2 Plasma D-dimer levels of control, unrelapsed and relapse groups
2.3 脑实质组、VM组和SCM组脑脊液和血浆D-二聚体水平
对照组、脑实质组、VM组和SCM组脑脊液D-二聚体中位数分别为27、190、1 910和10 117 ng/mL,各组间脑脊液D-二聚体水平比较差异有统计学意义。各组血浆D-二聚体中位数分别为102、102、189和264 ng/mL。血浆D-二聚体水平SCM组和VM组与其他各组差异有统计学意义,脑实质组与对照组差异无统计学意义(图3~4)。

图 3 对照组、脑实质组、VM组和SCM组脑脊液D-二聚体水平Fig. 3 Cerebrospinal fluid D-dimer levels of control, parenchyma,VM and SCM groups
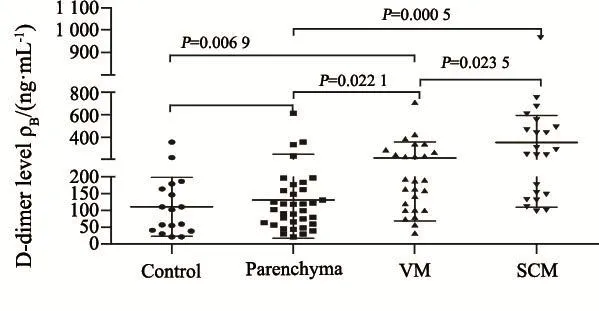
图 4 对照组、脑实质组、VM组和SCM组血浆D-二聚体水平Fig. 4 Plasma D-dimer levels of control, parenchyma, VM and SCM groups
2.4 PSCM组和SSCM组患者脑脊液和血浆D-二聚体水平
对照组、PSCM组和SSCM组患者脑脊液D-二聚体中位数分别为27、5 811及11 609 ng/ mL;SSCM组患者脑脊液D-二聚体水平显著高于PSCM组和对照组。血浆D-二聚体中位数分别为102、132和239 ng/mL。SSCM组患者血浆D-二聚体水平显著高于对照组,但与PSCM组比较差异无统计学意义(图5~6)。
2.5 脑胶质瘤患者脑脊液和血浆D-二聚体水平的ROC曲线
脑胶质瘤患者脑脊液和血浆D-二聚体水平的ROC曲线的曲线下面积(area under curve,AUC)分别为0.932 7(P<0.000 1,95%CI:0.88~0.98)和0.698 1(P<0.010 3,95%CI:0.56~0.83),脑脊液和血浆D-二聚体水平截断值分别为69和219 ng/mL,灵敏度和特异度分别为86.75%、94.12%和34.94%、94.12%(图7~8)。
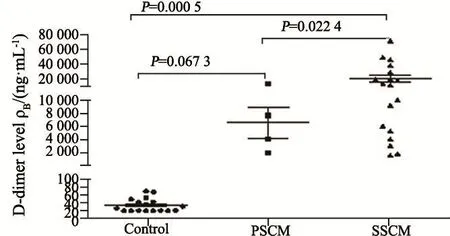
图 5 PSCM组和SSCM组脑脊液D-二聚体水平Fig. 5 Cerebrospinal fluid D-dimer levels of PSCM and SSCM groups
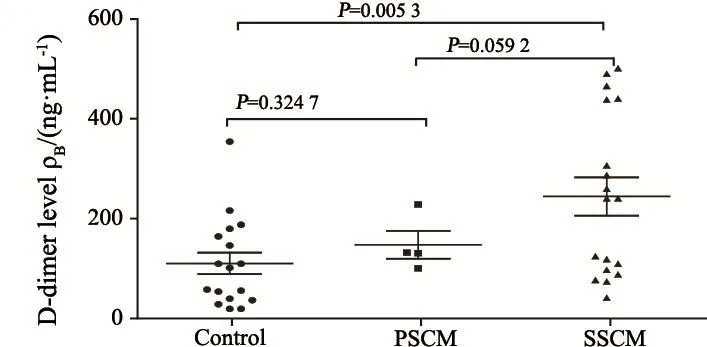
图 6 PSCM组和SSCM组血浆D-二聚体水平Fig. 6 Plasma D-dimer levels of PSCM and SSCM groups

图 7 脑脊液D-二聚体水平ROC曲线Fig. 7 ROC curve of cerebrospinal fluid D-dimer for glioma
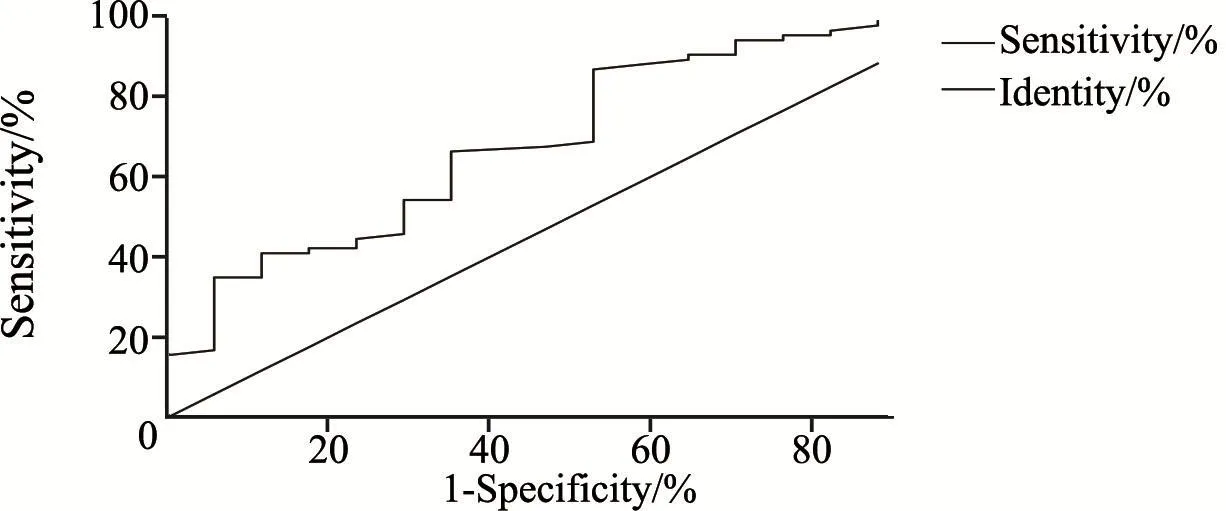
图 8 血浆D-二聚体水平的ROC曲线Fig. 8 ROC curve of plasma D-dimer for glioma
2.6 VM组和SCM组治疗前后脑脊液和血浆D-二聚体变化
VM组和SCM组患者给予全身化疗联合鞘内注射治疗5~6个周期后,脑脊液D-二聚体中位数分别为836和3 551 ng/mL,与治疗前(1 910和10 117 ng/mL)相比,脑脊液D-二聚体水平的下降差异有统计学意义;血浆D-二聚体中位数分别为138和182 ng/mL,与治疗前(189和264 ng/mL)相比,血浆D-二聚体水平变化差异无统计学意义(图9~10)。
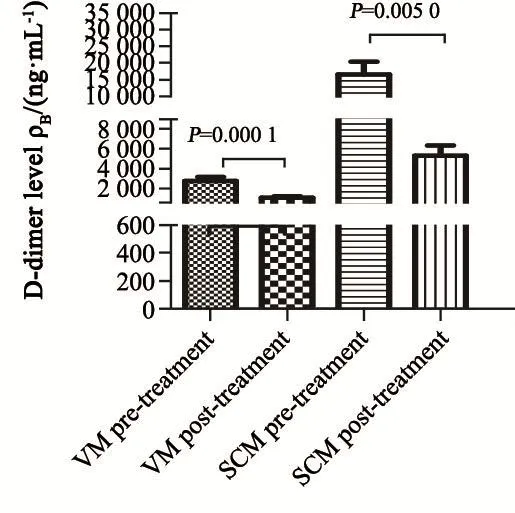
图 9 VM组和SCM组治疗前后脑脊液D-二聚体变化Fig. 9 Cerebrospinal fluid D-dimer levels of VM and SCMpatients before and after treatment
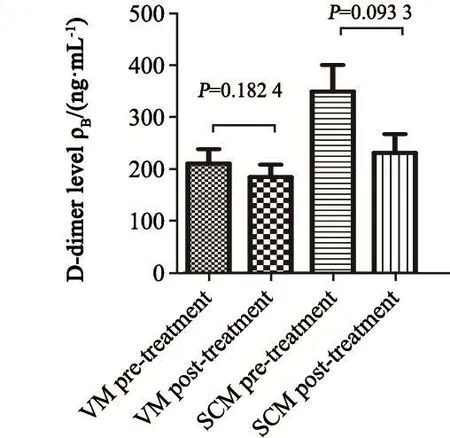
图 10 VM组和SCM组治疗前后血浆D-二聚体变化Fig. 10 Plasma D-dimer levels of VM and SCM patients before and after treatment
3 讨论
胶质瘤是原发于中枢神经系统的侵袭性肿瘤,几乎所有患者最终复发进展和转移,死亡率高,生存期短。目前主要的治疗方式包括手术切除、放疗及替莫唑胺辅助化疗等综合治疗[7-8]。胶质瘤VM和SCM是胶质瘤复发转移的一种形式,绝大多数发生于病程晚期,少数可发生于病程早中期,不同级别胶质瘤发生VM和SCM后生存期截然不同,目前尚无有效治疗手段。全脊髓磁共振检查是目前诊断胶质瘤SCM的唯一有效影像学方法,但磁共振检查价格昂贵,对VM和SCM的程度和范围不能量化评估且易误诊,寻找早期、有效、可量化及特异性强的诊断胶质瘤VM和SCM的方法非常重要,尤其是早期发现和诊断胶质瘤SCM对评估预后、控制肿瘤进展和延长生存期有重要意义。
Can等[9]报道,胶质瘤患者向高级别转变过程中,血浆纤维蛋白降解产物浓度也逐渐增加,当截断值为0.5 μg/mL时,其灵敏度和特异度分别为76%和85%,认为血浆纤维蛋白降解产物可以作为胶质瘤具有一定敏感性但非特异性的筛选工具。Sciacca等[10]在高级别胶质瘤(AA/GBM)患者血栓相关遗传多态性和血浆标志物的研究中发现,D-二聚体、血管内皮生长因子、脂蛋白A、同型半胱氨酸及纤溶酶原激活剂等与凝血和纤溶相关的因子水平升高,能够促进血栓形成和肿瘤进展复发。Diao等[11]报道,血浆D-二聚体可以作为预测肿瘤转移的诊断工具,1 123例消化系统肿瘤患者中出现血浆D-二聚体水平升高者肿瘤远处转移发生率增高,复发率增高,生存期缩短。但胶质瘤患者脑脊液D-二聚体水平与胶质瘤进展转移的相关性研究迄今未见报道。本研究显示,胶质瘤患者脑脊液D-二聚体水平在复发组显著高于未复发组,VM组和SCM组显著高于脑实质组,SSCM组显著高于PSCM组,VM组和SCM组脑脊液D-二聚体水平呈现几十倍到数百倍的升高,恶性级别和浸润程度不同的患者之间脑脊液D-二聚体浓度差异巨大,而未复发组和脑实质组脑脊液D-二聚体未见明显升高,提示脑脊液D-二聚体升高能够较准确地反映胶质瘤发生VM和SCM,其升高幅度不但与胶质瘤VM和SCM关系密切,也与胶质瘤的级别、播散范围和浸润程度有关。肿瘤级别越高,播散范围越大,播散病程越长,结节状病灶越多,脑脊液D-二聚体升高越明显,我们考虑脑脊液D-二聚体升高可能是胶质瘤发生VM和SCM的一个显著临床特点。
中枢神经系统和脑脊液循环都是相对独立封闭的环境,脉络膜每天生成脑脊液400~500 mL,更新需6~8 h,而D-二聚体半衰期大约6 h,VM组和SCM组患者脑脊液D-二聚体持续大量存在,其浓度远高于血浆D-二聚体,同时患者没有血栓形成、感染及出血等病理状态,说明脑脊液D-二聚体显著升高是胶质瘤VM和SCM的结果,而不是胶质瘤破坏血脑屏障后发生渗漏的结果,也与患者外周血凝血系统无关,胶质瘤发生VM和SCM导致脑脊液D-二聚体升高的机制值得深入研究,有助于阐明凝血和纤溶系统在胶质瘤转移复发中的作用。Hoke等[12]报道,23例血浆D-二聚体升高的胶质母细胞瘤患者伴有肿瘤进展和死亡率升高,无进展生存期缩短。部分研究显示,肿瘤细胞包括胶质瘤能够通过表达组织因子促进肿瘤细胞生长转移,促进肿瘤血管新生,促进纤维蛋白附着于肿瘤细胞,使肿瘤细胞易于在微血管中被俘获,从而发生远端血管转移,凝血系统激活的程度和持续时间与肿瘤进展和预后差显著相关[13-14],提示血浆D-二聚体升高与胶质瘤进展转移密切相关,但本研究显示,VM组和SCM组血浆D-二聚体没有明显升高,与其他文献报道不一致,可能与患者选择差异有关。但VM组和SCM组引起脑脊液D-二聚体显著升高的机制仍不能完全解释,SCM是高级别胶质瘤终末期阶段之一,预后极差,其发生可能与胶质瘤细胞表达某些肿瘤生长浸润相关的因子受体有关,如血管内皮生长因子、基质金属蛋白酶和表皮生长因子受体等,肿瘤浸润部位破坏脑脊膜,侵蚀血管,暴露组织因子,局部激活凝血因子等分子,生成D-二聚体,并直接释放入脑脊液。
星形细胞瘤与少突胶质细胞瘤相比更具侵袭性和向高级别胶质瘤进展的倾向,本研究发现,除胶质母细胞瘤外,病理诊断中含有星形细胞瘤成分的胶质瘤更具有发生VM和SCM的倾向,少突胶质细胞瘤很少发生SCM,而高级别胶质瘤发生SCM后进展更快,生存期短;低级别星形细胞瘤发生SCM后进展缓慢,病程仍较长,提示脑脊液D-二聚体升高与胶质母细胞瘤或星形细胞瘤的分子表型和侵袭性有关。而原发于脊髓的低级别星形细胞瘤或间变型星形细胞瘤患者在手术后短期发生SCM,也伴有脑脊液D-二聚体明显升高,除部分患者脊髓广泛播散与星形细胞瘤发生肿瘤细胞脱落和种植有关外,可能也与胶质瘤细胞浸润性高有关,同时脑脊液D-二聚体升高也可能进一步促进胶质瘤细胞在脊髓表面定植、浸润和生长。虽然对照组中初发室管膜瘤的肿瘤负荷较小,髓母细胞瘤和原始中枢神经系统淋巴瘤呈浸润性生长时,脑脊液D-二聚体水平均低于血浆正常标准参考值,甚至髓母细胞瘤发生脑室多发侵犯时脑脊液D-二聚体也未见升高,提示脑脊液D-二聚体升高可能与脑肿瘤类型有关,脑脊液D-二聚体升高能够较特异地反映胶质瘤发生VM和SCM,进一步研究胶质瘤SCM引起脑脊液D-二聚体升高的分子机制,将有助于预防胶质瘤SCM,制定合理治疗措施,改善患者生存质量和预后。
鉴于脑脊液蛋白组学研究没有发现较好的早期预测胶质瘤和胶质瘤SCM的相关生物标志物[15],为此我们进一步分析胶质瘤患者脑脊液D-二聚体ROC曲线评估可能发生VM或SCM的最佳脑脊液D-二聚体截断值,结果显示,最佳的脑脊液D-二聚体截断值为69 ng/mL,AUC为0.932 7,灵敏度和特异度分别为86.75%和94.12%。这个结果似乎不可想象,脑脊液中如此远低于血浆正常值的D-二聚体浓度可能具有预示胶质瘤VM和SCM的可能性。虽然血浆D-二聚体升高能够作为预测高级别胶质瘤发生血栓的标志物[16],但目前仍没有能够预测胶质瘤发生VM和SCM的较好指标。本研究显示,脑脊液D-二聚体截断值为69 ng/mL具有较高的灵敏度和特异度,说明脑脊液D-二聚体升高能够作为预测胶质瘤VM和SCM的标志物,数值偏低可能与脑实质组患者脑脊液D-二聚体偏低和脑实质组患者数比重较多有关。SCM组患者脑脊液D-二聚体升高幅度远高于VM组,绝大多数超过10 000 ng/mL,最高者达60 000 ng/mL,提示脑脊液D-二聚体显著升高不但对胶质瘤SCM有较高特异度,而且其升高幅度也直接反映SCM程度和肿瘤负荷。D-二聚体升高在预测胶质瘤VM时可能存在一定误差,因此进一步扩大研究寻找合适的脑脊液D-二聚体截断值,通过量化预测胶质瘤SCM是非常重要的,可以避免误诊或漏诊。
有文献报道,胶质母细胞也具有激活凝血系统的作用,胶质母细胞瘤患者血浆D-二聚体水平升高是独立的预测肿瘤进展预后的危险因素,当血浆D-二聚体水平超过500 ng/mL时,肿瘤患者死亡率明显升高[12]。Zhang等[17]报道81例终末期肿瘤患者血浆D-二聚体进行性升高预示肿瘤进展和不良预后,临终前4~8周和1~4周血浆D-二聚体动态升高,差异有统计学意义。本组胶质瘤患者血浆D-二聚体ROC曲线显示,血浆D-二聚体截断值为219 ng/mL,各组中只有SCM组血浆D-二聚体水平稍高于血浆正常参考值,其余各组血浆D-二聚体水平均远低于血浆D-二聚体正常参考值,提示正常脑脊液中不存在凝血因子,因此当胶质瘤发生VM和SCM时,出现脑脊液D-二聚体升高,进一步证实脑脊液D-二聚体升高与脑胶质瘤VM和SCM有关。肿瘤患者在多种疾病状态下可以伴随血浆D-二聚体水平升高,如手术、放化疗、感染、脏器功能衰竭、血栓形成及高凝等病理状态,血浆D-二聚体水平升高在实体肿瘤中缺乏特异性和敏感性,因此本组血浆D-二聚体水平在胶质瘤及胶质瘤复发转移时没有发现具有诊断和参考价值,与许多临床研究报道不符合[18],但本组脑脊液D-二聚体水平升高显示出明确的临床意义。
VM组和SCM组全身化疗联合甲氨蝶呤鞘内注射治疗有效的患者脑脊液D-二聚体水平显著下降,症状明显改善,化疗无效者脑脊液D-二聚体水平短暂下降或下降不明显,生存期短,提示全身化疗联合甲氨蝶呤鞘内注射对部分VM组和SCM组患者有一定疗效;当脑脊液D-二聚体水平下降不明显或进行性升高时,表明化疗无效,需更换化疗方案。本研究发现,原来治疗有效的患者继续治疗后,脑脊液D-二聚体可逐渐再次较快或迅速升高,部分患者病情进展迅速,预示胶质瘤进一步发生耐药和肿瘤进展,预后明显变差,提示动态监测脑脊液D-二聚体水平变化可作为胶质瘤脑室侵犯和脊髓播散患者评估疗效、预后及调整化疗方案的指标。血浆D-二聚体水平在治疗前后没有显著性变化,没有显示出临床指导意义。
综上所述,脑脊液D-二聚体升高是有效预测胶质瘤VM或SCM和评估疗效的标志物,对SCM患者更有意义。

