PLK4在结直肠癌中的表达及临床意义
蒋浩海,肖 锋,顾春燕,周林森,高一飞,穆向明
1.盐城市第一人民医院普外科,江苏 盐城 224001;
2.南通大学附属南通第三医院病理科,江苏 南通 226006
Polo样蛋白激酶4(Polo-like kinases 4,PLK4)是一种高度保守的丝/苏氨酸蛋白激酶,属于Polo样蛋白激酶家族,但在结构上与该家族其他成员有所不同,主要参与调控中心体的复制进程[1],过表达PLK4能够诱导肿瘤细胞中心体扩大、染色体不稳定及肿瘤侵袭性增强[2-3]。PLK4在人结直肠癌(colorectal cancer,CRC)组织中的表达情况还缺乏相关研究。本研究旨在明确PLK4 mRNA和蛋白在CRC中的表达状态,与CRC临床病理指标是否存在相关性,以及与预后的关系。
1 资料和方法
1.1 临床资料
选取南通大学附属南通第三医院2012年1月—2015年12月经手术切除的CRC患者标本129例;均经患者知情同意,并通过医院伦理委员会批准。组织常规4%甲醛溶液固定、石蜡包埋。取上述129例CRC患者中的19例癌组织及相应癌旁组织新鲜标本,液氮冻存备用。本组CRC患者年龄31~89岁;其中男性86例,女性43例。术后通过电话随访本组患者至2017年8月,随访时间3~66个月,129例患者中共113例成功随访,16例失访,随访频率为2~3个月/次。
1.2 主要试剂
TRIzol试剂盒购自美国Invitrogen公司,反转录试剂盒购自日本TaKaRa公司,PLK4、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物由美国Invitrogen公司合成,兔抗人PLK4多克隆抗体购自艾博抗(上海)贸易有限公司,辣根过氧化物酶标记二抗及免疫组织化学试剂盒购自基因科技(上海)股份有限公司。
1.3 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测
按TRIzol说明书抽提组织总RNA,紫外分光光度仪测定RNA浓度并定量,立即进行反转录反应合成cDNA。PLK4上游引物5’-AATCAAGCACTCTCCAATC-3’,下游引物5’-TGTGTCCTTCTGCAAATC-3’;GAPDH上游引物5’-CCATTTGCAGTGGCAAAG-3’,下游引物5’-CACCCCATTTGATGTTAGTG-3’。反应条件:94 ℃ 5 min,94 ℃ 45 s,60 ℃ 1 min,30个循环,72 ℃ 10 min。每个样本设3个复孔。
1.4 免疫组织化学检测及结果判定
免疫组织化学染色采用Envision二步法,参照试剂盒说明书进行。所有标本经4%甲醛溶液固定12 h,常规组织学方法处理,4 μm厚连续切片,设阳性和阴性对照。免疫组织化学染色结果采用“双盲”法进行评定。采用半定量积分法对癌细胞染色强度和阳性细胞所占百分比进行评分。将染色强度分为4级:未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞所占的百分比:每张切片在400倍放大光学显微镜下随机选择5个视野,计数1 000个癌细胞,计算细胞阳性率,无阳性细胞为0分,1%~10%阳性细胞为1分,11%~50%阳性细胞为2分,51%~80%阳性细胞为3分,81%~100%为4分。将两组评分相乘所得值,分为2个等级:0~6分为低表达组;7~12分为高表达组。
1.5 统计学处理
应用SPSS 17.0统计软件分析处理数据。计量资料用x±s 表示,率的比较采用Fisher精确检验;免疫组织化学结果采用χ2检验分析,各组之间比较采用Spearman秩相关分析;对随访资料用Log-rank检验并绘制Kaplan-Meier生存曲线,应用多因素COX比例风险模型评估对生存影响的独立因素。P<0.05为差异有统计学意义。
2 结果
2.1 PLK4 mRNA在CRC组织、癌旁组织中的表达
PLK4 mRNA在CRC组织中表达较高,在癌旁组织中表达较低(图1)。统计学结果显示,CRC组织中PLK4的相对表达量为1.60±0.78,显著高于癌旁组织(0.85±0.29),差异有统计学意义(P<0.01)。
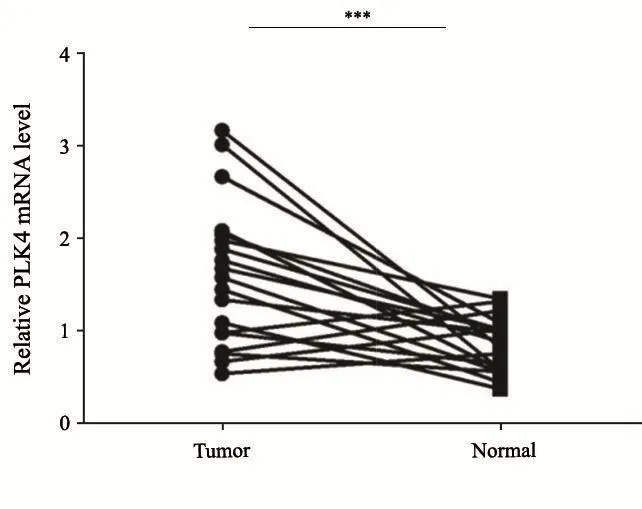
图 1 RTFQ-PCR显示PLK4 mRNA在19例CRC组织中的表达高于癌旁组织Fig. 1 RTFQ-PCR showed that the expression of PLK4 mRNA in 19 cases of CRC tissues was higher than that in adjacent normaltissues***: P<0.01, CRC tissues compared with paracancerous normal tissues
2.2 免疫组织化学检测PLK4蛋白在肠癌组织中的水平及细胞定位
运用免疫组织化学法进一步检测PLK4蛋白在129例CRC组织中的水平,结果显示,PLK4蛋白阳性信号定位于细胞质及部分细胞核(图2)。PLK4蛋白在129例CRC组织中低度阳性62例,高度阳性67例;PLK4蛋白在CRC组织中的水平显著高于癌旁组织(P<0.01,表1)。
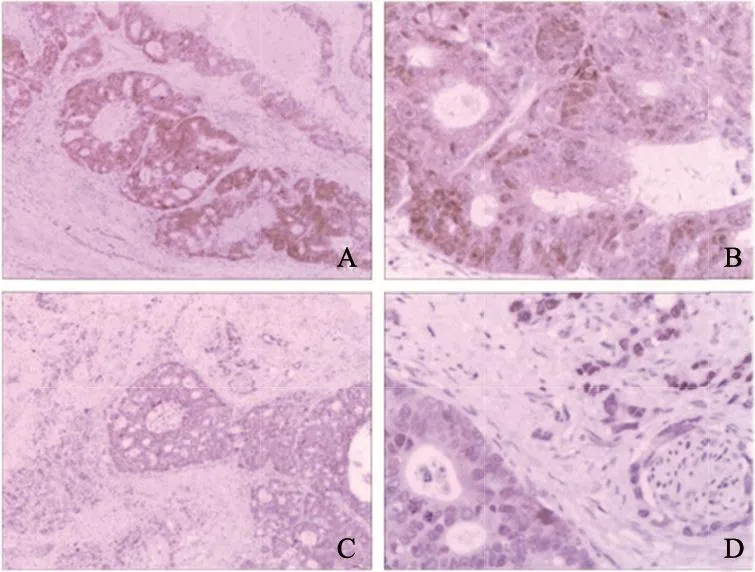
图 2 免疫组织化学检测PLK4在CRC组织中的水平和定位(Envision二步法)Fig. 2 Immunohistochemical analysis of PLK4 expression andlocalization in CRC tissues (Envision two step method)A: PLK4 was detected in the cytoplasm and part of nuclei in CRC cells,staining displayed high expression level (×50); B: Local amplification of graph A (×200); C: PLK4 staining displayed low expression level(×50); D: Local amplification of graph C (×200). It was found that the expression of PLK4 in poorly differentiated CRC (upper right) was higher than that in moderately dierentiated CRC (lower left)

表 1 PLK4蛋白在CRC组织及对应癌旁组织中的水平Tab. 1 Expression of PLK4 protein in CRC tissues and adjacent normal tissues
2.3 PLK4表达与CRC临床病理特征的关系
PLK4蛋白水平与CRC分化程度(P=0.001 1)、N分期(P=0.000 0)、M分期(P=0.035 8)和TNM分期(P=0.000 0)呈正相关。PLK4水平与CRC患者年龄、性别、大小、部位及T分期均无显著相关性(表2)。
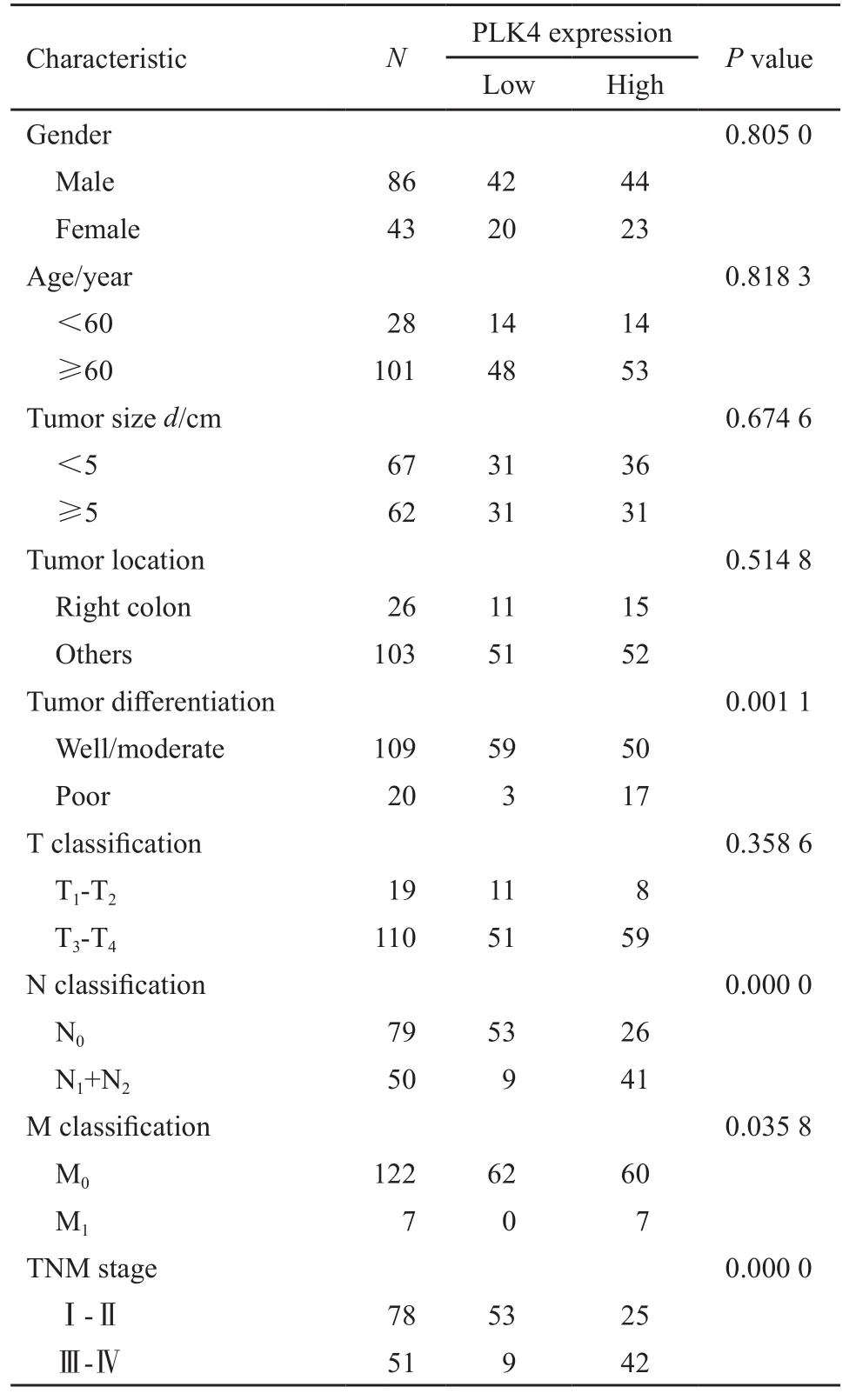
表 2 PLK4表达与CRC临床病理特征之间的相关性Tab. 2 Correlation of PLK4 expression with clinicopathological features of CRC patients(n)
2.4 PLK4蛋白水平与预后的关系
将CRC患者分为PLK4低表达组和高表达组,应用Kaplan-Meier法进行生存分析并绘制生存曲线,组间生存率比较采用Log-rank检验,结果显示,PLK4低表达组中位生存时间为27个月,高表达组中位生存时间为12个月,组间总生存率(overall survival,OS)差异有统计学意义,PLK4高表达组OS明显低于PLK4低表达组(χ2=13.476,P=0.000,图3)。应用COX比例风险模型评估PLK4高表达对生存的影响,结果显示,PLK4高表达组与低表达组的风险比(hazard ratio,HR)为0.532(95%CI:0.213~1.327,P=0.176,表3),PLK4高表达不是CRC的独立预后因素。
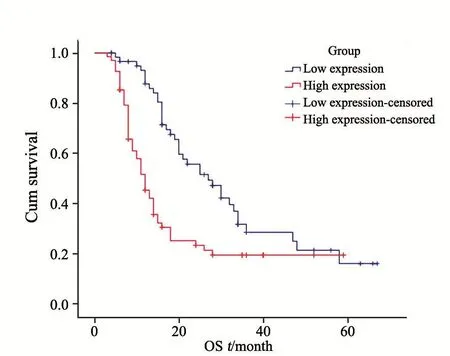
图 3 PLK4高表达组和低表达组的CRC患者生存曲线Fig. 3 Survival curve of PLK4 high expression group and PLK4low expression group in CRC patientsOS rates of patients with PLK4 high expression group is significantly lower than that of patients with PLK4 low expression group (Log-rank test, P<0.001)
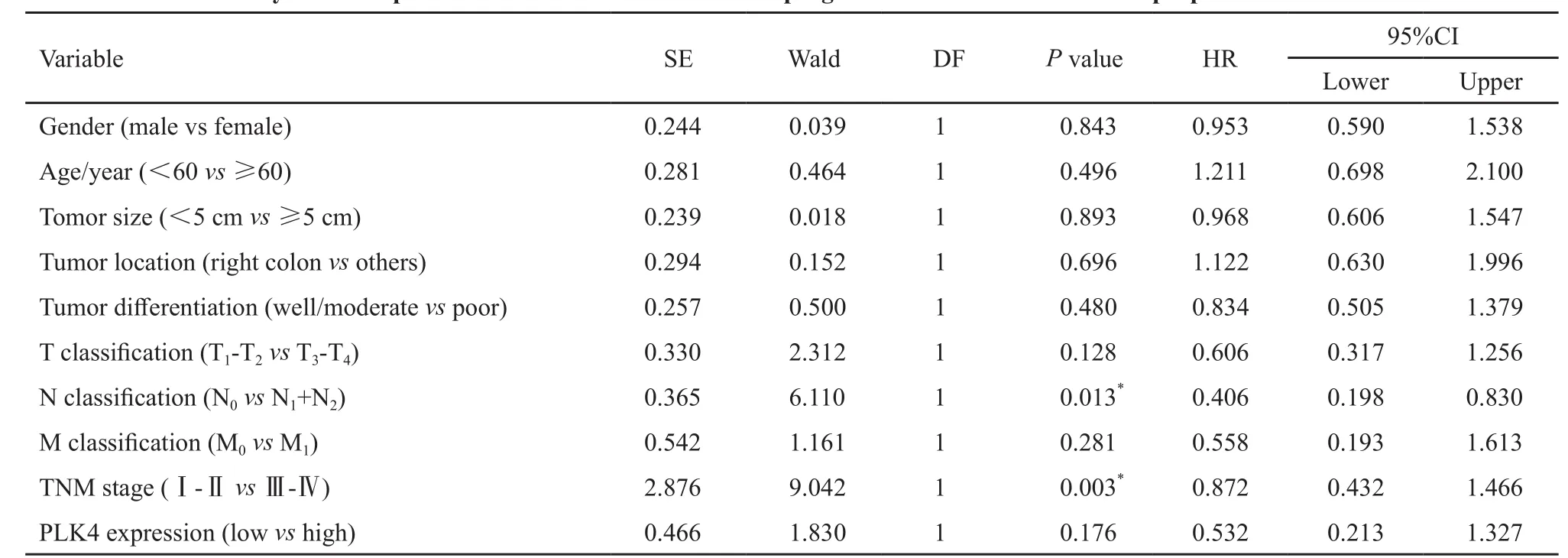
表 3 多因素COX比例风险模型分析CRC独立相关因子Tab. 3 Analysis of independent correlation factors of CRC prognosis with multivariate COX proportional hazards model
3 讨论
PLK4在细胞有丝分裂过程中发挥重要作用,包括参与调节中心体复制、细胞伸展、运动和胞质分裂。在细胞周期G1早期,PLK4通过自身磷酸化调节中心体的复制,同时通过负反馈环导致自身降解来限制每次循环中心体只复制1次[4-5]。在S期,PLK4通过与细胞周期蛋白依赖性激酶CDK2、CP110和PLK4下游调节分子纺锤体组装6同源物相互作用,进而启动和催化中心粒的复制和延伸[6]。然而,调控PLK4基因表达的相关因素没有得到充分的明确。有研究结果表明,SAPK通路和P53的协同作用能抑制PLK4活性[7],而这两条途径往往是在恶性肿瘤中失活的。另有研究显示,NF-κB能调控PLK4的表达,PLK4可能是一个新的NF-κB靶基因,为进一步的NF-κB调控中心体复制提供了一个直接的联系[8]。
PLK4在胃癌、肝癌和乳腺癌中的表达状态此前已有报道[2,9-10]。然而,PLK4表达状态在不同癌症中有所不同。PLK4在胃癌和乳腺癌中过表达,而在肝细胞癌中的表达水平较低。也有一些报道表明,PLK4在CRC组织中高表达[11],但在CRC中PLK4的作用还缺乏深入的研究。
本研究中,我们全面研究了PLK4 mRNA及蛋白在CRC组织中的表达状态,并明确了PLK4表达与CRC临床病理参数的关系,以及对CRC的预后评估价值,结果表明,PLK4 mRNA和蛋白在CRC组织中表达上调,并且与CRC组织学分化差、淋巴结转移、远处转移及TNM分期高相关。此外,Kaplan Meier生存分析显示,高表达PLK4的CRC患者OS低,是不利的预后因素,多因素COX比例风险模型分析显示,PLK4高表达不是独立的危险因素。本研究结果表明,PLK4可能在CRC的侵袭和转移中起着重要的作用,PLK4高表达提示CRC预后差,但不是独立预后因素。
Kazazian等[12]最新的研究结果显示,体外癌细胞的迁移和侵袭,以及体内的癌症异体移植模型中肿瘤的局部浸润和转移都依赖于PLK4的激酶活性,PLK4表达缺失不仅可抑制癌细胞的浸润性生物学行为,并且诱导分化差的乳腺癌细胞出现上皮表型(提示分化趋向成熟)。这与本研究关于PLK4高表达与CRC淋巴结转移和远处转移正相关、PLK4在分化差的CRC组织中高表达的结果是一致的。Sredni等[13]的研究结果表明,发生于儿童的髓母细胞瘤过表达PLK4,而恶性横纹肌样肿瘤的瘤细胞增殖高度依赖于PLK4,进一步的研究提示,运用靶向小分子抑制剂抑制PLK4可能作为一种新的治疗策略治疗恶性横纹肌样肿瘤和其他胚胎脑肿瘤[14]。靶向抑制CRC中PLK4的表达能否作为新的治疗方式有待进一步研究。
综上所述,PLK4在CRC组织中高表达,可能参与CRC的侵袭、转移过程,检测CRC组织中PLK4的表达可以提示预后。进一步明确PLK4在CRC中的作用机制,将有助于更深入地认识CRC,也为临床寻找新的治疗靶点提供思路。

