沼泽红假单胞菌与枯草芽孢杆菌对鲫鱼IL-8和IL-10基因表达的影响
方庆,李璟,王利
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.成都理工大学环境学院,四川 成都 610059)
白细胞介素(interleukin)是指在白细胞或免疫细胞间相互作用的淋巴因子,可以传递信息,激活、调节免疫细胞并介导T、B细胞增殖与分化,在炎症反应中也起重要作用。IL-8和IL-10是其中的重要组成部分,在炎症反应和免疫方面发挥着极其重要的作用[1-2]。IL-8属于CXC型趋化因子,具有促进炎症反应与有丝分裂和刺激血管生成等作用,与多种疾病及衰老都有密切的联系,在免疫调节及抗肿瘤方面也具有极其重要的作用,并且是评价动物免疫功能的重要指标[3]。IL-10作为一种多效价细胞因子在肿瘤、炎症和免疫性疾病等多种疾病中也发挥着重要的作用。IL-10在具有免疫抑制作用的同时也具有免疫刺激作用,可以促进B细胞的增殖、分化和MHCⅡ类分子表达,阻止B细胞凋亡,并促进各种免疫球蛋白类别的转换和非单核细胞依赖性T细胞的成熟与增殖,是重要的抑制性细胞因子[4]。
枯草芽孢杆菌和沼泽红假单胞菌是我国农业部第105号公告公布的允许使用的益生菌饲料添加剂,因其具有无抗药性、适应性强,能耐受高浓度的有机废水和较强的分解转化能力,不污染环境等优点在养殖产业中使用广泛[5]。目前,已有关IL-8及IL-10的研究多偏重于对肿瘤因子的影响,而关于益生菌对鲫鱼相关基因影响的文章鲜有报道。该试验采用RT-PCR方法,选用沼泽红假单胞杆菌、复合菌种(枯草芽孢杆菌和沼泽红假单胞菌)对鲫鱼的两个基因表达的影响的不同状况,推测益生菌对鲫鱼炎症反应和免疫功能的作用,为深入研究鲫鱼免疫应答反应、炎症发生及益生菌的推广使用,提供参考资料。
1 材料与方法
1.1 试验材料
试验中所用枯草芽孢杆菌和沼泽红假单胞菌,由该试验室制备培养,经分子鉴定后于-80℃冰箱中保存备用。试验用鲫鱼购于成都某市场,体长(15.7±2.3)cm,体质量(115.2±13.8)g。营养琼脂(Nutrient Agar;北京奥博星生物技术有限责任公司)。2×Long Tap Mix酶、DNA Marker DL2000购自北京天根生化科技有限公司产品。Yeast Extract、Tryptone、Trizol(Invitrogen公司产品),凝胶回收试剂盒(Axygen公司产品)。
1.2 试验方法
1.2.1 试验分组
选取大小均匀,生长状况良好的鲫鱼90尾,分成3组。A组空白对照组,B组添加沼泽红假单胞菌,C组添加沼泽红假单胞菌和枯草芽孢杆菌按照1:1混合制成的复合菌。两组菌均添加至水中。每隔3天进行菌液的添加,至终浓度活菌量为2.1×107cfu/ml,试验养殖时间为30 d。试验每隔10 d,每缸随机选取3尾鲫鱼,采集上述3尾试验鲫鱼的脾脏和肾脏组织,液氮速冻后迅速将样品放入-80℃低温冰箱中保存备用。
1.2.2 提取总RNA及合成cDNA
利用Trizol法提取试验鱼脾脏和肾脏样品的总RNA[6],用分光光度计检测RNA浓度,并使用FastQuant反转录试剂盒对提取的RNA进行反转录成cDNA,将获得的cDNA置于-20℃保存备用。
1.2.2 引物设计
根据GenBank数据库中登录的鲫鱼IL-8和IL-10基因全序列,以β-actin为内参基因。利用Primer Primer 5.0设计引物,并用Oblige 6.0检验,序列为:IL-8上游引物 5'-CTTAGAGGACTGGGTGTA-3',下游引物5'-GTTATCTTCAGGGTTGC-3'。IL-10上游引物5'-GACACCATTCTGCCAACA-3',下游引物5'-GCGAACTCAAAGGGATT-3'。β-actin上游引物5'-CAAGATGATGGTGTGCCAAGTG-3',下游引物5'-TCTGTCTCCGGCACGAAGTA-3'。
1.2.3 PCR扩增
PCR 反应体系(25 μL):dd H2O 10 μL,2×Taq PCR Master Mix 13 μL,上游引物(10μmol/L)0.9 μL,下游引物(10 μmol/L)0.9 μL,cDNA 模板 1.2 μL。PCR 反应程序为:94℃5 min;94℃30 s,适宜TM值30 s,72 ℃ 40 s,共32个循环;72℃ 5 min。IL-8、IL-10 和β-actin的TM值分别为46℃,52℃和56℃。用1%琼脂糖凝胶电泳对PCR产物进行检测,最后在80 V电压下电泳30 min,观察结果并凝胶成像系统记录。
2 结果分析
2.1 总RNA的提取及检测
经凝胶电泳检测,A组、B组和C组中脾脏和肾脏(10 d、20 d和 30 d)RNA 28S、18 S 条带单一清晰,分光度计检测OD260/OD280值在1.8~2.0之间。由此RNA质量及完整性较好,符合试验要求。
2.2 PCR扩增结果
2.2.1 IL-8表达结果
IL-8的序列长度为143 bp,β-actin序列长度为120 bp,由图1~图3可知,IL-8在各时间段的不同组织内均有表达。在组别上,图1 IL-8在C组脾脏中表达量比A、B两组低,在B组肾脏中的表达量比A、C两组高;图2 IL-8在各组组织中的表达量无明显差异;图3 IL-8在各组组织中均有较高表达。在时间段上,20 d的表达量最低,而30 d的表达量最高。
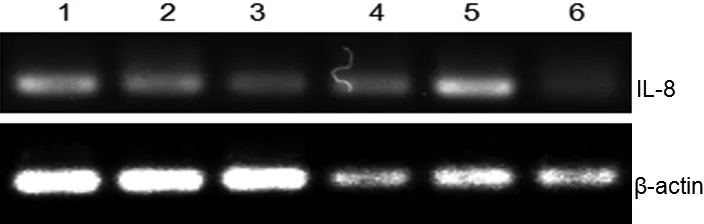
图1 IL-8在不同组织中的表达(10 d)
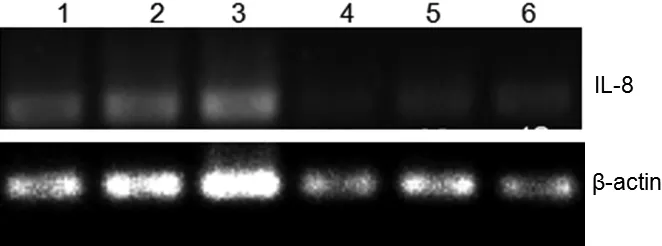
图2 IL-8在不同组织中的表达(20 d)
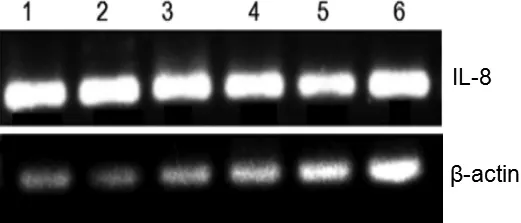
图3 IL-8在不同组织中的表达(30 d)
2.2.2 IL-10表达结果
IL-10的序列长度为146 bp,β-actin序列长度为120 bp。由图4~图6可知,IL-10在各时间段的不同组织内均有表达。在组别上,图4 IL-10在C组脾脏和肾脏中表达量均比A、B两组高;图5 IL-10在各组组织中的表达量均较低;图6 IL-10在脾脏中的表达量均无明显变化,在B、C组肾脏中的表达量均比A组高。在时间段上,20 d的表达量最低,而30 d的表达量最高。
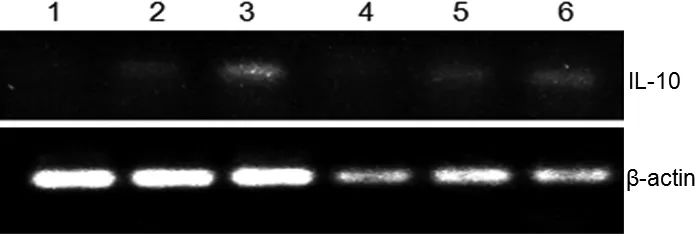
图4 IL-10在不同组织中的表达(10 d)
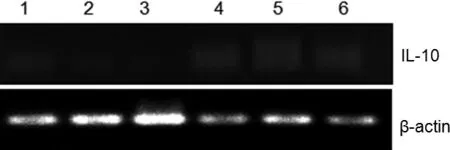
图5 IL-10在不同组织中的表达(20 d)
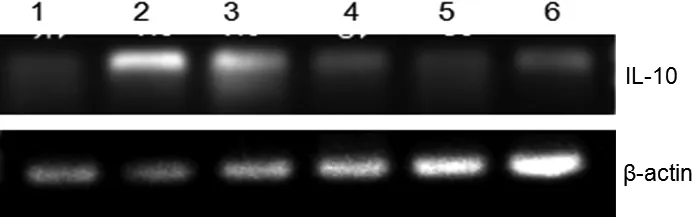
图6 IL-10在不同组织中的表达(30 d)
3 讨论
益生菌对于提高水产动物的免疫能力和抗体水平的报道已有许多[7]。沼泽红假单胞菌和枯草芽孢杆菌均属于水产养殖中常用菌种,能够促进鱼类的生长和相关免疫。研究发现向青虾养殖系统中分别添加硝化细菌制剂、芽孢杆菌制剂及硝化细菌和芽孢杆菌复合菌剂,结果显示,青虾平均体质量硝化细菌+芽孢杆菌组增长最多,硝化细菌组稍大于芽孢杆菌组,空白组最少[8]。微生物制剂能够促进肠胃营养成分吸收,从而使黄颡鱼的生长加快[9]。鱼类饲料中添加枯草芽孢杆菌能提高团头鲂的可抗氧功能,增强集体的防御能力,进而促进机体健康[10]。在罗非鱼饲料中添加沼泽红假单胞菌,罗非鱼死亡率明显低于对照组,抗病效果显著[11]。
饲料中添加壳寡糖可以促进青鱼IL-8和IL-10基因的表达[12]。双气三联活菌减少了IL-10KO小鼠的结肠炎症,降低了促炎细胞因子的分泌[13]。益生菌乳酸菌的脂质酸在猪小肠上皮细胞中能降低聚I:c(聚肌胞苷酸)诱导的IL-8的生成,从而抑制病毒致病性炎症反应[14],2株乳酸菌抑制Escherichia coli K88对促炎症因子APRIL分泌的诱导作用并促进Escherichia coli K88感染的肠上皮细胞分泌IL-10[15]。屎肠球菌可以保护肠上皮细胞,并能减弱肠上皮细胞中ETEC(产肠毒素大肠杆菌)诱导的IL-8分泌[16]。该试验复合菌组(C组)基因IL-8在肾脏和脾脏的表达量明显高于对照组(A组),说明适当添加复合菌对鲫鱼免疫功能的提高有明显的影响。IL-10在肾脏中表达量高于对照组,说明沼泽红假单胞菌能提高鲫鱼的免疫功能,其作用机理可能与上述机制相似。而基因IL-10在鲫鱼脾脏中表达结果相似,可能是因为IL-10在脾脏中自身表达较低,也可能是益生菌对于脾脏中基因的影响不大,或者与不同菌种的有效成分或者作用方式不同有关,也或者与菌种的选择或益生菌配比比例有关,其根本原因需要进一步研究。
该试验IL-8基因在B组和C组中的表达量明显高于对照组。该研究中第20天时B组和C组的IL-8、IL-10基因的表达量明显低于第10天和第30天,造成这种差异的原因可能与试验周期长短、温度应激有关,一定时期内使用免疫增强剂反而会使机体免疫功能下降,可能是鱼体免疫调节系统存在一种负反馈机制。因此,有必要研究益生菌的有效免疫期,也可以作为该试验基因的表达量随时间改变而有所改变的试验依据。
综上所述,该试验从基因水平探讨了益生菌对鲫鱼脾脏和肾脏中IL-8及IL-10基因表达的影响。这为深入研究益生菌对鲫鱼免疫机制的影响提供参考,也为益生菌在水产养殖中的应用提供科学资料。

