影响斑点叉尾 病毒病发病因素的探索
刘洪岩,王江,张世勇,王明华,赵彦华,陈校辉,边文冀
(江苏省淡水水产研究所,江苏 南京 210017)
斑点叉尾 病毒(Channel catfish virus,CCV),属于疱疹病毒科(Herpesvirus), 鱼疱疹病毒属(Ictalurivirus)[1]。CCV 是一种线性双链 DNA 病毒[2],病毒颗粒为20面体对称,核衣壳由162个壳粒组成,直径约为100nm,具有囊膜的完整病毒粒子,直径约为175~200 nm[3]。CCV基因组全长为134.2 Kb,共有79个开放阅读框。CCV通过滚环方式复制,可发生在10-35℃温度范围内,35℃时复制速度最快,而30℃时复制量最大,最适的复制温度是25-33℃。CCV能够在25℃的池水中生存2 d,在池底淤泥中迅速失活[4]。
斑点叉尾 病毒传播速度快、病程短、病死率高,给斑点叉尾 产业带来了严重的经济损失。在已知的报道中发现,CCV的产生和传播和外部环境有很大的关系,但并没有确定各种影响因子对发病的具体影响力。因此,在目前的预防和治疗措施中,没有提出有效的解决预防方案,只能通过有效的管理来将影响降低。该试验通过对斑点叉尾 攻毒CCV,观察不同的温度、病毒量以及种质对发病以及病死率的影响,旨在为CCVD的防控和斑点叉尾 抗病品种的选育提供理论支持。
1 材料与方法
1.1 试验动物
2017年12月从江苏省淡水水产研究所扬中基地6—7月繁育的49个斑点叉尾 家系中随机挑选体质量为15.0~20.0 g的健康幼鱼于江苏省淡水水产研究所实验室内进行暂养2周。暂养期间每天投喂两次,使用嘉吉精养鱼料进行投喂,正式试验开始后停止喂食。使用加热棒将水温控制在28~30℃。
1.2 试验药物
试验用的CCV来自于华中农业大学,试验病毒先配置母液,梯度稀释为103,104,105 TCID50。
1.3 试验方法
试验全程在室内进行,使用容量为250 L的塑料箱进行养殖,试验用水为经过曝气处理的自来水,pH 值7.8~8.2,溶解氧浓度>5 mg/L,光照 200~1 200 lx,24 h曝气。选择100 g左右,大小均匀的斑点叉尾 进行试验,每组10条。采用腹腔注射的方式进行攻毒,注射病毒体积为100 μL。
病毒浓度影响实验中,设103 TCLD、104 TCLD、105 TCLD 3个浓度组,每组3个平行。温度影响试验中设置两个温度,分别为10℃和18℃,每个组设置3个平行实验。种质影响试验中,设置两种种质,分别为正常的斑点叉尾 和白化的斑点叉尾,每个组设置3个平行试验。温度影响试验中,试验组攻毒的浓度为104 TCLD;种质影响试验中,试验组攻毒的浓度为103 TCLD。对照组同样设置3个平行,注射等量体积的生理盐水。
病毒注射后便开始正式试验,及时观察鱼体活动情况,并记录死亡情况及时捞出死亡个体。死亡标准为触碰无任何反应。
1.4 计算公式
试验结束后按以下公式计算:
累积病死率(cumulative mortality,CM)=(累计死亡鱼尾数/攻毒鱼尾数)×100%
2 结果
斑点叉尾 注射CCV后,观察发现大部分鱼体均出现不同程度的感染现象,前期主要出现鱼集群聚集在角落,部分鱼在水中急促紧张游动,出现打转、翻转现象,最后倒立在水中死亡。体表发现鳍条基部、尾柄、肌肉有出血点,腹腔膨大,单侧或双侧眼球凸出,腮丝发白,表皮发黑。解剖后腹腔内有黄褐色积水,肠道呈现灰白色,肝、脾肿大且有出血点,肾也发现有出血。
2.1 温度对CCVD暴发的影响
斑点叉尾 在注射CCV之后,由于鱼体自身免疫和病毒剂量的关系48 h内没有出现死亡。高温度组(18℃)第3天开始开始出现死亡,低温度组(10摄氏度)第5天出现死亡。高温度组的LC 50出现在第12天,低温度组LC50出现在第13天,在第13天之后,高温度组和低温度组没有明显差异,高温度组在17 d全部死亡,低温度组在18 d全部死亡。至试验结束,对照组全部存活。试验结果如图1所示。
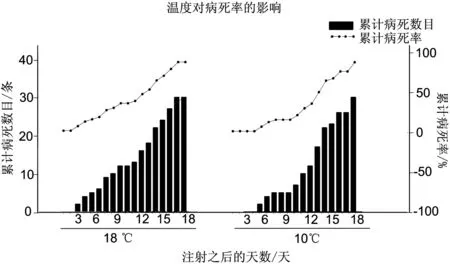
图1 不同温度组斑点叉尾累积病死率和累计病死数目
2.2 病毒浓度对CCVD暴发的影响
斑点叉尾 在注射CCV 20 h之后,105TCLD出现死亡,104TCLD组在攻毒后3 d出现死亡,103TCLD组在第8天才出现死亡。103组第八天开始出现了暴发性死亡,从开始死亡到全部死亡,用时10 d,与104TCLD和105TCLD接近。103TCLD,104TCLD,105TCLD组的LC50分别出现在第13天,第12天和第10天。试验结果如图2所示。
2.3 种质浓度对CCVD暴发的影响
为了突出种质的区别,试验中选取了正常的斑点叉尾 和白化斑点叉尾 作了对比试验。白化组在第3天开始出现暴发性死亡,病程短,从出现死亡到全部死亡用时4 d,正常组在第8天开始出现死亡,病程较长,全部死亡用时10 d。103TCLD攻毒时,正常组的LC50出现在第10天,白化组的LC50出现在第5天。实验结果如图3所示。
3 讨论
该试验讨论了温度,病毒浓度和种质对CCVD暴发的影响。
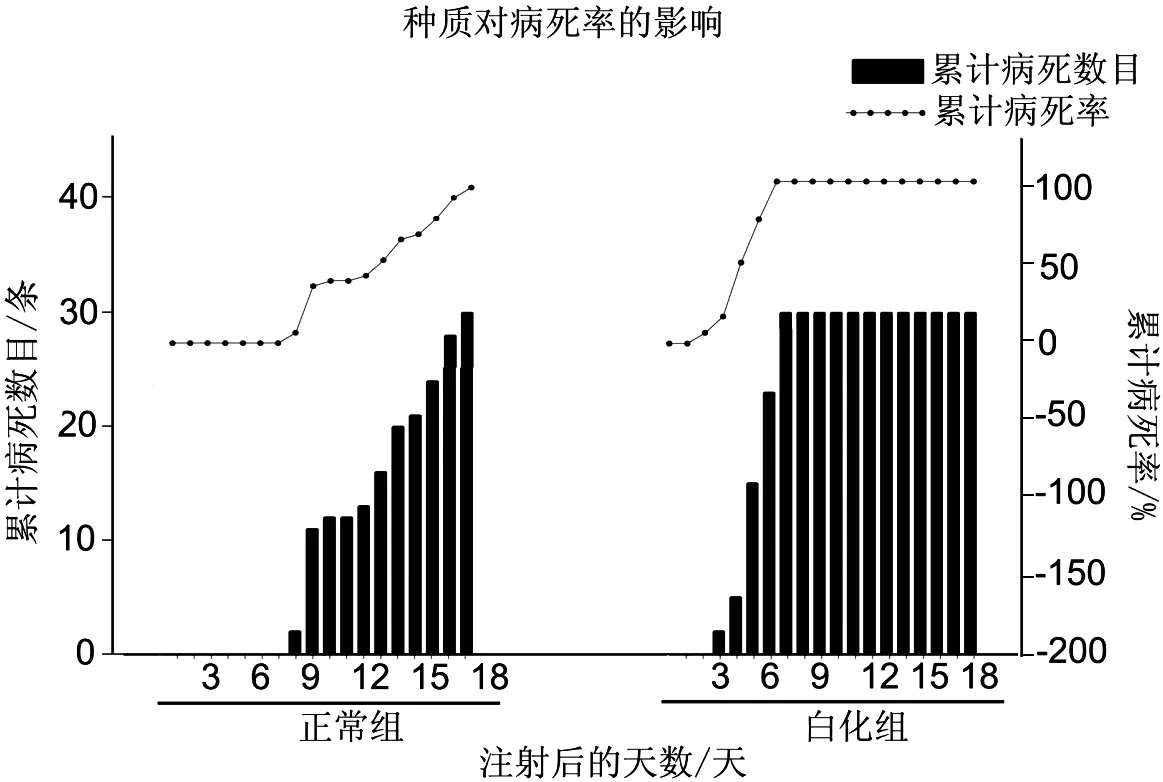
图3 不同种质组斑点叉尾累积病死率和累计病死数目
在温度的试验中,10℃组和18℃组在暴发的时间上时有区别的,低温组暴发迟缓。两组实验中,从暴发到死亡所用的时间,也就是病程,并无很大区别,低温组用时13 d,高温组用时15 d。这说明,温度会影响病毒的复制,温度升高会加快病毒的复制,但是,当病毒达到一定的浓度时,温度这一因子对疾病的暴发影响力并不大。与以往的研究不同,该次试验中,在10℃的试验组发现了CCVD的暴发,这说明在低于15℃时,CCVD是可能暴发的。
在观察浓度对CCVD的暴发的影响时,发现,低浓度组(103)暴发最晚;高浓度组(105)最先暴发。这证明,病毒在鱼体内达到一定的量,才会对鱼造成伤害,CCVD暴发的时候,鱼体内的病毒已经达到了一定浓度。高浓度的病毒作用下的是急性病毒病感染,个体免疫系统不能迅速地将所有的病毒清除,因此,短时间内会出现较多的死亡,但是,由于个体差异,有些个体免疫反应比较强,对病毒清除比较快,因此不会在短时间内一下都发病[5]。低浓度的病毒感染是慢性感染,病毒感染后,宿主有时间修复病毒造成的组织损伤,因此CCVD暴发需要长时间的病毒复制才能实现,所以出现了暴发推迟,但是暴发的病程并没有延长,这是因为病毒在宿主体内存在并不断复制,发病时已经达到了高浓度,并且由于慢性的病毒感染,已经导致了部分器官的病变,因此病程不会延长。
种质对CCVD暴发影响的试验证明,种质在对抗疾病中起到关键性作用。试验中使用了白化的斑点叉尾 ,在低浓度作用下,会迅速暴发引起死亡(第3天暴发VS正常组第8天暴发),病程极短(白化组病程4 dVS正常组病程10 d)。这说明,种质对CCVD暴发有很大的影响。种质的差异,区别于个体的差异,是一种群体的表现,白化群体表现出来对CCVD抗性非常弱。这也说明了选育抗病品质的必要性和可行性。
综合目前国内外的相关研究可以发现,CCV是一种传播速度极快、危害十分严重的急性传染病。感染后的致死率甚至能够超过90%达到100%。大规模的暴发CCV将会给养殖产业带来极其严重的经济损失。目前常用的CCV检测手段主要是通过细胞培养的方式分离病毒,然后使用免疫荧光或PCR分子鉴定的方法来进行检测,但操作步骤过于繁琐且周期较长[6-7]。李惠芳等人建立的实时荧光定量PCR检测方法则大大提高的检测速率和准确性[8]。
在目前的技术条件下还没有有效的治疗方法来控制CCV,只能通过合理高效的管理手段来降低发病风险。从而将损失压到最低。
首先要定期对养殖场环境进行检疫,尤其是苗种的产地检疫。由于CCV是可以垂直传播的,并且在病毒积累到一定量才会发病,因此,携带者就是暴发的危险因子。一旦发现有携带CCV,应该及时清除。其次,消毒,减少环境对鱼的应激,苗种孵化一定要采取消毒措施,对于已经感染病毒的苗种要及时清除,使用的工具也要进行销毁。最后是新品种的培育。种质在抗病中起到关键作用,不同的种质对于疾病的敏感性不同,例如抗病基因的筛选(干扰素高表达品种),抗病SNP筛选等等[9]。因此,选育抗病新品种是预防CCVD暴发的关键[10]。

