老蒜提取物石油醚部位对大肠杆菌的抑制作用研究
王小敏,杨钰昆,张民
(1.山西中医药大学制药与食品工程学院,山西晋中 030619)(2.天津科技大学食品工程与生物技术学院,天津 300457)(3.山西大学生命科学学院,山西太原 030006)
大蒜作为传统的药食两用植物其抑菌活性已被广泛认可,然而大蒜刺激性和难闻的气味限制了其消费和利用。将新鲜大蒜切片后浸泡于低浓度乙醇水溶液中,于室温下避光保存10个月或者20个月,过滤后得到的浸提液经减压低温浓缩即得到市售的老蒜提取物[1]。老蒜提取物是一种特殊的大蒜产品,具有安全、低刺激性的特点。老蒜提取物在其制备过程中,生蒜中原有的不稳定的化合物,通过酶催化或者自然反应产生了独特的对人体有益的有机硫化物以及生物碱,且大蒜的刺激性和臭味也得到改善[2]。
老蒜提取物对一些疾病如:糖尿病、老年痴呆症、动脉粥样硬化、血管冠状钙化、内皮功能异常、抗癌药物引起的心脏毒性和细胞凋亡、心脏病、癌症、高血压、高血脂以及衰老[3,4]的治疗或预防有积极地作用,但关于老蒜提取物抑菌活性研究较少。有文献报道称λ-谷氨酰半胱氨酸是大蒜中含硫化合物的前体物质,经过水解氧化可以转化为蒜氨酸[5]。在老蒜提取物的制作过程中,蒜氨酸逐渐损失形成硫代亚磺酸酯,硫代亚磺酸酯不稳定逐渐转化为二烯丙基二硫化物、二烯丙基三硫化物等具有二硫键的化合物,这些具有二硫键的化合物是大蒜中主要的抑菌活性物质[6,7]。课题组前期已经对两种自制老蒜提取物的抑菌活性以及可能的抑菌活性成分做了研究分析,发现老蒜提取物石油醚部位含有多种具有二硫键的化合物以及有机酸和酚类物质使其对多种细菌表现出了较强的抑菌活性[8],但两种自制老蒜提取物石油醚部位的抑菌机理尚不明确。
本实验以课题组自制的两种老蒜提取物为原料采用石油醚萃取,萃取液挥干溶剂得到老蒜提取物石油醚部位,以大肠杆菌为试验菌株,通过激光共聚焦显微镜和扫描电镜观察、细胞内容物泄漏等实验,研究老蒜提取物石油醚部位对大肠杆菌的抑制机理。
1 材料与方法
1.1 原料
按实验室前期获得的方法制备两种老蒜提取物样品,AGE-1:将普通白皮大蒜切片后于室温下在10%乙醇水溶液中浸泡 90 d,过滤得到浸提液,浸提液40 ℃旋转蒸发浓缩后即得;AGE-2:将大蒜切片后于室温下在蒸馏水中浸泡20 d,过滤得到浸提液,浸提液 40 ℃旋转蒸发浓缩后即得[8]。取 AGE-1、AGE-2加水溶解后分别采用石油醚(60 ℃~90 ℃)进行液液萃取,萃取两次,合并两次萃取液进行浓缩,浓缩液在水浴锅上挥干残留溶剂,得到AGE-1和AGE-2的石油醚部位。AGE-1和AGE-2的石油醚部位分别溶解于少量二甲基亚砜,取试管加定量的蒸馏水,在漩涡振荡器中一边震荡一边用移液器逐滴加入已经溶解于二甲基亚砜的样品,配制成样品的分散液,实验中根据需要以蒸馏水为溶剂将样品稀释成不同浓度的分散液。
供试菌株:大肠杆菌(Escherichia coli,ATCC 25922),由广东省微生物菌种保藏中心提供。
1.2 主要仪器设备
分析天平,JD1000-2,沈阳龙腾电子有限公司;酶标仪,Multiskan FC,美国Thermo公司;生化培养箱,SPX-250,上海博迅实业公司医疗设备厂;往复式双门双层恒温培养振荡器,SPF-1112,上海世平实验设备有限公司;高压灭菌锅,DY2009(X)-032-00,上海博迅实业公司医疗设备厂;分光光度计,TU-1810,北京普析通用仪器有限责任公司;电导率仪,DDS-307,北京华瑞博远科技发展有限公司;激光共聚焦显微镜,C1 plus,日本Nikon公司;扫描电子显微镜,SU1510,日本Hitachi High公司。
1.3 实验方法
1.3.1 最低抑菌浓度的测定
采用微量肉汤稀释法测定石油醚部位对大肠杆菌的最低抑菌浓度(MIC)[9]。分别取AGE-1和AGE-2的石油醚部位配制成浓度为20 mg/mL的分散液,采用倍比稀释法稀释为一系列浓度。取无菌96孔板,第一行1~10孔加10 µL系列浓度的样品,第11和12孔不加样品作为生长对照,1~12孔加100 µL的105CFU/mL大肠杆菌菌悬液,平行三行。第四行 1~10孔加100 µL肉汤培养液作为空白,盖上96孔板盖,将加样后的96孔板于37 ℃恒温培养箱中静置培养24 h,用酶标仪测定600 nm的OD值。以小孔内细菌生长被完全抑制的最低样品浓度为该样品的MIC。
1.3.2 石油醚部位对大肠杆菌生长曲线的影响
大肠杆菌活化后,接种于液体肉汤培养基,置于37 ℃培养箱中培养12 h,稀释为105CFU/mL的菌悬液,取50 mL稀释后的菌悬液与AGE-1和AGE-2的石油醚部位分散液分别混合,使AGE-1和AGE-2的石油醚部位的终浓度分别为其最低抑菌浓度,37 ℃,150 r/min摇床培养,另外以无菌水代替样品做空白对照。每培养两小时取样,采用分光光度计在 600 nm测菌液的OD值[10]。
1.3.3 细胞内容物的泄漏
通过培养液中大分子物质的测定分析微生物细胞内容物的泄漏。取50 mL稀释为105CFU/mL的菌悬液与AGE-1和AGE-2的石油醚部位分散液分别混合,使AGE-1和AGE-2的石油醚部位的终浓度分别为其最低抑菌浓度,37 ℃,150 r/min摇床培养,另外以无菌水代替样品做空白对照。培养0、3、6、9、12、18、24、30、36、42、48 h取样,采用分光光度计在260 nm测定菌液的OD值,该值可以代表细胞内DNA/RNA的泄漏程度由此反映出细胞膜的受损情况[11]。
1.3.4 培养液电导率的测定
取50 mL稀释为105CFU/mL的菌悬液与AGE-1和AGE-2的石油醚部位分散液分别混合,使AGE-1和 AGE-2的石油醚部位的终浓度分别为其最低抑菌浓度,37 ℃,150 r/min摇床培养,另外以无菌水代替样品做空白对照。培养0、2、4、6、8、10、12 h取样,测定培养液的电导率[12]。
1.3.5 激光共聚焦显微镜研究石油醚部位对大肠杆菌的影响
为了研究两种自制老蒜提取物石油醚部位对大肠杆菌细胞通透性和细胞凋亡情况的影响,采用Hoechst33342和PI对大肠杆菌双染。取50 mL浓度为105CFU/mL的菌悬液加样品溶液,使AGE-1和AGE-2的石油醚部位的终浓度为其最低抑菌浓度,37 ℃培养24 h,另外以无菌水代替样品溶液作为对照组。取 1 mL培养后的菌悬液加 10 µL浓度为 0.5 mg/mL的Hoechst 33342(激发波长355 nm,发射波长465 nm),37 ℃染色10 min,5000 r/min,4 ℃离心5 min,弃上清后分散于1 mL缓冲溶液,加5 µL浓度为1 mg/mL的PI染液避光染色10 min(激发波长540 nm,发射波长620 nm),缓冲溶液洗三次。滴加一滴处理好的大肠杆菌悬浮液到载玻片上,盖上盖玻片,然后利用激光共聚焦显微镜进行观察[13]。
1.3.6 扫描电镜观察
为了研究AGE-1和AGE-2石油醚部位对大肠杆菌形态的影响,取50 mL浓度为105CFU/mL的大肠杆菌菌悬液分别与AGE-1和AGE-2的石油醚部位混合培养,使AGE-1和AGE-2的石油醚部位的浓度为其最低抑菌浓度,以无菌水代替样品作为对照组,37 ℃,150 r/min培养24 h后5000 r/min离心5 min,弃上清,菌体用2.5%的戊二醛固定24 h,5000 r/min离心5 min弃上清,超纯水清洗三次后菌体分散于超纯水中。取一滴菌悬液滴加到载玻片上冷冻干燥后喷金,扫描电子显微镜观察[14]。
1.4 数据分析
所有试验重复三次,结果以平均值(mean)±标准差(SD)表示,用Origin 8.0软件作图。
2 结果与讨论
2.1 最低抑菌浓度测定
采用微量肉汤稀释法测定了AGE-1和AGE-2石油醚部位对大肠杆菌的最低抑菌浓度,结果发现AGE-1和AGE-2石油醚部位对大肠杆菌的最低抑菌浓度分别为31 μg/mL 和 62 μg/mL。
2.2 对生长曲线的影响
为了研究石油醚部位对大肠杆菌生长曲线的影响,将AGE-1和AGE-2石油醚部位分别与大肠杆菌混合培养48 h,AGE-1和AGE-2石油醚部位对大肠杆菌生长曲线的影响见图 1,实验中正常对照组很快进入对数生长期,12 h以后OD600保持稳定。AGE-1和 AGE-2石油醚部位处理组降低了大肠杆菌的OD600,培养12 h后大肠杆菌的OD600有一定程度的增加,但始终低于正常对照组,说明AGE-1和AGE-2石油醚部位在其最低抑菌浓度下抑制大肠杆菌的活性,培养12 h后大肠杆菌能够再次进行生长发育但生长速度受到限制,导致其OD600始终低于正常对照组。

图1 石油醚部位对大肠杆菌的生长曲线的影响Fig.1 Effects of petroleum ether fractions on the growth curve of Escherichia coli
2.3 细胞内容物的泄漏
将AGE-1和AGE-2石油醚部位在其最低抑菌浓度下分别与大肠杆菌混合培养48 h,采用分光光度计对培养液中核酸等大分子物质进行了检测,结果见图2,与正常对照组相比,AGE-1和AGE-2石油醚部位导致了培养液中大分子物质的增加,该结果表明AGE-1和AGE-2石油醚部位造成了大肠杆菌细胞壁和细胞膜的损伤而导致了细胞内容物的泄漏。
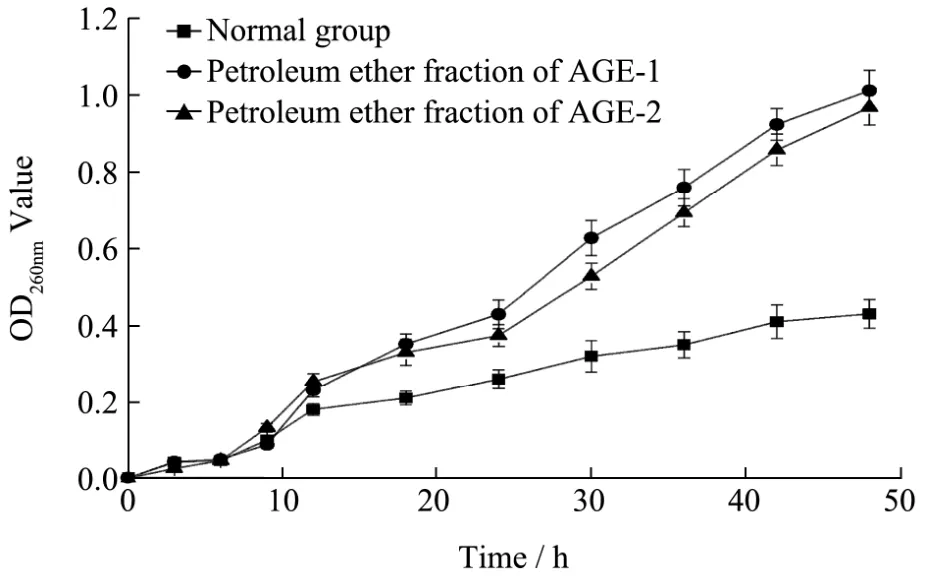
图2 石油醚部位对大肠杆菌大分子物质泄漏的影响Fig.2 Effect of petroleum ether fractions on large molecules leakage of Escherichia coli
2.4 培养液中电导率的变化
细菌细胞膜遭到破坏后,细胞内的电解质大量渗漏到培养液中导致培养液电导率增加,电导率变化可以反映出细胞膜通透性的变化。
将AGE-1和AGE-2石油醚部位在其最低抑菌浓度下分别与大肠杆菌混合培养,每2 h测定培养液的电导率,结果见图 3,由图可以发现正常对照组菌液的电导率一直处在比较低的水平,AGE-1和 AGE-2石油醚部位处理组电导率明显高于正常对照组,且AGE-1石油醚部位处理组的电导率大于AGE-2石油醚部位。
以上结果说明AGE-1和AGE-2石油醚部位在各自最低抑菌浓度时造成了细菌细胞膜的破坏,导致细胞内电解质渗漏,且AGE-1的石油醚部位对细胞膜的破坏作用大于AGE-2的石油醚部位。

图3 石油醚部位对大肠杆菌培养液的电导率的影响Fig.3 Effect of petroleum ether fractions on conductivity of Escherichia coli culture fluid
2.5 激光共聚焦显微镜研究石油醚部位对大肠杆菌细胞膜通透性的影响
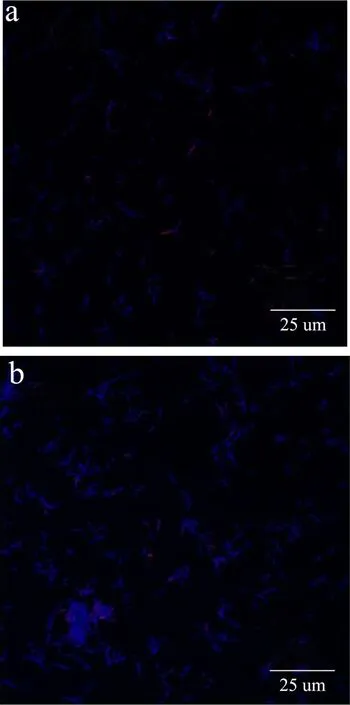

图4 处理24 h后大肠杆菌激光共聚焦显微镜拍摄图Fig.4 Laser scanning confocal microscope image of Escherichia coli after exposure for 24 h
利用PI和Hoechst33342对大肠杆菌双染后用激光共聚焦显微镜观察,结果见图4。Hoechst33342是细胞渗透性荧光染料,可以对所有细胞的DNA进行染色,且健康细胞染色后呈现微弱的蓝色荧光,凋亡细胞呈现强烈的蓝色荧光[15],PI可以对坏死细胞的DNA和RNA进行染色并呈现红色荧光[16]。图4(a)中正常对照组多数细胞都呈微弱的蓝色荧光,红色荧光细胞较少;图 4(b)和(c)中 AGE-1和 AGE-2石油醚部位最低抑菌浓度下处理24 h后细胞蓝色荧光增强,表明AGE-1和AGE-2石油醚部位可以促使大肠杆菌细胞发生凋亡;红色荧光细胞数量增加,表明AGE-1和AGE-2石油醚部位可以促使大肠杆菌细胞发生坏死;与正常对照组相比AGE-1和AGE-2石油醚部位在其最低抑菌浓度下分别处理24 h能够促使大肠杆菌凋亡和坏死,提高了大肠杆菌细胞膜的通透性使Hoechst33342的透过率增大,且AGE-1的石油醚部位对大肠杆菌的作用大于AGE-2的石油醚部位。
2.6 扫描电子显微镜观察石油醚部位对大肠杆菌细胞膜的影响
采用了扫描电子显微镜观察石油醚部位对大肠杆菌表面形态的影响,结果见图5。图5(a)中对照组大肠杆菌培养24 h后菌体表面光滑,形态完整、饱满,呈现典型的短杆状,没有细胞膜破损及内容物的泄漏;图5(b)中31 μg/mL的AGE-1石油醚部位处理24 h后菌体发生变形、凹陷,细胞表面粗糙,菌体之间互相黏连,甚至有菌体发生解体;图5(c)中62 μg/mL的AGE-2石油醚部位处理24 h后菌体也发生变形和凹陷,细胞表面粗糙,菌体之间互相黏连;AGE-2石油醚部位处理组细胞受损情况小于 AGE-1石油醚部位处理组,该结果与培养液中电导率测定、细胞内容物泄漏测定结果以及激光共聚焦显微镜观察结果一致。细胞膜遭到破坏导致细胞表面粗糙,细胞内原生质泄漏导致菌体之间互相黏连,并发生变形和凹陷。以上结果表明AGE-1和AGE-2石油醚部位对大肠杆菌具有损伤作用,可以破坏细胞壁和细胞膜造成细胞原生质的泄漏。
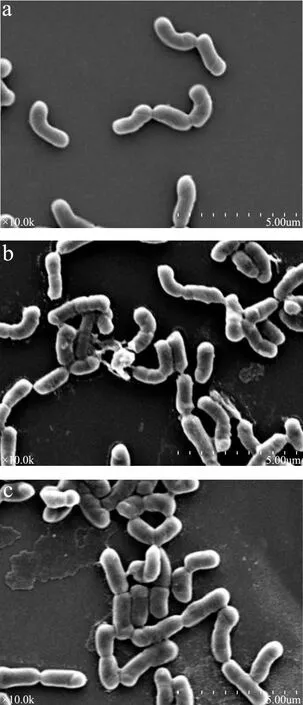
图5 处理24 h后大肠杆菌扫描电子显微镜图(×10000)Fig.5 SEM image of Escherichia coli after exposure for 24 h(×10000)
3 结论
3.1 本实验分析了AGE-1和AGE-2石油醚部位对大肠杆菌的最低抑菌浓度,发现AGE-1和AGE-2石油醚部位对大肠杆菌最低抑菌浓度分别为31 μg/mL和62 μg/mL。AGE-1和AGE-2的石油醚部位在其最低抑菌浓度下能够抑制大肠杆菌的生长发育,导致细胞内电解质和大分子物质的泄漏,并能对大肠杆菌细胞壁和细胞膜造成损伤,改变细胞膜的通透性,促使细胞凋亡或坏死,从而使大肠杆菌细胞表面粗糙,菌体之间互相黏连,细胞形态发生变形和凹陷。
3.2 课题组前期已经对两种自制老蒜提取物的抑菌活性以及可能的抑菌活性成分做了研究分析,发现AGE-1和AGE-2的石油醚部位含有多种具有二硫键的化合物如:二甲基三硫、二烯丙基二硫醚、3-乙烯基-1,2-二硫杂环己-4-烯、3-乙烯基-1,2-二硫杂环己-5-烯[8],研究发现具有二硫键的化合物是大蒜中主要的抑菌活性物质[6,7],这些具有二硫键的化合物可以与具有巯基的氨基酸发生反应产生竞争性抑制作用,阻碍含有巯基的氨基酸的正常利用,通过抑制细胞中蛋白质的正常合成起到抑制细菌生长的作用;具有二硫键的化合物还可以与不含巯基的氨基酸反应,影响一些酶的活性和一些生物过程[17],使其表现出较强的抑菌活性。前期实验还发现AGE-1和AGE-2的石油醚部位含有多种有机酸和酚类物质,这些物质可以阻碍细胞膜、细胞壁的合成,并阻碍微生物细胞能量代谢及发育[18]。实验中生长曲线测定结果验证了 AGE-1和AGE-2的石油醚部位可以抑制大肠杆菌的生物合成,培养液中核酸等大分子物质和电导率的测定结果,以及激光共聚焦显微镜和扫描电镜观察证实了 AGE-1和 AGE-2的石油醚部位可以通过损伤大肠杆菌的细胞壁和细胞膜,致使细胞凋亡和坏死达到其抑菌效果。

