紫薯多糖组分PSPP1-1对人胃癌SGC7901细胞的抑制作用
贾俊强,屈红森,吴琼英
(1.江苏科技大学 粮食学院,镇江 212004)(2.江苏科技大学 生物技术学院,镇江 212018)
甘薯为旋花科甘薯属蔓生草本植物,是世界第七大粮食作物[1].甘薯具有很强的环境适应能力,在我国南北地区广泛种植。据统计,我国甘薯年产约1.17亿t,占全世界甘薯总产量的90%左右[2].紫薯是一种薯皮紫黑色、肉质紫红色的甘薯品种,富含花青素、β-胡萝卜素和维生素等多种活性物质[3,4],具有较高的商业开发价值.
多糖是一种由醛糖和酮糖通过糖苷键连接组成的生物大分子化合物,普遍存在于植物、动物和微生物组织中.药理研究表明,多糖具有抗氧化、抗菌、抗肿瘤和提高免疫力等生物活性[5-7],在生物医药领域中备受青睐.课题组前期研究发现,紫薯中非淀粉性多糖含量为5.4%[8],其含量要高于药用植物槲寄生[9].通过对紫薯多糖分离和纯化,得到了具有显著抑制人胃癌SGC7901细胞增殖活性的杂多糖组分PSPP1-1,其平均分子量为33.3 kDa,由鼠李糖、木糖、葡萄糖和半乳糖按摩尔比17.5 ∶1.0 ∶2.7 ∶1.1组成[10],但尚不清楚该多糖组分的抗肿瘤机制.本研究通过观察PSPP1-1组分对SGC7901细胞的形态、生长周期、线粒体膜电位和凋亡相关基因表达等的影响,探讨了其诱导SGC7901细胞凋亡的机制.
1 实验
1.1 材料与试剂
人胃癌SGC7901细胞由江苏科技大学生物技术学院提供;噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、 二甲基亚砜(dimethyl sulfox-ide,DMSO)、胎牛血清、高糖DMEM培养基,胰酶 Gibco公司;Sybr Premix Ex Taq, Roche公司;Annexin V-FITC细胞凋亡检测试剂盒、细胞DNA含量检测试剂盒、细胞凋亡线粒体膜电位检测试剂盒,江苏凯基生物科技发展有限公司;其余试剂均为分析纯.
1.2 仪器与设备
Eppendof 台式冷冻离心机,德国Eppendorf公司;ND-1000核酸蛋白定量仪,美国NanoDrop公司;PCR仪,杭州朗基公司;FACSAria流式细胞仪,美国BD公司;超净工作台,杭州净化设备厂;JS-780凝胶成像系统,上海培清全自动凝胶成像系统;2300-2型二氧化碳培养箱,美国Sheldon公司;XDS-1B型倒置式显微镜,重庆光电仪器有限公司;CountStar自动细胞计数仪,北京康碧泉生物科技有限公司;S4800-II场发射扫描电子显微镜,日立高新技术国际贸易有限公司.
1.3 实验方法
1.3.1 细胞培养
将SGC7901细胞接种培养于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的高糖DMEM培养基中,培养条件为37℃、5% CO2.
1.3.2 紫薯多糖PSPP1-1的制备
紫薯粗多糖的制备:紫薯粉依次用石油醚脱脂和80%乙醇脱色后,用蒸馏水配成4%的悬浮液,然后用超声波在210 W下处理30 min,处理结束后用α淀粉酶(加酶量60 U/g)在66 ℃酶解1.5 h,离心收集上清液。将收集的上清液浓缩至初始体积的1/10后,加入3倍体积的95%乙醇,4 ℃静置约2 h后离心,收集沉淀,用95%乙醇洗涤2次后,用Savage方法[11]进行脱蛋白处理,最后冷冻干燥备用.
PSPP1-1组分的制备:根据课题组前期的研究报道制备PSPP1-1组分[10].将紫薯粗多糖依次用DEAE-52纤维素树脂和Sephadex G-100进行分离纯化;DEAE-52纤维素树脂洗脱条件为:依次用0、0.1、0.2、0.3和0.4 mol/L NaCl洗脱,洗脱速率1.0 mL/min;Sephadex G-100洗脱条件为:蒸馏水洗脱,洗脱速率0.5 mL/min.分离纯化后共得到3个洗脱组分(PSPP1-1、PSPP1-2和PSPP1-3).收集PSPP1-1组分用于后续研究.
1.3.3 抗肿瘤活性分析
采用MTT比色法测定多糖的抗肿瘤活性[12].SGC7901细胞(4×103个/孔)接种在96孔板中,在37 ℃、5% CO2下培养12 h后,分别加入质量浓度为100、200、300、400和500 μg/mL的PSPP1-1组分(以PBS为对照),培养48 h,每孔加入100 μL 1mg/mL MTT后,在37 ℃、5%CO2的培养箱中继续培养4 h,弃掉培养液,分别在各孔中加入100 μL DMSO,37 ℃振荡孵育10 min,在570 nm下测定吸光值,按下式计算多糖的抗肿瘤活性(抑制率用Y表示):
式中:A0为对照组的吸光值,A1为添加样品组的吸光值.
1.3.4 扫描电镜观察
取细胞培养液,经0.25%胰酶消化后离心,收集细胞沉淀,分别用500 μL PBS洗涤细胞2次,离心后收集细胞,将收集的细胞用预冷2.5%戊二醛溶液固定,待固定2.0 h后用移液器轻轻吸取固定液,分别用500 μL PBS洗涤2次,依次用4 ℃的10%、30%、50%、70%、90%和100%乙醇进行脱水,然后依次用4℃的30%、50%、70%和100%乙酸异戊酯乙醇溶液进行进一步脱水,脱水后的细胞经超临界干燥和真空喷镀处理后进行扫描电镜观察.
1.3.5 细胞周期检测
SGC7901细胞(4×103个/孔)接种在96孔板中,在37 ℃和5% CO2下培养12 h后加入PSPP1-1组分(以PBS为对照),细胞培养液中PSPP1-1组分的浓度为200 μg/mL,培养48 h后收集SGC7901细胞,用冷PBS洗涤2次.将收集的细胞用PBS调整细胞浓度为1×106/mL后,加入9倍体积的70%乙醇,-20 ℃固定12 h,离心收集细胞后重新悬浮于500 μL PBS中,加入100 μL RNase在37 ℃反应30 min,加入5 μL PI室温避光染色30 min后在激发波长488 nm检测.
1.3.6 细胞线粒体膜电位检测
按1.3.5中的方法进行SGC7901细胞的处理、培养与收集.然后将收集的1×106细胞用500 μL JC-1荧光染料工作液均匀悬浮,在37 ℃和5% CO2浓度下孵育15 min,室温离心收集细胞,用PBS洗涤2次,洗涤后的细胞重新悬浮在500 μL PBS后,利用流式细胞术进行分析.
1.3.7 荧光实时定量RT-PCR检测凋亡相关基因蛋白表达
总RNA的提取:将收集的细胞用10 mL冷PBS洗涤2次后空干,加1 mL冷Trizol混匀后室温静置 5 min,加入200 μL预冷的氯仿,涡轮震荡10 s后在冰盒上静置10 min,离心后吸取上层水相移至1.5 mL 离心管中,加入1 mL异丙醇后混匀,在冰盒上静置10 min,离心后弃上清液,加入1 mL 75%乙醇并混匀,离心后弃上清液,沉淀快速风干后加入20 μL DEPC水,混匀后在低温冰箱中保存备用.
逆转录反应条件:65 ℃热变性处理5 min,42 ℃转录反应60 min,在70 ℃下保持15 min终止反应.
RT-PCR检测:ATCB内参基因的上游引物为5’-CATGTACGTTGCTATCCAGGCT-3’,下游引物为3’-GGAGGGCATACCCCTCGTA-5’; TP53基因的上游引物为5’-TGGTAATCTACTGGGACGGAAC-3’,下游引物为3’-TGCTCGCTTAGTGCTCCCT-5’; Caspase-3基因的上游引物为5’-GAACTGGACTGTGGCATTGA-3’,下游引物为3’-CAAAGCGACTGGATGAACC-5’; Bax基因的上游引物为5’-AGAGGATGATTGCCGCCG-3’,下游引物为3’-TGCACAGGGCCTTGAGCA-5’; Bcl-2基因的上游引物为5’-CCATTTGGTGTTCGGAGTTTA-3’,下游引物为3’-TTCGCAGAAGTCCTGTGATGT-5’.反应条件为:95 ℃预变性5 min,1个循环;95℃变性10 s,60 ℃退火15 s,72 ℃延伸25 s,45个循环,琼脂糖凝胶电泳检测,凝胶成像系统分析扫描结果.
1.3.8 统计学分析
用Excel软件分析实验数据,结果以平均值±标准偏差表示.
2 结果与分析
2.1 PSPP1-1组分对SGC7901细胞的增殖抑制活性
采用MTT法测定不同浓度PSPP1-1对SGC7901细胞增殖的抑制率,结果如图1.由图可知,随着PSPP1-1质量浓度(C)的逐渐增加,抑制作用逐渐增强,呈现剂量依赖关系.单糖组成是影响多糖抗肿瘤活性的主要因素之一,抗肿瘤多糖通常由葡萄糖、半乳糖、甘露糖、阿拉伯糖、鼠李糖和木糖等单糖组成[13,14].紫薯多糖组分PSPP1-1是一种由鼠李糖、木糖、葡萄糖和半乳糖按照摩尔比17.5 ∶1.0 ∶ 2.7 ∶1.1组成的杂多糖[10],因此,PSPP1-1的抗肿瘤活性可能部分归因于其单糖组成.通过图中的回归方程,确定PSPP1-1抑制SGC7901细胞增殖的IC50为376 μg/mL.在多糖质量浓度为400 μg/mL时, PSPP1-1和霍山石斛多糖对SGC7901细胞增殖的抑制率分别约为61%和45%[15],这表明PSPP1-1抗肿瘤活性高于霍山石斛多糖.

图1 PSPP1-1组分对SGC7901细胞的抑制活性Fig.1 Inhibition of PSPP1-1 fraction on SGC-7901 cell proliferation
2.2 PSPP1-1组分对SGC7901细胞形态的影响
在200 μg/mL PSPP1-1处理下,SGC7901细胞在48 h培养过程中的形态变化见图2.当SGC7901细胞培养至2 h时,处理组与对照组的细胞数量和形态上并无明显差异,均呈现梭形形态,生长状态良好,当继续培养至12 h时,处理组的细胞数量增幅较小,且部分细胞轮廓模糊,出现细胞膜破裂,凋亡细胞数量增加;当继续培养至48 h时,处理组的细胞凋亡数量进一步增加,细胞膜破裂严重,细胞碎片明显增多.这说明PSPP1-1能够有效抑制SGC7901细胞的增殖.
为了进一步观察PSPP1-1处理后SGC7901细胞形态的变化,利用扫描电镜观察其微观形态,见图3.图中对照组细胞形态规则,表面附有绒毛和突起,细胞膜表面有大量微孔;处理组细胞明显皱缩,形状不规则,表面绒毛及微孔消失,并出现凋亡小体,这与A549细胞经白灵菇多糖处理后细胞的微观变化一致[16].这可能是由于多糖加入激活并促进细胞内蛋白酶的合成与释放,使细胞表面微管、绒毛水解,并堵塞表面微孔,防止进一步损伤,是一种细胞自我应激保护作用[16].
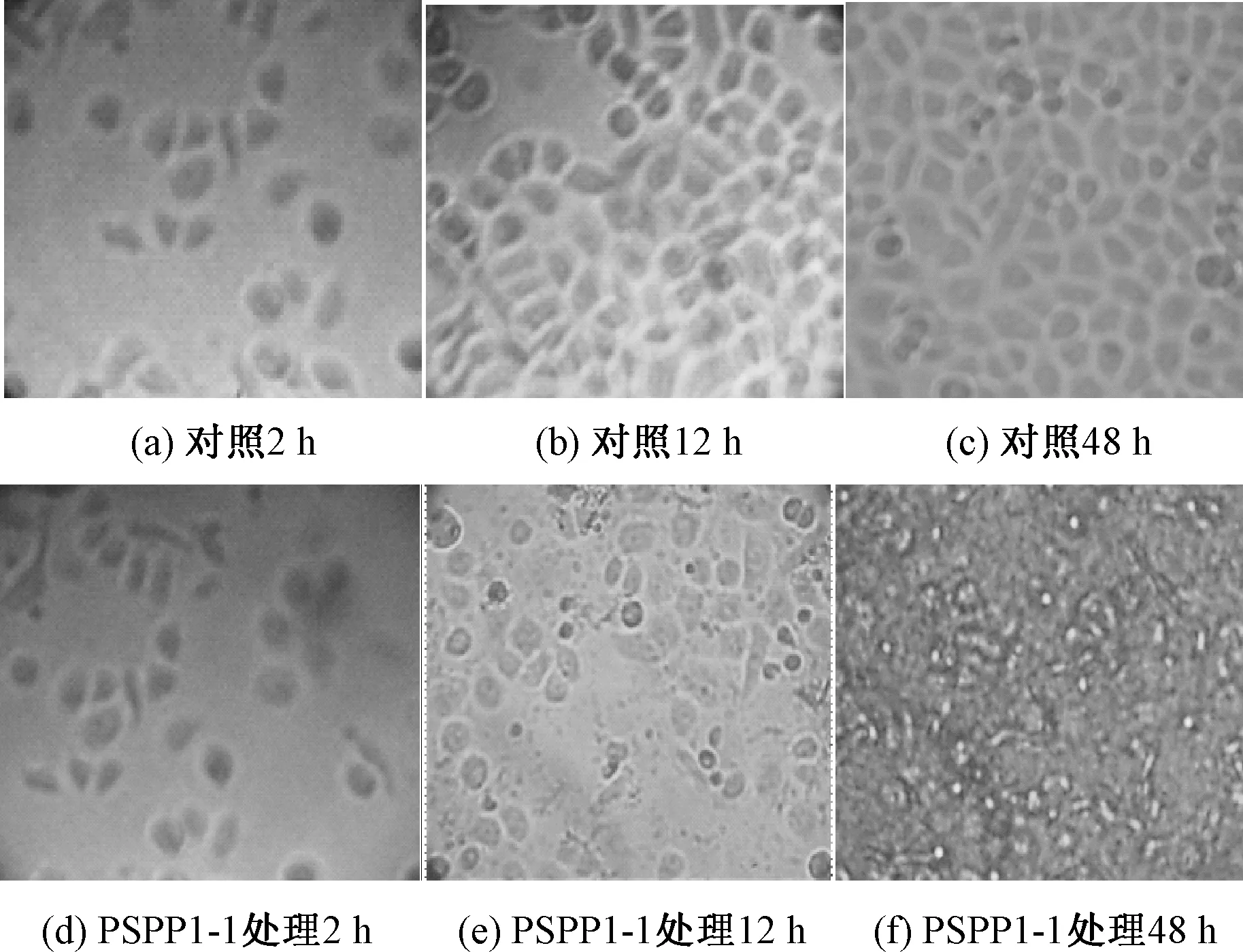
图2 倒置显微镜观察PSPP1-1组分处理后SGC7901细胞的形态变化Fig.2 Inverted microscope images of SGC 7901 cells after treatment with PSPP1-1 fraction

图3 PSPP1-1组分处理后SGC7901细胞的扫描电镜图Fig.3 SEM of SGC 7901 cells after treatment with PSPP1-1 fraction
2.3 PSPP1-1组分对SGC7901细胞周期及线粒体膜电位的影响
从图4可知,PSPP1-1(200 μg/mL)处理组SGC7901细胞在正常二倍体细胞G1/G0前出现了亚二倍体峰(Sub-G1),这是由晚期凋亡细胞DNA断裂形成的,是表明细胞凋亡的特征峰[17],进一步表明PSPP-Ⅰ能够诱导SGC7901细胞凋亡.
线粒体是细胞进行有氧呼吸和产生能量的主要场所,其病变会引起细胞信息传递受阻并促使细胞凋亡[18].PSPP1-1(200 μg/mL)处理组SGC7901细胞的线粒体膜电位变化如图5.从图中可知,对照组线粒体膜电位较高,绝大部分SGC7901细胞的线粒体内形成了能够发射红色荧光的JC-1多聚体,而经PSPP1-1处理后,一部分SGC7901细胞的线粒体内形成了能够发射绿色荧光的JC-1单体,SGC7901细胞的线粒体膜电位降低;细胞线粒体膜电位降低造成了线粒体功能损害,是引起细胞凋亡的主要因素[19],这表明PSPP1-1处理诱导SGC7901细胞凋亡.
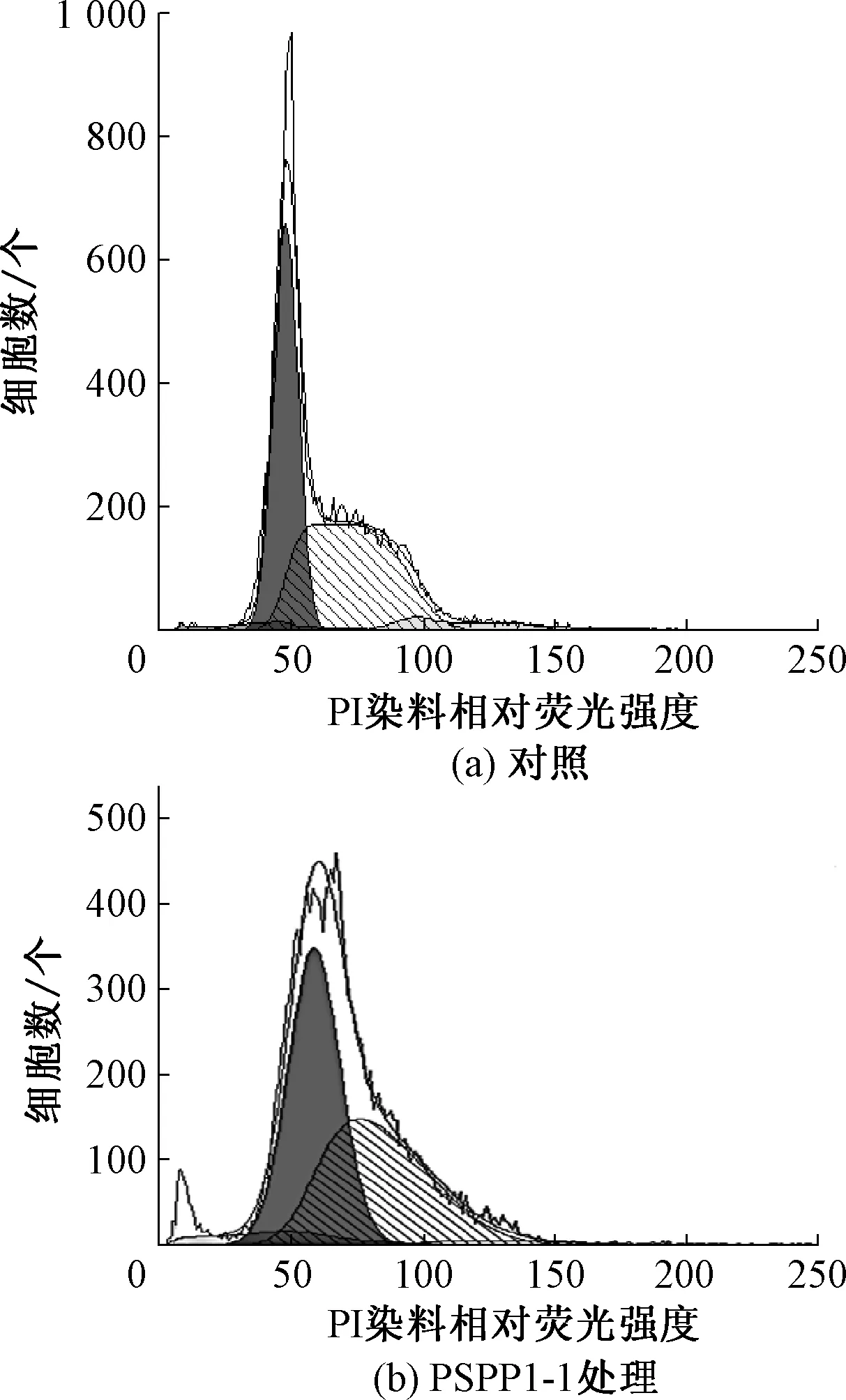
图4 PSPP1-1组分对SGC7901细胞周期的影响Fig.4 Effect of PSPP1-1 fraction on cell cycle of SGC7901 cells

图5 PSPP1-1组分对SGC7901细胞线粒体膜电位的影响Fig.5 Effect of PSPP1-1 fraction on mitochondrial transmembrane potential of SGC7901 cells
2.4 PSPP1-1组分对SGC7901细胞凋亡基因表达的影响
RT-PCR分析表明,PSPP1-1组分对SGC7901细胞凋亡基因表达有显著影响(图6),PSPP1-1可以上调SGC7901细胞凋亡基因TP53、Caspase-3和Bax的表达,同时能够明显下调凋亡基因Bcl-2表达.PSPP1-1对凋亡基因TP53、Caspase-3和Bax表达的上调随着培养时间的延长而提高,当培养至36 h时,其表达分别是初始水平(0h)的2.6、3.1和2.0倍.PSPP1-1对凋亡基因Bcl-2表达的下调随着培养时间的延长而降低,当培养至36 h时,其表达仅为初始水平(0h)的0.45倍.

图6 PSPP1-1组分对SGC7901细胞凋亡基因表达的影响Fig.6 Effect of PSPP1-1 fraction on apoptotic gene expression of SGC7901 cells
现代研究表明,TP53为肿瘤抑制基因,其编码蛋白的p53蛋白通过监控细胞生长及基因组而抑制肿瘤细胞形成,当细胞受到刺激后p53蛋白表达上调,激活p21蛋白,进而阻止Rb蛋白的磷酸化和细胞周期的进行,可以阻滞细胞于G1期[20].Caspase-3是一种半胱氨酸蛋白酶,它与细胞凋亡密切相关,在被凋亡信号启动后,Caspase-3被激活,并酶切其特异的底物,通过影响特定信号分子直接参与细胞早期凋亡启动、信号传递及晚期凋亡效应[21].Bax与Bcl-2共同调节细胞的凋亡,Bcl-2是最重要的凋亡抑制因子,Bcl-2 蛋白酶通过阻止细胞色素C从线粒体释放起到抑制细胞凋亡作用,Bax 是促进细胞凋亡因子,Bax蛋白酶通过向线粒体传递上游的凋亡信号起到促进凋亡的作用[22].与对照组相比,PSPP1-1处理后SGC7901细胞Bax/Bcl-2比率也发生了显著变化,说明PSPP1-1可能通过线粒体通道诱导细胞凋亡;另外,PSPP1-1也通过上调TP53和Caspase-3的蛋白表达,共同诱导SGC7901细胞凋亡.
3 结论
紫薯多糖组分PSPP1-1具有良好的抑制胃癌SGC7901细胞活性的作用,其抑制SGC7901细胞增殖的IC50为376 μg/mL,PSPP1-1处理后,SGC7901细胞形状变得不规则,表面绒毛及微孔消失,细胞线粒体膜电位降低,细胞出现凋亡;凋亡基因表达分析结果表明,PSPP1-1可通过增加Bax/Bcl-2比率,提高TP53与Caspase-3的蛋白表达共同诱导SGC7901细胞凋亡.

