初发糖尿病足溃疡患者的生存预后研究*
莫泽纬,陈道雄,全会标,陈开宁,高勇义,王斐,陈存仁,张华川
(海南省人民医院 内分泌科,海南 海口 570311)
糖尿病足溃疡(diabetic foot ulcer, DFU)是糖尿病患者严重慢性并发症之一,DFU年发病率2.2%~6.3%,19%~34%的糖尿病患者在其一生中至少发生一次DFU[1],25%~90%糖尿病患者的下肢截肢与DFU相关,DFU约花费糖尿病患者20%~40%的医疗资源[2]。DFU已成为导致糖尿病患者住院、截肢主要原因。糖尿病患者发生DFU后病死率升高,1、3、5和10年累积病死率分别为15.4%、33.1%、45.8%和70.4%[3],死亡风险是无DFU患者的2~4倍[1,4]。目前国内尚无较大样本量的糖尿病足溃疡患者生存预后的详尽研究,本研究通过对住院的初发DFU患者的随访,分析患者的生存率、影响生存预后的高危因素,为临床工作提供参考。
1 资料与方法
1.1 一般资料
选取2010年1月-2016年12月在海南省人民医院住院的609例初发DFU患者资料,所有患者均为符合1999年WHO诊断标准的2型糖尿病患者;DFU诊断标准按《糖尿病足国际临床指南》,并排除近期内有重大外伤、中毒、严重心、肝、肾功能不全、恶性肿瘤晚期者。
1.2 研究方法
1.2.1 收集基线临床资料 制定调查表,收集年龄、性别、吸烟史、糖尿病病程、DFU病程、Wagner分级、合并症及并发症,包括:糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)、糖尿病视网膜病变(diabetic retinopathy, DR)、糖尿病肾病(diabetic nephropathy, DN)、周围动脉病变(peripheral arterial disease, PAD)、 心 血 管 病(cardiovascular disease,CVD)、脑血管病、高血压、血脂异常等。
1.2.2 实验室检查 测定空腹血糖(fasting blood glucose, FBG)、 餐 后 2 h血 糖(2-hour postprandial glucose, 2 hPG)、糖化血红蛋白(haemoglobin A1c,HbA1c)、三酰甘油(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、 血尿素氮(blood urea nitrogen, BUN)、肌酐(Creatinine,Cr)、24 h尿微量清蛋白排泄率(24 h urinary albumin excretion rate, 24 h UAER)。
1.2.3 诊断标准 糖尿病足Wagner分级:0级,有发生足溃疡高危因素,目前无足溃疡;1级,皮肤局部有浅表溃疡,临床上无感染;2级,溃疡深达肌肉、肌腱,无脓肿或骨感染;3级,溃疡伴深部脓肿和骨髓炎;4级,局限性坏疽(足趾、足跟或前足背);5级,全足坏疽;Wagner 1~5级纳入本研究。截肢:下肢任意部位的横向解剖平面的离断。DPN:踝反射和/或膝反射异常,10 g尼龙丝检查异常,神经传导速度(NCV)异常,需排除其他病因所导致的神经病变。DN:Ⅰ期,肾小球滤过率明显增高;Ⅱ期,24 h UAER间歇性增高,肾小球滤过率轻度增高;Ⅲ期,持续性微量清蛋白尿,24 h UAER为20 mg~300 mg;Ⅳ期,24 h UAER>300 mg;V期为尿毒症期。DR:由眼科专科医师进行眼底检查后做出诊断。PAD:足背动脉和/或胫后动脉未扪及搏动,测定踝肱指数<0.9。高血压:指非同日3次测量血压≥140/90 mmHg或既往有高血压病史,目前正在使用降压药物治疗。CVD:指患者既往有明确心肌梗死或心绞痛、缺血性心肌病等病史或冠状动脉CTA或冠状动脉造影提示冠状动脉狭窄>75%。脑血管病:包括既往明确的缺血性及出血性脑卒中、TIA病史或入院后头颅CT或MRI检查明确的卒中。血脂异常(符合任意一项):HDL-C≤1.04 mmol/L,TG≥1.76 mmol/L,TC>5.6 mmol/L,LDL-C>3.37 mmol/L。
1.2.4 随访资料收集 通过查阅患者门诊及再次住院病历、死亡登记卡、与患者及家属进行电话随访等方法,每3~6个月随访1次,随访至2017年6月30日,以患者死亡或随访截止日期为观察终点。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,两组间比较用t检验,计数资料以构成比表示,比较采用χ2检验,用Kaplan-Meier生存曲线估计生存率,Log-rank检验分析影响生存预后的高危因素,将有统计学意义的因素进入Cox风险比例模型进行多因素分析,死亡风险值以HR值和95%CI形式表示,P<0.05有统计学意义。
2 结果
2.1 总体生存情况
522例患者(85.7%)完成随访,平均随访(3.475±1.690)年,存活288例(55.2%),死亡234例(44.8%),平均生存时间(4.720±0.120)年。生存曲线显示:中位生存期5.030年,1、3和5年累积生存率分别为89.8%、72.5%和50.4%。见图1。
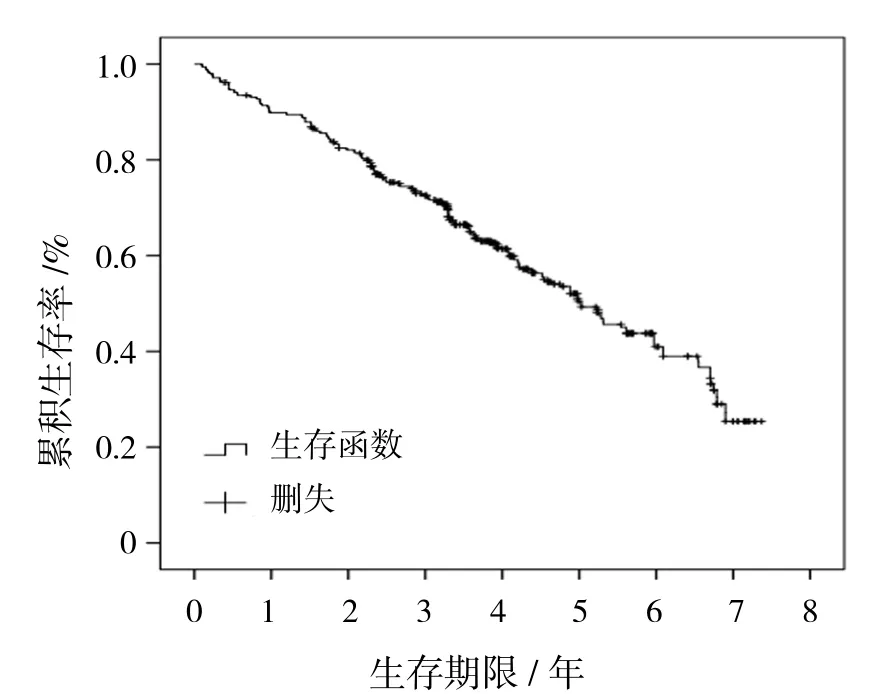
图1 总体生存曲线
2.2 基线临床资料
522例患者平均年龄(66.6±9.8)岁,平均糖尿病病程(10.7±6.5)年,DFU病程(2.5±2.3)个月。死亡组与存活组比较,患者年龄大、糖尿病病程长,差异有统计学意义(P<0.05);Wagner 3~5级、DN、PAD、CVD死亡组与存活组比较患病率升高,差异有统计学意义(P<0.05);两组DFU病程差异无统计学意义(P>0.05),两组男性、吸烟、HbA1c(>8%)、截肢、DPN、DR、脑血管病、高血压、血脂异常的比例差异无统计学意义(P>0.05)。见表1。

表1 糖尿病足溃疡患者基线临床特征
2.3 影响DFU患者生存因素分析结果
生存分析Log-rank检验进行单因素分析显示:老龄(年龄≥60岁)、糖尿病病程(≥10年)、Wagner 3~5级及合并DN、PAD、CVD的患者累积生存率降低,差异有统计学意义(P<0.05)(见表2和图2~7)。Cox比例风险回归模型进行多因素分析显示:年龄、Wagner分级、DN、PAD、CVD是DFU患者死亡的高危因素(见表3、4)。

表2 影响糖尿病足溃疡患者生存预后单因素分析
续表2
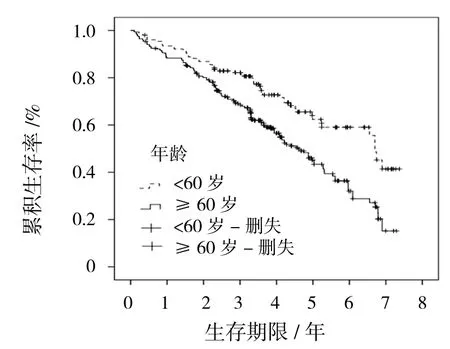
图2 不同年龄生存曲线
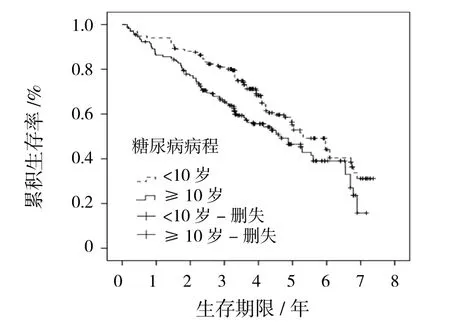
图3 不同糖尿病病程生存曲线

图4 Wagner分级生存曲线
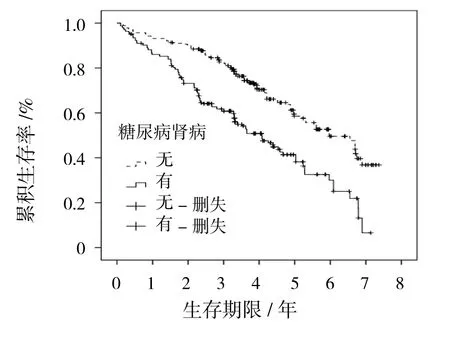
图5 DN生存曲线
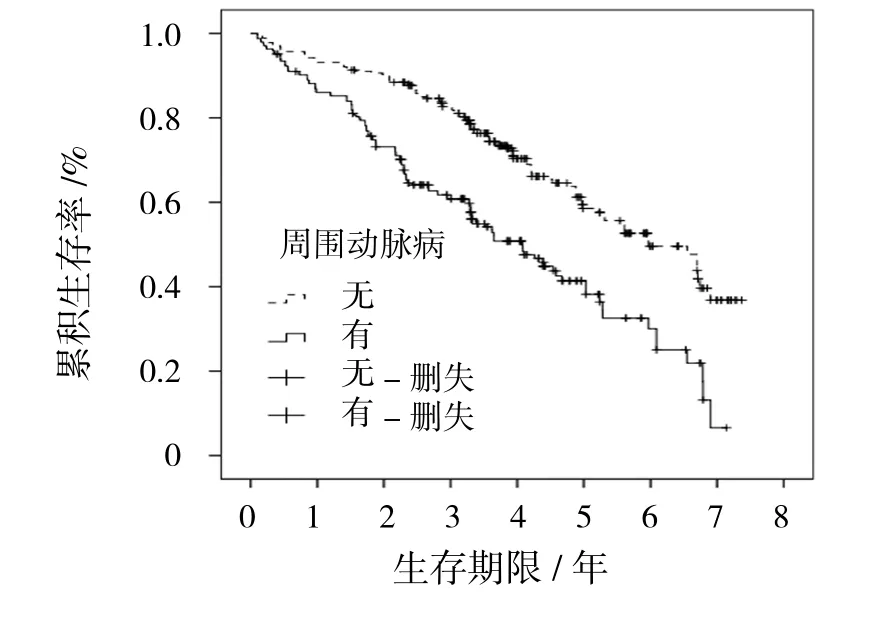
图6 PAD生存曲线

图7 CVD生存曲线

表3 Cox回归分析因素赋值

表4 影响糖尿病足溃疡患者生存预后的多因素Cox回归分析
3 讨论
糖尿病足是指糖尿病患者因下肢远端神经异常和不同程度的血管病变导致的足部感染、溃疡和/或深层组织破坏。本研究显示,初发DFU患者年龄大,男性为主,糖尿病病程长,血糖控制差,DPN、DN、DR、PAD、CVD及脑血管病等糖尿病慢性并发症及合并症高发。在长达7.5年的随访后,522例患者有288例(55.2%)存活,1、3和5年生存率分别为89.8%、72.5%及50.4%,国内外报道DFU患者1、3和5年生存率分别为90.2%~69.0%、74.1%~46.0%和54.2%~32.0%,DFU患者生存预后甚至比某些肿瘤差[5-6]。
目前导致DFU患者病死率增高的原因尚不清楚。研究表明[1,6-7],年龄是死亡的危险因素,年龄每增加1岁DFU患者死亡风险增加5%~8%,超过65岁的DFU患者死亡风险增加2.99倍。本研究以老龄(≥60岁)患者为主,死亡组患者年龄更大,老龄DFU患者死亡风险增加了47.6%。老龄患者由于生理机能减退,糖尿病微血管和大血管病变、神经病变等慢性并发症患病率增高,整体血糖控制差,机体免疫功能降低,感染发生率高而导致病死率增高[8]。足部病变程度对长期病死率的影响尚存在争议,李翔等[5]研究显示,足部病变程度不是影响患者远期死亡的高危因素。本研究显示,65.9%为严重足部病变(Wagner 3~5级),Wagner 3~5级患者1、3和5年存活率低于Wagner 1~2级患者,差异有统计学意义。一项纳入66323例DFU退伍军人的研究显示[9],严重足部病变与死亡相关,足部坏疽及骨髓炎患者的死亡风险较轻度足部病变患者的死亡风险分别增加了70%和9%。XU等报道[10],住院的DFU患者心功能不全发生率随着足部病变加重而升高,由Wagner 0级的33.6%升至Wagner 5级的87.0%。严重足部病变导致的全身的炎症反应、败血症、截肢、活动能力降低、心功能不全、合并的CVD和肾功能不全等均增加了死亡风险[9,11]。
CVD和下肢PAD均是常见的糖尿病大血管并发症,本研究中CVD和PAD患病率高达44.4%和65.9%,死亡组CVD和PAD患病率高于存活组,差异有统计学意义。发生DFU后由于糖脂代谢紊乱、细菌感染、创伤、大量炎症因子生成等导致全身炎症反应增强,凝血-纤溶系统平衡失调、血小板黏附、血液黏滞度增高、血管内皮功能紊乱,从而加速血栓形成、血管闭塞[12-13]。既往研究表明[4-5,14],CVD是糖尿病及DFU患者死亡主要原因及死亡高危因素,25.8%~65.0% DFU患者死于CVD,合并CVD患者死亡风险是非CVD患者的2~4倍[13-15]。PINTO等[16]报道,DFU患者还有更高的心室壁活动异常、左心室肥厚、左室射血分数降低、心电图异常等亚临床CVD病变,在多种高危因素作用下亚临床CVD发展为CVD。此外,心功能不全、心血管自主神经病变、心律失常均增加死亡风险。GHANASSIA等[15]研究显示,虽然50%的DFU患者死于CVD,但CVD不是死亡的预测因素,考虑在基线下资料比较时死亡组与非死亡组患者CVD患病率差异无统计学意义,而在随访中死亡组患者CVD新发病率更高导致死亡增加。PAD是全身动脉粥样硬化症在下肢的局部表现,虽然其直接导致死亡可能性小,但本研究表明,合并PAD的患者生存率降低,死亡风险增加69.3%。在糖尿病患者中研究的报道[17],即使是无症状的PAD患者其死亡风险是无PAD患者的2~3倍,CVD死亡风险增加67%。MORBACH等[3]对247例DFU患者进行13年的随访研究发现,PAD是患者截肢和死亡的高危因素,PAD导致截肢风险增加34.34倍,死亡风险增加44%,PAD患者1、3和5年死亡率分别为21.9%、44.1%和58.8%,高于无PAD患者的7.5%、19.7%和30.2%,差异有统计学意义。GIUGLIANO等[18]研究表明,PAD预示着全身其他部位血管出现更弥漫的动脉硬化、血栓形成、闭塞病变,以及更高的心脑血管病患病率及相关的死亡风险,行下肢血管介入治疗可以通过改善下肢血管内皮细胞功能和血供,还可以减轻全身炎症反应,延缓全身动脉粥样硬化的发展,从而降低心血管事件发生率和病死率。
HE等报道[19],DFU合并肾功能不全患者死于CVD的风险是肾功能正常者1.55~5.25倍;中重度肾功能不全患者足部治愈率降低、截肢率升高,全因死亡风险是肾功能正常患者的3.54~4.45倍。一项在DFU截肢患者中的研究显示[20],终末期DN、透析患者大截肢率为71.1%,高于肾功能正常患者的46.2%;肾功能正常患者1、3、5和10年生存率分别为85.6%、73.2%、60.3%和32.9%,慢性肾功能不全患者1、3、5和10年生存率分别为76.6%、56.3%、40.9%和17.0%;慢性肾功能不全患者死亡风险增加46%,透析患者生存预后更差,死亡风险增加2.9倍。本研究显示死亡组DN的患病率高于存活组,DN患者1、3和5年存活率分别为86.0%、60.8%和41.4%,中位存活期为4.080年,同样显示DN是预测死亡的高危因素,究其原因可能为DN患者尤其是中重度肾功能不全患者常合并贫血、低蛋白血症,机体免疫力低下,易发生严重感染[20];缺血性心脏病、充血性心力衰竭、脑血管病、周围神经病变等发生率高于肾功能正常患者;透析患者还可因透析相关的并发症导致死亡;DFU本身导致全身炎症级联反应,加重慢性肾功能不全影响预后[13]。
与既往的研究不同,本研究虽然截肢率高达16.9%,但未显示截肢增加死亡风险,考虑本研究的DFU患者多为截趾为主的小截肢,而大截肢与死亡风险相关性更高。高血糖是诱发糖尿病慢性并发症和影响足病预后的主要原因,但本研究未显示出HbA1c与长期生存预后相关,考虑入组时无论是死亡组还是存活组,患者的血糖均控制差,长期的高血糖导致的慢性并发症与死亡更密切。
本研究表明,住院的初发DFU患者已合并多种糖尿病慢性并发症和合并症,患者病死率高、平均生存时间短,尤其老龄、严重足部病变的患者还需评估心血管、下肢血管及肾脏病变等。患者应戒除长期静坐、吸烟等不良生活方式,控制血糖、血压,规律使用调脂、抗血小板聚集、改善循环、营养神经等药物,并需多学科联合治疗,方能改善生存预后[8]。本研究由于样本量大,随访时间长,部分患者失联或仅能通过电话随访获得生存资料,在后续的研究中将改善研究方法以完善相关资料的收集。

