细胞因子预处理对体外扩增NK细胞活性的影响*
申重阳,幸倚帆,谭小虎,陈勇军
(1.成都中医药大学 基础医学院,四川 成都 611137;2.成都康景生物科技有限公司,四川 成都 611130)
自然杀伤细胞(natural killer cell, NK)是机体重要的免疫细胞,约占外周血单个核细胞总数的10%~20%,主要分布在外周血、淋巴结、脾、骨髓中,可以通过多种趋化因子作用迁移到炎症部位。NK细胞可以不依赖于树突状细胞的抗原递呈作用,清除MHC-I分子阴性的肿瘤细胞以及被病毒感染的细胞。因此NK细胞逐渐成为肿瘤免疫治疗领域的热点,用于控制肿瘤细胞的生长和转移[1]。然而由于缺乏有效的NK细胞体外扩增手段,影响NK细胞在肿瘤过继细胞免疫治疗中的治疗效果。因此,应用更加有效的方法提高NK细胞的数量及活性是临床急需解决的问题。
目前常用的NK细胞体外扩增方式为使用多种细胞因子的联合刺激。白细胞介素(interleukin, IL)IL-2+IL-15的联合刺激是体外扩增NK细胞的常用方案,IL-15可以维持NK细胞的分化和扩增,抵抗IL-2介导的NK细胞凋亡[2-3]。IL-2可以促进NK前体细胞和NK成熟细胞的生长,增加NK细胞分泌的细胞溶解酶的表达量,增强NK细胞毒性[4]。此外,IL-12和IL-18也常用于NK细胞的体外培养。不同于IL-2和IL-15,IL-12通过促进NK细胞释放干扰素γ(interferon gamma, IFN-γ)和肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α),从而达到抑制肿瘤血管新生以及通过肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand,TRAIL)和细胞凋亡因子配体(fas ligand, FasL)介导肿瘤细胞凋亡的效果[5];IL-18能够通过上调NK细胞表面IL-12受体(IL-12 receptor, IL-12R)的表达,增强IL-12效果[6-7]。然而如何优化细胞因子组合方式、添加时间点进而使得NK细胞的体外扩增达到最佳效果,现有的研究并没有一致的结论[8-10]。本研究选取IL-2、IL-12、IL-15和IL-184种细胞因子的3种不同组合和添加方式,对健康志愿者或肿瘤患者的外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)进行体外培养,并分析所得NK细胞的扩增倍数、细胞表型以及对肿瘤细胞的杀伤活性,以找到一种最有效的NK细胞体外培养方案。
1 材料与方法
1.1 试剂
RPMI 1640培养基和胎牛血清(FBS)购自美国Thermo Fisher公司,ALyS505NK-AC、ALyS505NK-EX培养基和CD16抗体购自日本株式会社细胞科学研究所,rhIL-2、rhIL-12、rhIL-15、rhIL-18购自美国Pepro Tech公司,流式抗体CD3-FITC、CD25-PE、CD45-PerCP、CD56-PE购自美国BD Biosciences公司,CFSE购自日本同仁化学研究所,7-AAD购自美国Bio Legend公司,淋巴细胞分离液购自天津市瀚洋生物制品科技有限责任公司,肿瘤细胞株K562购自上海中科院细胞库,ELISA试剂盒购自美国eBioscience公司。
1.2 细胞培养
健康志愿者5例,年龄26~43岁。霍奇金淋巴瘤患者2例,年龄分别为46岁和59岁。采集外周血50 ml,使用淋巴细胞分离液分离PBMCs。使用NK细胞培养基进行培养,细胞因子添加方式如下:A组(IL-2+IL-15联合添加),第1天,用CD16抗体包被的T25培养瓶进行培养,加入7 ml NK细胞初始培养基(含10%灭活人自体血清的ALyS505NK-AC培养基,并加入rhIL-21000 u/ml、rhIL-1520 ng/ml);每3天补液,第14天,收集细胞进行后续表型和功能实验。B组(IL-2+IL-12+IL-15+IL-18联合添加),其他操作过程与A组相同,rhIL-12添加浓度为10 ng/ml,rhIL-18添加浓度为50 ng/ml。C组(IL-12+IL-15+IL-18预处理/IL-2):先使用细胞因子rhIL-12(10 ng/ml)+rhIL-18(50 ng/ml)+rhIL-15(1 ng/ml)预处理16 h,然后PBS洗涤2次,之后再按照与A组相同的方式进行后续培养,只添加rhIL-2(1000 u/ml)。
肿瘤细胞株K562用含10%胎牛血清的1640培养液,于37℃,5%二氧化碳CO2培养箱中培养。
1.3 检测细胞表型
收集培养7和14 d的各组NK细胞,将细胞浓度调为1×107个/ml,标志荧光抗体CD3-FITC、CD45-PerCP、CD56-PE,各组设同型IgG阴性对照,4℃避光孵育30 min后,PBS漂洗2次,然后使用流式细胞仪进行检测分析。对于CD25的检测,细胞孵育CD25-PE荧光抗体,方法同上。
1.4 ELISA检测IFN-γ的释放
取培养14 d后的NK细胞作为效应细胞,K562细胞为靶细胞,按照10∶1的比例在96孔板中进行共培养,每组NK细胞做3个复孔。共培养24 h后收集培养上清,按照试剂盒说明书操作方法进行检测。
1.5 NK体外杀伤K562肿瘤细胞实验
NK细胞培养至第14天时,收集细胞进行CFSE标记。主要操作步骤如下:收集NK细胞并计数,使用CFSE标记缓冲液(生理盐水+1% FBS)洗涤1次,并重悬细胞(细胞密度为1×107个/ml);加入CFSE(终浓度为200 nmol),置于37℃细胞培养箱孵育15min,生理盐水洗涤2次,并用NK细胞培养基重悬细胞。在6孔板中加入0.5 ml K562细胞(1×105个/孔),然后按比例(5∶1、10∶1和20∶1)加入标记好的NK细胞(总体积为1 ml),同时设置只有NK细胞或K562细胞的对照孔,置于培养箱共培养4 h。
收集共培养的细胞,使用7-AAD染色法检测K562细胞的死亡率,主要操作如下:离心收集细胞,弃上清,加入100 μl染色缓冲液重悬细胞,然后加入5 μl 7-AAD混匀,室温避光放置15 min。同时设置不加7-AAD的阴性对照。然后加入400 μl染色缓冲液,使用流式细胞仪进行检测。
1.6 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,方差分析差异有统计学意义后,再采用LSD-t检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 细胞因子预处理对NK细胞扩增能力的影响
分别在细胞培养过程中的第7天和第14天取样,离心弃上清,加入适量PBS重悬后用血细胞计数板计数。计数统计结果见图1A所示,在第7天时,A、B、C组中细胞扩增倍数分别为(25.726±5.057)、(26.156±6.106)和(29.471±7.616),各组间差异无统计学意义(F=0.313,P=0.743)。第14天时,3组细胞扩增倍数分别为(92.637±10.522)、(104.939±12.414)和(114.361±15.825),虽然C组的细胞扩增倍数略高于A和B组,但是组间差异无统计学意义(F=2.073,P=0.207)。由于现有的NK体外扩增方法得到的细胞除了NK以外,还有一定数量的T细胞和NKT细胞,因此使用流式细胞仪的方法检测样品中CD3和CD56的表达情况,并对其中NK细胞(CD3-CD56+)比例进行了统计学分析,结果显示随着培养时间的延长,各组培养方式下NK细胞比例也不断增加,第7天时NK细胞比例分别为(31.048±4.428)%、(37.965±2.560)%和(40.277±5.229)%,第14天时NK细胞比例分别为(54.375±6.803)%、(57.033±6.773)%和(62.697+6.232)%(见图1B),但是各组间NK细胞比例差异无统计学意义(F=3.879和1.241,P=0.083和0.354)。以上结果表明,细胞因子预处理的培养方式(C组)能较好的扩增NK细胞,与传统培养方式(A和B组)的扩增能力相当。
2.2 细胞因子预处理对NK细胞活性的影响
在第7天时取样进行流式细胞仪检测,细胞因子预处理的方式C组可以提高CD25(IL-2Rα)的表达(阳性率为69.1%),而A和B组培养方式几乎不能诱导CD25的表达(见图2A)。ELISA检测NK细胞与靶细胞(K562)共培养后上清中IFNγ的释放情况,结果显示各组细胞的IFNγ释放量分别为(43.2±8.7)、(63.4±10.3)和(137.4±17.5)ng/ml,经单因素方差分析各组间差异有统计学意义(F=32.490,P=0.001)。进一步两两比较表明,与A和B组比较,C组中细胞IFNγ释放量较多(t=6.982和5.151,P=0.002和0.007),而A和B组细胞间IFNγ释放量无明显变化(t=2.609,P=0.060)(见图2B)。

图1 3种培养方式的扩增倍数和NK细胞比例
2.3 细胞因子预处理对NK细胞杀伤能力的影响
采用体外杀伤实验进一步证实NK细胞的活性。首先,使用CFSE标记效应细胞(Effector, E),结果显示200 nmol的CFSE可以很好的标记NK细胞(阳性率为>99%),并且几乎不会对NK细胞产生毒性(见图3A)。然后,将标记过的NK细胞与靶细胞K562(Target, T)按照5∶1、10∶1和20∶1的比例共培养,并通过7-AAD染色的方法统计K562细胞的死亡率,C组的NK细胞杀伤K562细胞的流式细胞仪检测结果见图3B(E∶T=5∶1)。对各组细胞在不同比例下的杀伤结果进行统计学分析,显示预处理方式得到的NK细胞的杀伤能力最强,各比例下的杀伤率分别为(27.967±9.434)%、(65.233±9.069)% 和(82.967±6.804)%,并且在10∶1和20∶1的比例时,各组细胞杀伤率之间差异有统计学意义(F=8.416和9.191,P=0.018 和 0.015)(见图 3C)。
2.4 肿瘤患者NK细胞扩增效果
从2例霍奇金淋巴瘤患者的外周血中分离PBMCs,然后使用细胞因子预处理的方法进行NK细胞的扩增培养,14 d后取样分析NK细胞的得率。流式细胞仪分析结果显示(见图4),2例肿瘤患者PBMCs均能成功扩增NK细胞(CD3-CD56+),其阳性率分别为62.63%和50.24%,而其他细胞(T细胞和NKT细胞)的比例较低。

图2 3种培养方式下CD25的表达及NK细胞释放IFNγ的比较
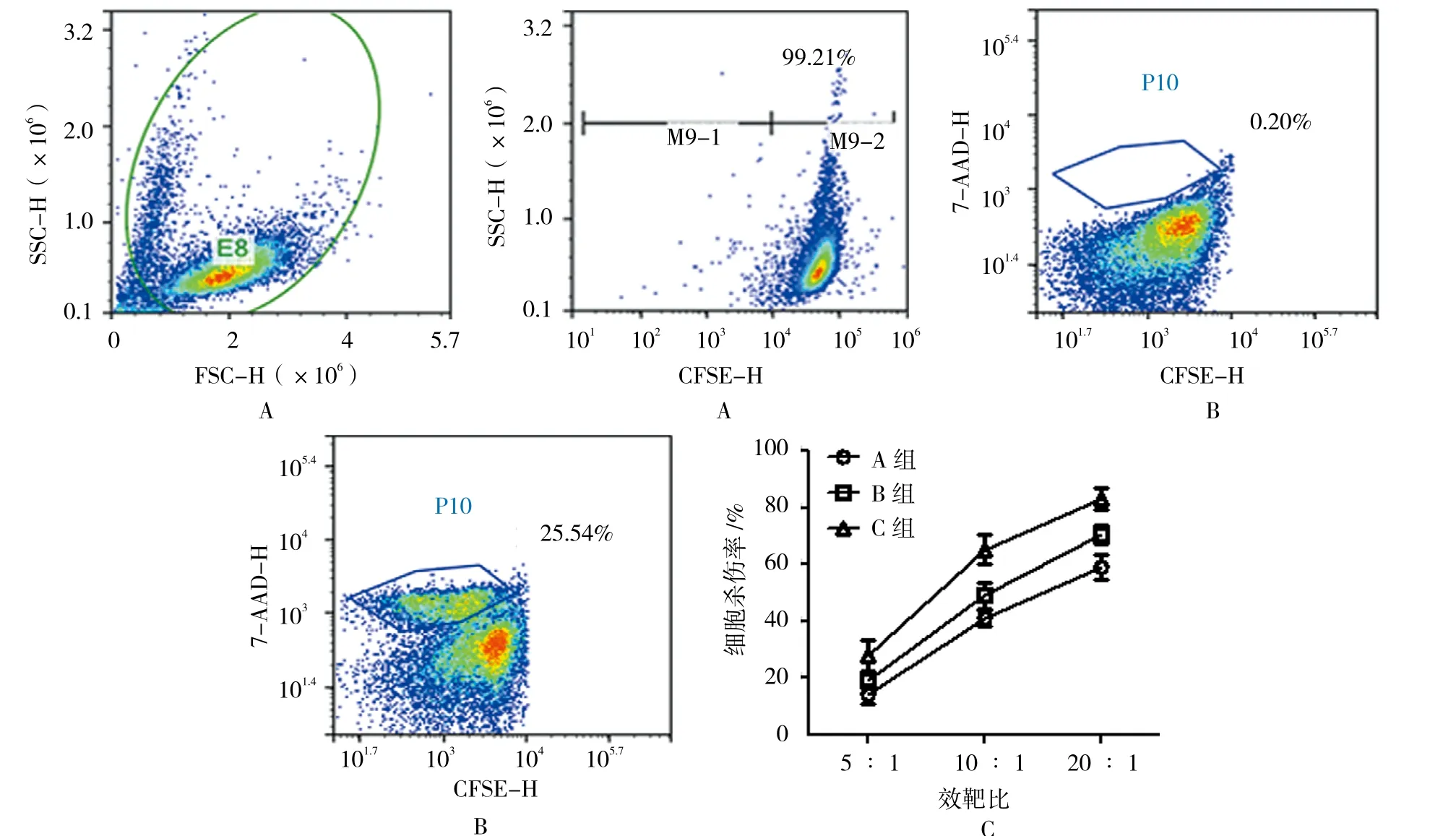
图3 3种培养方式下NK细胞杀伤活性的比较

图4 肿瘤患者NK细胞的扩增效果
3 讨论
IL-12、IL-15、IL-18等细胞因子对NK细胞的功能具有重要的作用。在NK细胞培养过程中添加不同种类的细胞因子,从而发展出多种培养方法[11]。不同的细胞因子组合和剂量等略有不同,而添加方式通常为持续添加。在体外扩增过程中持续添加细胞因子不但增加了培养成本,而且由于IL-12细胞因子会造成严重的不良反应,因此要限制IL-12在NK细胞培养过程中的使用量以及残余量。有研究发现[12-13],IL-12、IL-15和IL-18可能是通过促进IFN-γ mRNA的合成以及蛋白质的表达参与NK细胞早期的免疫应答,并不涉及NK细胞的生长及活性维持。本研究探索了使用细胞因子预处理的培养方法,先使用IL-12、IL-15和IL-183种因子刺激16 h,然后使用只添加IL-2的培养基进行培养。结果显示IL-12、IL-15和IL-18预处理的培养方法能很好地扩增NK细胞,细胞扩增倍数和NK细胞比例与传统的持续添加细胞因子的培养方式相当。NK细胞的生长依赖于IL-2信号通路,而IL-2的复合体形式决定了信号通路的敏感性,以及细胞因子刺激NK细胞活性的能力[14]。本研究发现,IL-12、IL-15和IL-18预处理能上调细胞表面CD25(IL-2Rα)的表达,从而NK细胞表面可形成IL-2Rα/β/γ复合体,大大提高NK对于细胞因子刺激的敏感性,降低了细胞因子的使用量。值得注意的是,预处理的培养方式获得的NK细胞的活性(IFNγ的释放量和体外杀伤K562肿瘤细胞的能力)显著提高。此外,IL-12+IL-15+IL-18预处理的培养方法还能够有效扩增肿瘤患者自身的NK细胞。因此,相对于传统培养方式下扩增的NK细胞,使用IL-12、IL-15和IL-18预处理的培养方式得到的NK细胞在临床上具有更大的优势。

