秦艽的原生质体培养
张改娜, 史国安, 侯典云
(河南科技大学农学院,河南洛阳 471023
秦艽(GentianamacrophyllaPall.)为龙胆科龙胆属多年生草本植物,是我国的传统中药和国家重点保护的野生药材之一[1],主产于陕西、甘肃、四川、内蒙古等地。秦艽以其干燥根入药,其味辛、苦、平,有祛风湿、清湿热、止痹痛之功效[2],其主要有效成分为龙胆苦苷(gentiopicro side),具有良好的保肝、健胃、利胆、抗炎、抗菌等作用[3-7]。近年来,由于秦艽的需求量猛增,使其被过度采挖,致使野生秦艽资源处于濒危状态,秦艽虽有栽培品种,但也因产量有限而使得近年来的价格不断上涨。组织培养技术已经在药用植物上得以广泛应用,并已成为保护濒临灭绝的野生药用资源和生产替代品的关键手段。原生质体培养导致基因水平的变异是普遍的现象[8],这种变异为植物育种提供了新的途径[9]。
制备原生质体常用的植物材料一般有叶片、子叶、下胚轴及愈伤组织等[10-12]。本研究对秦艽愈伤组织诱导和原生质体培养及再生进行了试验,以期获得性状优良的愈伤组织,同时研究原生质体分离和再生的条件,为进一步开展秦艽大规模细胞培养及秦艽的品质改良工作奠定基础。
1 材料与方法
1.1 试验材料
秦艽种子,采集于陕西省陇县的秦艽种植基地。
1.2 试验方法
1.2.1 外植体的处理 将于4 ℃保存2周的秦艽种子用75%乙醇处理30 s,再用0.1%氯化汞处理6 min,最后用无菌水冲洗5遍,接种到1/2MS固体培养基上萌发。取无菌幼苗的嫩叶用来诱导愈伤组织,诱导愈伤组织的培养基为MS固体培养基,其中附加了2 mg/L 2,4-二苯氧基乙酸(2,4-D)、0.2 mg/L 6-苄氨基嘌呤(6-BA)、3%蔗糖和0.65%琼脂,pH值为5.8~6.0,继代培养基为MS固体培养基,其中附加了1.5 mg/L 2,4-D、0.5 mg/L 6-BA、500 mg/L水解酪蛋白(CH)、3%蔗糖和0.65%琼脂,pH值为5.8~6.0。取疏松的黄色颗粒状愈伤组织用于游离原生质体。
1.2.2 原生质体的游离与纯化 将继代6~16 d的约1 g松软的淡黄色颗粒状愈伤组织放于10 mL酶混合液中游离。酶混合液组成成分为2%纤维素酶(Cellulase Onozuka R10)、1%半纤维素酶和0.5%果胶酶、0.05 mol/L CaCl2、0.4 mol/L甘露醇和0.1% 2-吗啉乙磺酸(MES)。原生质体的游离和纯化方法同文献[13]。
1.2.3 原生质体的培养 将纯化的原生质体置于6 cm大小的玻璃培养皿中,悬浮于含有不同植物生长调节物的DPD液体培养基中,依次调节其密度为2×105、3×105、4×105、4×105个/mL,采用配方为1.5 mg/L 2,4-D+0.5 mg/L 6-BA+0.3 mol/L甘露醇+2%蔗糖+500 mg/L 水解酪蛋白的DPD液体培养基进行培养。定期观察培养过程中原生质体的生长分裂状况。相对分裂频率以培养15 d时发生分裂的原生质体数占植板上存活的原生质体总数的比例(百分数)表示。每次随机检查20个视野,每个处理至少重复3次。原生质体的活力用酚藏花红染色法测定[14]。
1.2.4 再生愈伤组织的形成与分化 将获得的肉眼可见的颗粒状愈伤组织转移至pH值为6.0、附加了2%蔗糖与 2 mg/L 2,4-D、0.2 mg/L 6-BA的DPD固体培养基中,培养温度为(25±2)℃,光照度为40 μmol/(m2·s),每天光照 10 h。然后放入含有不同植物生长调节剂组合的MS分化培养基(表1)上进行分化。培养条件为温度(25±2) ℃、光照度400 μmol/(m2·s)。
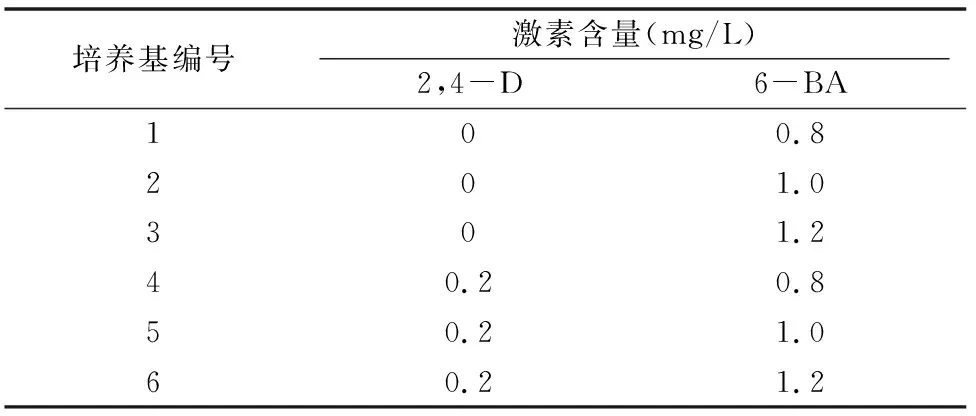
表1 不同植物生长调节剂组合
2 结果与分析
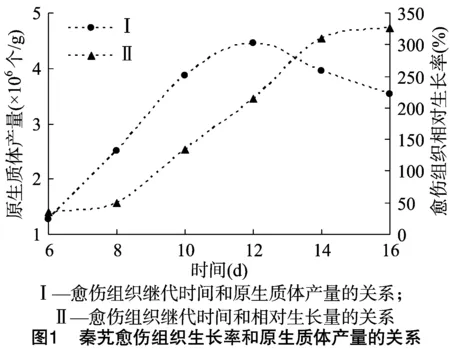
2.1 不同继代培养时间的愈伤组织对原生质体产量的影响
将由秦艽嫩叶诱导获得的愈伤组织在MS固体继代培养基上进行继代培养,培养过程中观察到愈伤组织逐渐呈淡黄色疏松颗粒状,可以认为是进行原生质体游离的适宜材料。将愈伤组织转入新鲜培养基,当取材时间不同时,游离原生质体的产量表现出一定的差异。由图1可以看出,无论是刚转入培养基的愈伤组织,还是生长16 d后的愈伤组织,分离原生质体的产量都较低。而继代后生长10~12 d的愈伤组织处于旺盛增殖状态,原生质体的产量和活力均较高,1 g愈伤组织最多可分离出4.5×106个原生质体,原生质体活力在80%以上。由此可见,大叶秦艽继代12 d时比较适合用于分离原生质体。
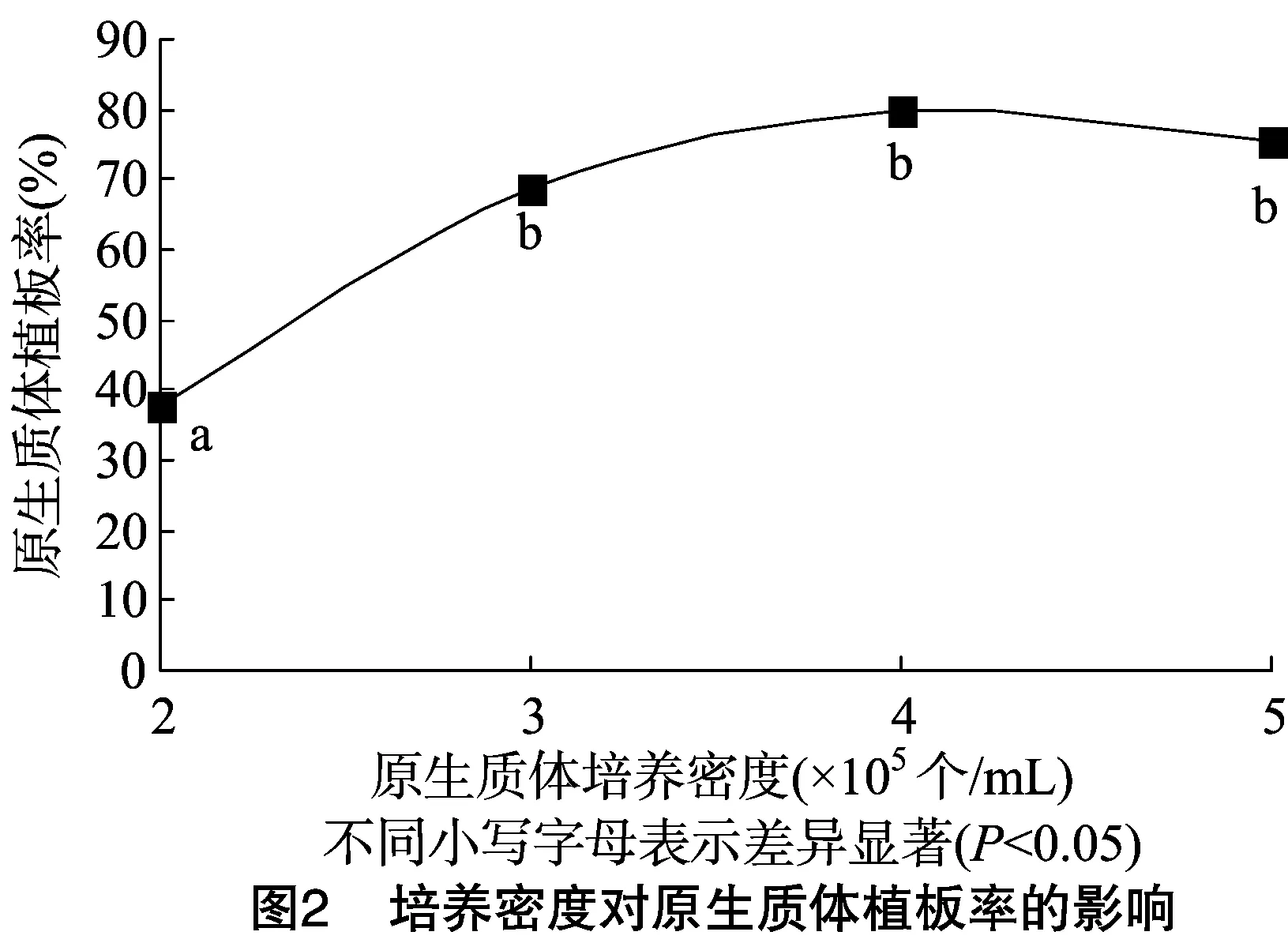
2.2 培养密度对原生质体培养的影响
不同原生质体培养密度对秦艽原生质体植板率的影响不同,过低或过高的原生质体培养密度都会导致秦艽原生质体植板率下降。由图2可以看出,在秦艽原生质体培养过程中,低密度(2×105个/mL)条件下的植板率在37%左右;而原生质体密度达到4×105个/mL时,秦艽的植板率明显提高,接近80%;当培养密度继续升高时,植板率开始有所下降。
2.3 原生质体来源的愈伤组织形成和试管苗的分化
本研究结果显示,原生质体在附加了1.5 mg/L 2,4-D、
0.5 mg/L 6-BA、0.3 mol/L甘露醇、2%蔗糖和500 mg/L水解酪蛋白的DPD液体培养基中的持续分裂效果最好。图3-b、图3-c为秦艽原生质体细胞第1次分裂显微观察结果;图3-d为原生质体细胞第2次分裂的显微观察结果;图3-e、图3-f、图3-g为原生质体多次分裂形成的细胞团。待原生质体形成的小细胞团生长至2 mm大小的愈伤组织(图3-h)时,转至“1.2.4”节中提到的DPD固体培养基中进行扩增。
将扩增后的愈伤组织放入表1的6种培养基中进行培养,结果表明,2,4-D对大叶秦艽的分化影响差异不大,而当6-BA浓度等于1.2 mg/L时,再生幼苗出现玻璃化(表2)。其中5号培养基是大叶秦艽由胚状体分化的最佳培养基,将扩增后的愈伤组织继代转入该培养基25 d,即可看到大量的胚状体产生(图4-a),分化率可达96.55%。
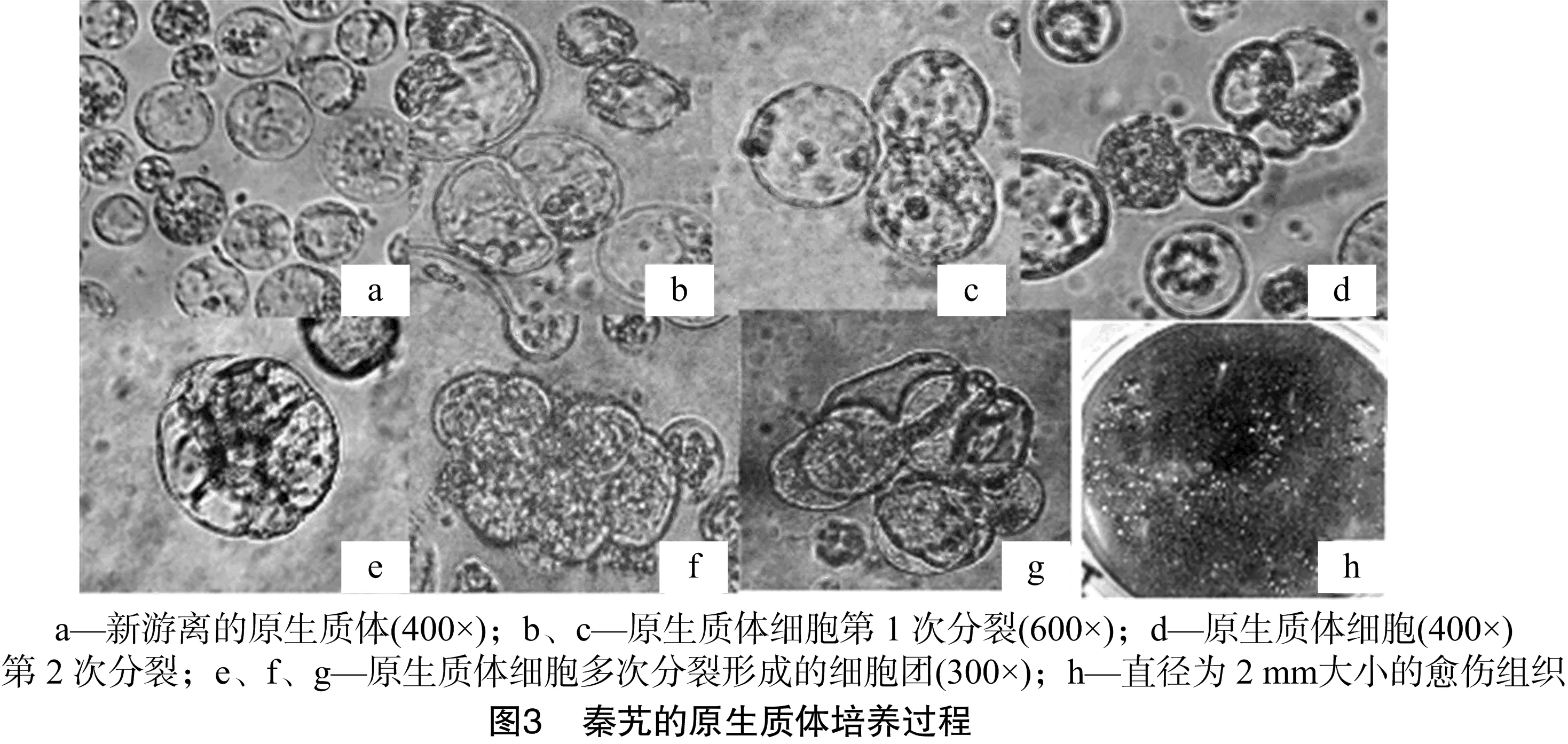
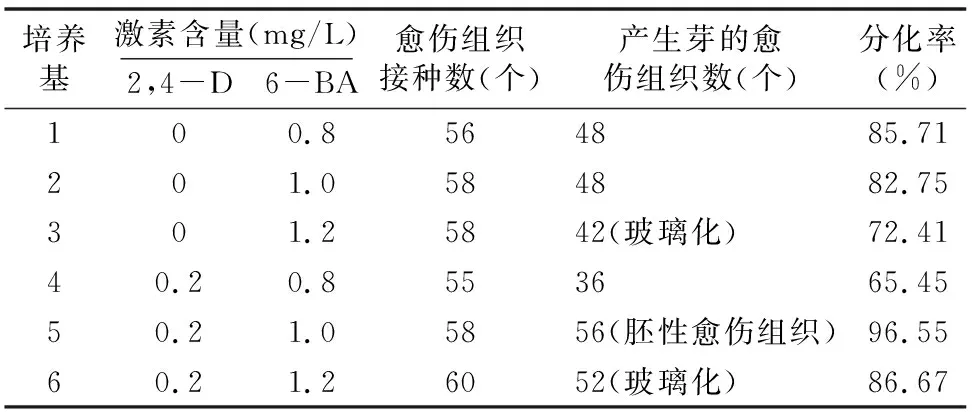
表2 不同植物生长调节剂组合对愈伤组织分化的影响
将形成含2张子叶的幼苗(图4-b)放入含有0.1 mol/L 6-BA、0.1 mol/L NAA,pH值为5.8的MS固体培养基上,可以同时促进苗和根的生长(图4-c),至苗高为5 cm左右时,可进行炼苗,将其移入土壤中(图4-d)。

3 讨论与结论
在原生质体游离和纯化过程中,酶的种类、浓度、酶解时间及酶液的渗透压对于原生质体的产量和活力都有很大影响[8,15],但是进行原生质体游离的供体材料——愈伤组织的状态对于原生质体的游离也是至关重要的,适合原生质体游离的愈伤组织培养时间与植物材料有关,大多数植物材料愈伤组织以在旺盛分裂期的游离原生质体最佳[16]。本试验采用含2%纤维素酶、1%半纤维素酶和0.5%果胶酶及 0.05 mol/L CaCl2、0.4 mol/L甘露醇和0.1% 2-吗啉乙磺酸的混合酶液进行秦艽原生质体游离,在供体愈伤组织接种 10~12 d时,获得的原生质体产量和活力较高,产量(鲜质量)为4.5×106个/g,活力达80%以上。
合适的原生质体培养密度和液体培养条件,是原生质体游离纯化后能够保持较高分裂频率的保证[17-18]。本试验采用DPD液体培养基,培养基中除了含有合适的生长调节剂(1.5 mg/L 2,4-D和0.5 mg/L 6-BA)外,还增加了 0.3 mol/L 甘露醇和2%蔗糖作为渗透调节剂和碳源,另加入了500 mg/L水解酪蛋白用于促进原生质体的生长和分裂。随着原生质体细胞生成细胞壁、分裂成为细胞团,所需的渗透压降低,因此在转入固体DPD培养基时,将甘露醇去除。
原生质体来源的愈伤组织的再分化,也遵循组织培养中的激素模式,在生长素和分裂素比例恰当时,分裂频率较高。本试验结果显示,过高的6-BA浓度(≥1.2 mg/L)会引起再生苗的玻璃化,而在过低的6-BA浓度(≤0.8 mg/L)下,分化率较低。当生长素2,4-D浓度为0.2 mg/L、细胞分裂素 6-BA浓度为1.0 mg/L时,分裂率达到了最高值,为96.55%。

