禾谷镰刀菌真菌毒素DON生物合成途径及调控机制研究进展
侯 瑞, 金巧军
(1.贵州大学林学院,贵州贵阳 550025; 2.西北农林科技大学植物保护学院,陕西杨凌 712100
小麦赤霉病是世界性病害,在亚洲、欧洲、北美洲等均有大流行的报道[1]。在我国,该病主要流行于长江中下游冬麦区、华南冬麦区、黄淮流域冬麦区、东北三江平原春麦区等,能够造成全国范围的大面积减产,是我国小麦的主要病害和重点防治对象。小麦赤霉病不但会造成小麦的严重减产,而且可在感病麦粒中产生大量的真菌毒素,不仅影响小麦的品质和质量,而且严重危害人、畜的健康[2]。真菌在生长极其缓慢、完全停止或遇到外界压力的情况下可产生次生代谢产物——真菌毒素[3]。禾谷镰刀菌是引起小麦赤霉病的主要病原菌[4],其产生的真菌毒素主要包括脱氧雪腐镰刀菌烯醇
(deoxynivalenol,简称DON)和玉米烯酮(zearalenone,ZEN)。单端孢霉烯族化合物(trichothecenes,简称TCTCs)分为类型A和类型B。类型A包含毒素T-2、HT-2、二乙酰蔗草镰刀菌烯醇(diacetoxyscirpenol,简称DAS)等;类型B包含DON及其乙酰化衍生物(3Ac-DON/15Ac-DON)和雪腐镰刀菌烯醇(14-O-acetyl DON-4-nivalenol,简称NIV)等[5]。B型单端孢霉烯化合物类毒素能够延缓或终止蛋白的生物合成[3]。ZEN是在禾谷镰刀菌侵染玉米时检测到的毒素,是唯一对人类来说比较温和的真菌毒素[6]。单端孢霉烯族化合物和玉米烯酮的化学式见图1。

1 禾谷镰刀菌真菌毒素DON生物合成途径
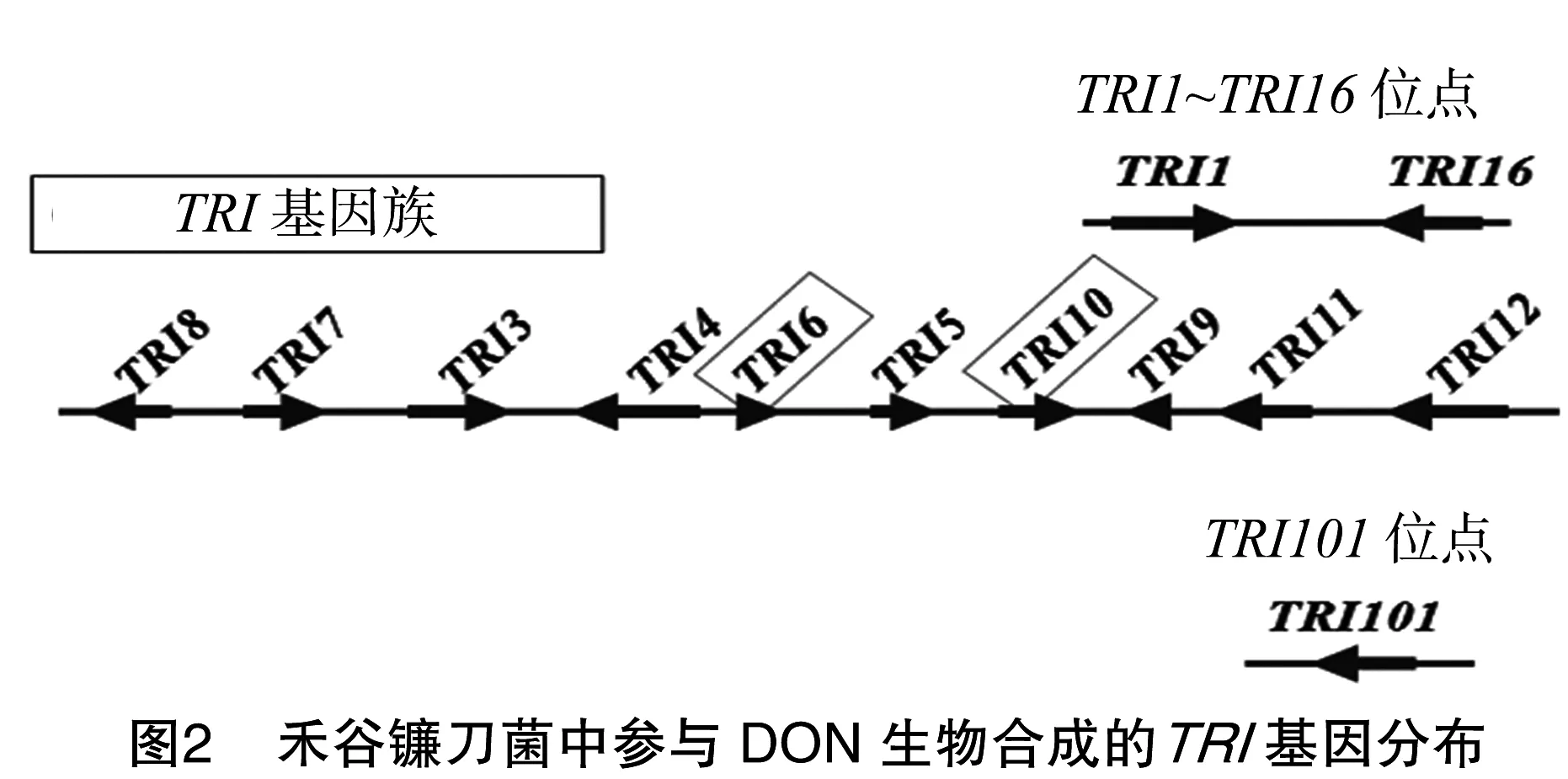
禾谷镰刀菌中单端孢霉烯前体合成酶基因TRI5是DON生物合成第1步的关键酶。tri5基因敲除突变体致病力显著下降,病害症状仅在接种的小穗处发生[7],表明DON毒素的产生并不是初侵染所必须的,但对病原菌在穗部的扩展却非常重要。在过去十多年中,参与DON生物合成的TRI基因都已被鉴定出。除了TRI101和TRI1~TRI16外,主要的TRI基因全都在一个TRI基因簇上(图2)。其中,TRI6和TRI10基因调控所有TRI基因的转录,TRI6基因是主要的转录因子,TRI10基因起次要作用。TRI6可与TRI10的启动子相结合并控制其表达,TRI6的表达是自我调控的[8]。TRI1、TRI4、TRI11基因都能编码P450单氧合酶[9-11];TRI3基因能够进行C-15的乙酰化[12];TRI7基因能编码4-O-乙酰基转移酶[13];TRI8基因能够进行C-3的脱乙酰化作用[14];TRI12基因是单端孢霉烯族毒素输出泵基因,能够参与毒素的转运[15];TRI19基因的功能尚未知;TRI101基因编码单端孢霉烯乙酰转移酶[16](表1)。
2 真菌毒素DON生物合成的调控机制
目前,国内外对真菌毒素DON生物合成途径的研究已经比较深入,对此途径和次生代谢的总体调控是人们关注的重点。真菌毒素合成受到内因和外因2个方面的调控,即由外界环境因素和体内调控网络的共同调控[17-18]。对于大多数真菌来说,某一类的环境因子,如pH值、碳源、氮源、H2O2等因子能够和体内一些信号通路共同调节真菌毒素的合成[19-21]。
禾谷镰刀菌中酸性pH值可诱导真菌毒素DON生物合成酶TRI5基因的表达,从而增强DON的生物合成。中性或碱性pH值条件下则不能合成DON,TRI基因的表达也检测不到[22-23]。而pH值调控DON的合成是通过真菌体内高度保守的pH值调控系统完成的。pH值调控系统的核心为pH值代谢调节因子FgPAC1基因(FGSG_12970),也是转录因子基因。敲除禾谷镰刀菌中的FgPAC1基因可增强酸性条件下早期TRI基因的表达和增加DON生物合成量的积累。且主要的TRI家族调节基因TRI6和TRI10基因启动子区都有潜在的FgPAC1基因的结合位点5′-GCCAAG-3′[23-24]。因此,在禾谷镰刀菌中,FgPAC1基因反向调控TRI家族基因的表达和DON的生物合成。
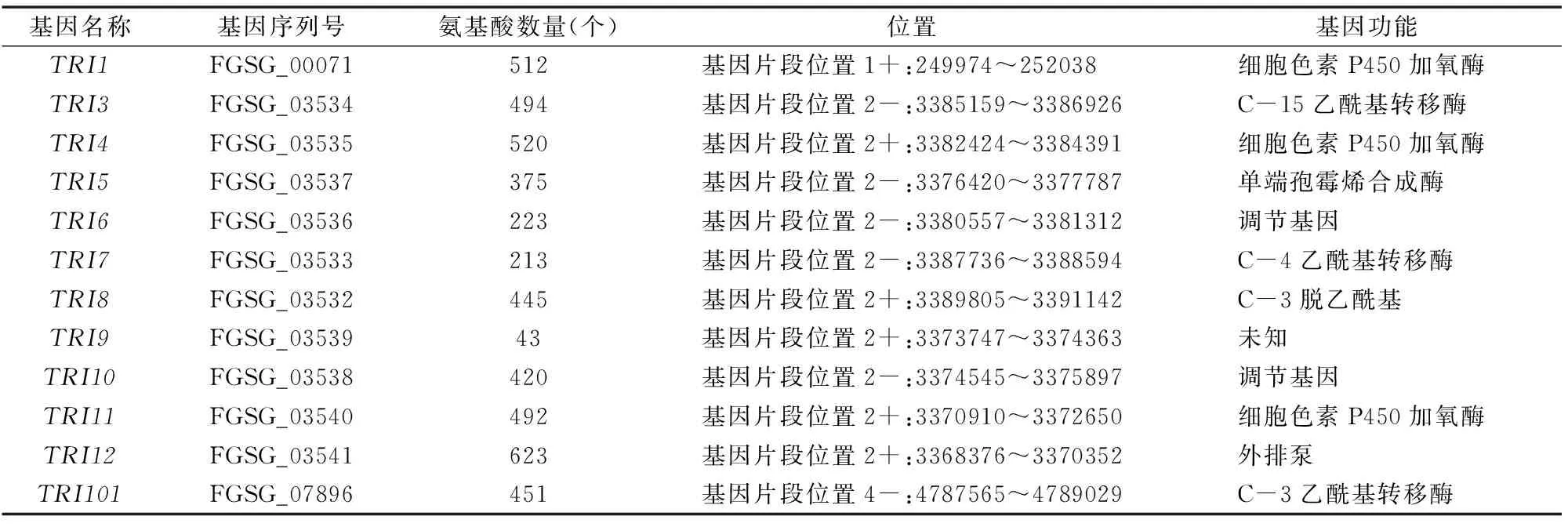
表1 DON生物合成中心基因和功能
酵母和丝状真菌中葡萄糖是优先碳源,会被优先吸收利用。只有在环境中没有葡萄糖时,酵母和丝状真菌才会使用其他碳源。如果优先碳源存在,就会抑制相关基因的转录和表达,即碳代谢抑制(carbon catabolite repression,简称CCR)[25]。禾谷镰刀菌中,蔗糖能够强烈诱导TRI4/TRI5基因的表达和真菌毒素DON的生物合成,但葡萄糖不能。同时,在蔗糖作为唯一碳源的培养基中额外加入葡萄糖,不能抑制DON的生物合成,说明CCR没有参与DON的生物合成[26]。目前,禾谷镰刀菌中也没有关于CCR相关调节基因参与DON生物合成的相关报道。
胍基丁胺和精氨酸等氮源可强烈诱导禾谷镰刀菌中TRI5基因的表达和真菌毒素DON的生物合成,但在相关诱导培养基中额外加入铵态氮则能抑制真菌毒素DON的生物合成[27-28]。铵态氮源是优先氮源,因此氮代谢抑制(nitrogen metabolite repression,简称NMR)参与了DON的生物合成。禾谷镰刀菌中氮代谢抑制的调控中心为调节因子FgAREA基因(FGSG_08634),也是转录因子基因,在铵态氮源缺乏时,FgAREA基因会被诱导表达,使次级碳源能够被利用。敲除禾谷镰刀菌中的FgAREA基因能够抑制TRI5、TRI6、TRI10基因的表达,同时DON生物合成量大幅降低[28-30]。Hou等发现在禾谷镰刀菌中,FgAREA基因能够与TRI10基因直接互作,且主要的TRI家族基因启动子区都有潜在的FgAREA基因的结合位点5′-HGATAR-3′(其中H代表A、T、C,R代表A或G)[28]。因此,在禾谷镰刀菌中,FgAREA基因正向调控TRI家族基因的表达和DON的生物合成。参与氮代谢抑制的另一个调节因子FgNMR1基因(FGSG_07197)在铵态氮源充足时,能够抑制FgAREA基因的表达。但敲除禾谷镰刀菌中的FgNMR1基因,对DON生物合成并没有影响。同时,Nasmith等发现禾谷镰刀菌中TRI6基因也可以通过FgNMR1基因的表达来调控FgAREA基因[31]。
低浓度的H2O2能够刺激禾谷镰刀菌中真菌毒素DON的生物合成[32]。DON生物合成家族TRI基因的表达在禾谷镰刀菌侵染小麦的早期能够被检测到[33],而氧迸发是植物常见的防卫反应,因此禾谷镰刀菌可能是把寄主产生的活性氧作为一个触发器来刺激DON的生物合成,因为DON本身也是重要的植物性毒素和毒力因子[3]。禾谷镰刀菌中,参与过氧化物压力调控相关的转录因子基因为FgATF1(FGSG_10142)、FgSKN7(FGSG_06359)、FgYAP1(FGSG_08800),虽然这3个基因都起着对氧分压容忍的作用,但敲除FgATF1基因并不能够影响DON的生物合成,敲除FgSKN7基因能够降低DON生物合成量,而且降低了H2O2对TRI基因表达水平的诱导[34],敲除FgYAP1基因能够使DON生物合成家族TRI基因表达量升高,同时DON生物合成量大幅增加[35]。因此,在禾谷镰刀菌中,FgSKN7基因正向调控TRI家族基因的表达和DON的生物合成,而FgYAP1基因反向调控TRI家族基因的表达和DON的生物合成。
禾谷镰刀菌中,促分裂原活化蛋白激酶(mitogen-activated protein kinase,简称MAPK)、环腺苷酸单磷酸-蛋白激酶A(cyclic adenosine phosphate-protein kinase A,简称cAMP-PKA)、雷帕霉素(target of rapamycin,简称TOR)等信号通路也都能够调控真菌毒素DON的生物合成。MAPK信号通路能够调节细胞的生长、分化和对环境的应激适应等多种重要的病理过程。禾谷镰刀菌MAPK信号通路包含3个磷酸化途径——Mgv1、Gpmk1、FgHog1磷酸化途径。Mgv1磷酸化途径的3个中心激酶基因[FgBck1(FGSG_06326)、FgMmk2(FGSG_07295)、FgMgv1(FGSG_10313)]被敲除后都会严重影响禾谷镰刀菌侵染和产毒,突变体仅在接种点发病,几乎检测不到DON生物合成量[36]。破坏MAPK信号通路的Gpmk1磷酸化途径同样也能够影响病原菌在小麦穗部的定殖和扩展[37],Gpmk1磷酸化途径的3个中心激酶基因[FgSte11(FGSG_05484)、FgSte7(FGSG_09903)、Fgpmk1(FGSG_06385)]被敲除后,DON生物合成量急剧降低[36-37]。FgHog1磷酸化途径能够调控渗透压调节信号,参与FgHog1磷酸化途径的中心激酶基因包括FgHOG1(Fg09612)、FgPBS2(Fg08691)、FgSSK2(Fg00408),这3个基因的敲除突变体都能够使DON生物合成量降低[38]。
cAMP-PKA信号通路能够调控真菌的生长发育和致病机制[39],禾谷镰刀菌中编码蛋白激酶A催化亚基的为FgCPK1(FGSG_07251)、FgCPK2(FGSG_08729)蛋白激酶基因。敲除FgCPK1基因,禾谷镰刀菌真菌毒素DON生物合成量降低,但敲除FgCPK2基因,DON生物合成量并没有明显变化,敲除禾谷镰刀菌中腺苷酸环化酶FgFAC1基因则不能合成DON[40-42]。当培养基中加入环腺苷酸(cyclic adenosine monophosphate,简称cAMP)时,可以刺激TRI基因表达来诱导DON生物合成。额外加入cAMP并不能恢复tri6突变体的表型缺失,但却能恢复tri10突变体在DON生物合成中的表型缺陷。cAMP的磷酸二酯酶基因为FgPDE1和FgPDE2。敲除FgPDE2基因可以激活蛋白激酶A(protein kinase A,简称PKA)的活性并增加DON的生物合成量,FgPDE1基因敲除突变体并没有此功能。但双突变体Fgtri6pde2菌株不能检测到DON,双突变体Fgtri10pde2菌株DON生物合成量显著高于tri10单突变体,说明在 cAMP-PKA信号通路调节DON生物合成中,TRI6基因是必需的,同时,FgPDE2基因反向调节DON生物合成[43]。
TOR信号通路在营养物质信号转导中起着重要作用[44]。但此信号途径唯一的激酶基因FgTOR1/2(FGSG_08133)可能为致死基因[36],与此激酶互作的Tap42磷酸激酶复合物由3个基因[FgPP2A(FGSG_09815)、FgSIT4(FGSG_01464)、FgPPG1(FGSG_05281)]编码。其中,FgPP2A(FGSG_09815)基因不能被敲除,FgSIT4、FgPPG1基因可以被敲除。敲除FgSIT4基因不影响DON生物合成,但敲除FgPPG1基因后突变体中检测不到DON[45]。
这些信号通路能够影响真菌毒素DON生物合成量,说明它们参与调控了DON的生物合成。调控机制可能是唯一的,但绝大多数信号通路应该是把外界环境因子的信号传导给体内的调控机制,从而实现对DON生物合成的总体调控。氮源调控DON生物合成调控中心转录因子FgAreA基因能够影响Gpmk1的磷酸化水平及cAMP-PKA活性水平[28]。在TOR作用下,参与氮代谢的一些基因可以被诱导表达。同时,Audenaert等发现FgAREA和FgPPG1基因突变体在产孢率、致病性和DON生物合成量的表型方面都基本一致,可能因为FgAreA是FgPPG1的下游元件,共同参与了TOR信号途径[32]。这些数据表明信号通路和代谢途径应该是相互作用共同调控DON的生物合成。但目前氮代谢和信号通路的研究较多,其他代谢途径的相关报道较少。
3 展望
禾谷镰刀菌真菌毒素DON不仅能够危害人、畜的健康,还是重要的致病因子,同时也是防治小麦赤霉病的关键。目前,还没有关于控制禾谷镰刀菌真菌毒素DON合成的有效途径。传统防治小麦赤霉病的手段以化学、物理方法为主,但防效甚微,还可能造成化学农药污染。我国关于小麦赤霉病的抗病育种的工作开始的较晚,也没有培育出较强的抗小麦赤霉病品种。因此,借助基因工程相关手段进行小麦赤霉病的防治极其重要,而搞清小麦赤霉病致病菌禾谷镰刀菌真菌毒素DON的调控机制对防治小麦赤霉病的扩展和毒素的污染起着重要作用。可以通过控制禾谷镰刀菌DON调控机制中的关键基因和关键信号通路来抑制禾谷镰刀菌产生真菌毒素DON,从而控制禾谷镰刀菌的进一步扩展,起到防治小麦赤霉病和提高粮食安全的作用。

