禾谷镰刀菌对二穗短柄草的致病性及侵染过程
苏培森,王 彪,王宏伟,孔令让,李安飞
山东农业大学 农学院,山东 泰安 271018
禾谷镰刀菌对二穗短柄草的致病性及侵染过程
苏培森,王 彪,王宏伟,孔令让,李安飞*
山东农业大学 农学院,山东 泰安 271018
小麦赤霉病主要是由禾谷镰刀菌引起的真菌病害,不仅造成小麦的产量损失而且降低小麦的品质。为了研究小麦赤霉病II型抗性机理,作为一种新型的单子叶模式植物,二穗短柄草(Bd21)能够和禾谷镰刀菌产生互作,在正常生长条件下却表现相对抗性表型。本文筛选了禾谷镰刀菌侵染二穗短柄草穗部的发病条件,并确认了最适发病条件为28℃,75%湿度。在禾谷镰刀菌侵染二穗短柄草的早期,分生孢子主要在雌蕊萌发,然后菌丝迅速生长并沿子房蔓延至小花的底部,通过穗轴节点向下延伸,然而菌丝并没有进入子房内部。另外,当禾谷镰刀菌侵染二穗短柄草的胚芽鞘时,菌丝可以进入胚芽鞘细胞,向下延展。因此,二穗短柄草可在小麦II型抗性研究中发挥重要作用。
小麦赤霉病;二穗短柄草;II型抗性
小麦赤霉病主要是由禾谷镰刀菌(Fusarium graminearum)引起的小麦穗部的一种真菌病害,其不仅造成小麦产量降低,而且在小麦籽粒积累脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)等真菌毒素,导致小麦品质下降[1]。近几十年来,由于气候和耕作的改变,小麦赤霉病频繁爆发[2]。小麦赤霉病主要分布于湿润、半湿润地区。目前中国的赤霉病主要发生在长江中下游流域并且赤霉病发病区域有逐渐北移的趋势[3-6]。赤霉病在小麦整个生育期均可发生,引起苗枯、基茎腐烂和穗枯等症状,穗枯症状危害尤为重要。根据寄主对于赤霉病的抗性类型的差异,主要划分为以下五种类型:一为抗侵染型(Type I);二为抗蔓延型(TypeⅡ);三为抗毒素积累型(TypeⅢ);四为籽粒抗感染(TypeⅣ);五为耐病型(Type V)[7]。目前研究最为广泛的为II型抗性。在过去的一百年,数量性状位点(QTL)已被广泛应用于小麦抗赤霉病的研究[8],但对于病原菌感染过程分子机理知之甚少。另外相比其他小麦病害如锈病,白粉病等病害的抗源,普通小麦种内可供利用的有效的抗赤霉病基因资源尚欠丰富[9],这严重限制了小麦赤霉病的研究。
二穗短柄草(Bd21)作为一种广泛生长在温带的单子叶植物,种质资源非常丰富。其植株矮小,易于种植,生命周期短,遗传转化效率高和基因组小[10],它已成为理想的用于单子叶植物功能基因组学研究的模式植物。更重要的是其整个基因组测序已于2010年完成[11]。Bd21是二倍体(2 n=2 x= 10),基因组大小大约272 Mb[11],介于拟南芥(约119 Mb)和水稻(大约382 Mb)基因组之间[12,13],并且包含15%的重复序列[14]。与普通小麦同属于早熟禾亚科,在进化上二穗短柄草与小麦等温季型禾谷类作物的亲缘关系相比于水稻更为相近[15],同源性较高。近10余年间来,随着对于二穗短柄草的研究逐渐增多,其T-DNA插入突变体库的构建及遗传转化系统的建立都将促进其作为模式植物在功能基因组学方面的研究[10]。
本研究以二穗短柄草为模式植物探究了小麦与禾谷镰刀菌之间的互作,确定了对于小麦赤霉病II型抗性研究的发病条件,并跟踪了禾谷镰刀菌在穗部的侵染过程。此外,我们对于二穗短柄草胚芽鞘也进行了禾谷镰刀菌的侵染,发现禾谷镰刀菌也可以侵染进入胚芽鞘细胞。这可以为我们研究小麦赤霉病II型抗性提供一定的理论支持。
1 材料与方法
1.1 实验材料
二穗短柄草Bd21(Brachypodiam distachyon);带有绿色荧光蛋白(Green Fluorescent Protein,GFP)禾谷镰刀菌菌株由山东农业大学植物保护学院梁元存副教授提供。GFP禾谷镰刀菌菌丝在荧光显微镜下可以观察到绿色荧光,以此用来观察菌丝生长延展情况。
1.2 实验方法
1.2.1 禾谷镰刀菌的培养 将带有GFP禾谷镰刀菌菌株移至土豆培养基中,28℃恒温箱中倒置培养3~5 d。将菌丝挑至盛有30 mL左右绿豆汤培养基的三角瓶中振荡培养,200 rpm,28℃,培养2~3 d,检测孢子浓度。
1.2.2 二穗短柄草穗部禾谷镰刀菌的接种 在二穗短柄草开花期采用单花滴注的方法接种小穗部基部单个小花,接种2 μL禾谷镰刀菌菌液(浓度为每毫升5~10×105个),分别置于不同温度25℃,28℃和不同湿度40%,75%的培养箱发病,在3 d,6 d和10 d通过荧光显微镜观察禾谷镰刀菌在二穗短柄草穗部的发病情况。
1.2.3 二穗短柄草胚芽鞘禾谷镰刀菌的接种 二穗短柄草种子发芽3~5 d,将胚芽鞘的顶端剪掉1 mm左右,然后于伤口的横截面上套上经GFP禾谷镰刀菌菌液浸润的滤纸(禾谷镰刀菌浓度为每亳升5~10×105个),置于相对湿度为85%的培养箱条件下培养(28℃光照16 h,18℃黑暗8 h)。在GFP禾谷镰刀菌接种后的1 d、6 d和12 d通过荧光显微镜观察菌丝在胚芽鞘内部的侵染。
2 结果与分析
2.1 二穗短柄草赤霉病最适发病条件
采用单花滴注的方法探究了在不同条件下二穗短柄草小穗感染禾谷镰刀菌情况。我们发现在在25℃或28℃,湿度40%,发病3 d,在接菌小花出现褐色病斑,但发病较轻。保持25℃或28℃,湿度75%的条件下,禾谷镰刀菌已经蔓延整个接菌小花,开始向邻近小花延展。当接种6 d,在高湿环境下,菌丝会明显向上延展,约1/2小穗发生褐色病症。当侵染10 d之后,28℃,湿度75%,菌丝会延展至整个小穗(图1)。对比不同发病条件下,禾谷镰刀菌在穗部的发病情况,最后发现在28℃,湿度75%为比较合适的发病条件。

图1 不同温度和湿度环境下禾谷镰刀菌在二穗短柄草穗部的侵染Fig.1 Fusarium graminearum against Brachypodium distachyon(Bd)spikes under different humidity and temperature
2.2 禾谷镰刀菌侵染二穗短柄草穗部过程
在侵染早期,我们观察了禾谷镰刀菌在小花内的侵染进程。接菌24 h后,通过观察,我们发现孢子已经完成萌发,菌丝由柱头延展至子房。接菌24~48 h,菌丝蔓延至小花基部,整个子房完全坏死(图2)。通过荧光显微镜观察子房,发现菌丝仅仅沿子房表面延展,而子房内部并没有菌丝(图3A)。当菌丝侵染完整个接种小花之后,我们调查了禾谷镰刀菌在邻近小花间的侵染方式,切开穗轴,发现在穗轴内并没有绿色荧光,而在邻近小花表面发现绿色荧光,因此禾谷镰刀菌菌丝通过侵染邻近小花表面侵染进入邻近小花,却并没有通过穗轴(图3B,图4)。

图2 侵染早期,禾谷镰刀菌在二穗短柄草穗小花的侵染Fig.2 Fusarium graminearum against Brachypodium distachyon spikes at early stage
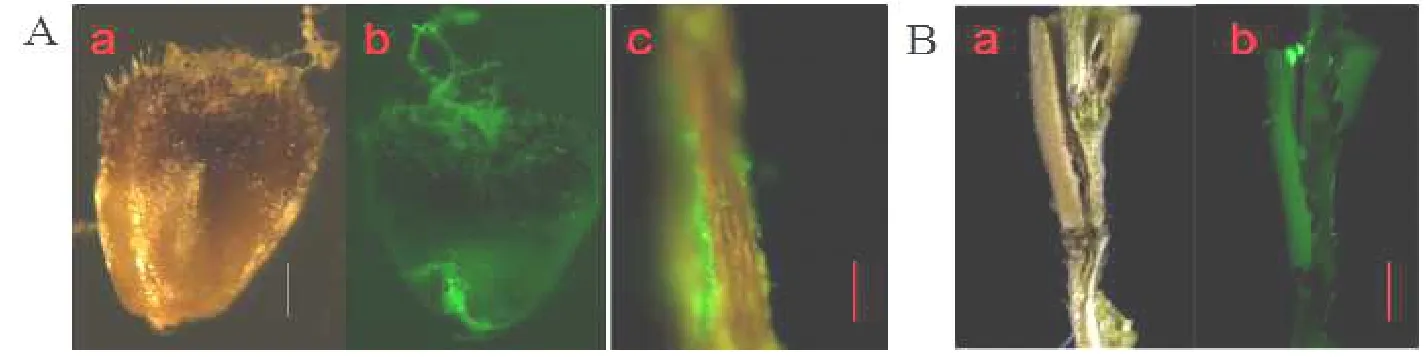
图3 二穗短柄草子房和小穗穗轴观察Fig.3 Observation on ovary and rachis in BdA.子房观察 (a~c)Observation on ovary;B.小穗穗轴观察 (a,b)Observation on rachis。比例尺:500µm。Scale:500µm

图4 禾谷镰刀菌在二穗短柄草穗部的侵染Fig.4 The processes of Fusarium graminearum against Brachypodium distachyon spikes
2.3 二穗短柄草、小麦及大麦禾谷镰刀菌侵染模式对比
将二穗短柄草禾谷镰刀菌侵染模式与小麦、大麦侵染模式作了比较。接种小麦,发现禾谷镰刀菌在接种小花发病后,菌丝会通过穗轴侵染邻近小花。相比之下,当大麦接种禾谷镰刀菌之后,菌丝在接种小花发病之后,并不会通过穗轴侵染邻近小花,而是直接在穗轴表面延展,侵染邻近小花(图5a,b)[16]。我们发现二穗短柄草在接种禾谷镰刀菌之后,在小穗内部菌丝不会通过穗轴而是沿着表面侵染至邻近小花(图3C,图4B),而在穗基部节点菌丝则会侵染至穗轴内部,然后向下侵染。(图5C)。

图5 二穗短柄草、小麦及大麦禾谷镰刀菌侵染模式比较Fig.5Comparisonof infectedmodelsamongFusariumgraminearumagainstBrachypodiumdistachyon,wheat and barley
2.4 禾谷镰刀菌侵染二穗短柄草胚芽鞘
通过实验,我们观察了禾谷镰刀菌在短柄草胚芽鞘的侵染方式。首先我们借鉴了小麦胚芽鞘研究方法[17]。将生长3 d左右的二穗短柄草幼苗顶端剪去1 mm,套上经GFP禾谷镰刀菌菌液浸润的滤纸(图6A)。在接种不同时间,通过荧光显微镜观察了菌丝在胚芽鞘内的侵染。当接种1天后,我们发现孢子已经萌发并侵染至胚芽鞘内部。当接种6 d后,菌丝进一步侵染,并且菌丝在胚芽鞘细胞内完成横向侵染。当接种12 d后,菌丝侵染至整个胚芽鞘(图6B)。

图6 禾谷镰刀菌在二穗短柄草胚芽鞘中的侵染Fig.6 Fusarium graminearum against Brachypodium distachyon in coleoptiles
3 讨论
近十几年,二穗短柄草作为一种新型的单子叶模式植物其研究工作经历由缓慢到快速的一个过程。二穗短柄草基因组测序完成,突变体库逐渐完善以及遗传转化的日渐成熟使其被用于作物功能基因组学的研究[10,15,18,19]。赤霉病作为小麦主要的病害之一,禾谷镰刀菌与小麦之间的互作机理并没有被明确解释。一般认为,在开花期,禾谷镰刀菌是通过颖壳之间的空隙进入到小穗内部[20]。在侵染6~12 h,禾谷镰刀菌已经开始萌发。在侵染12~24 h,禾谷镰刀菌在颖壳内开始形成初步的菌丝网[21]。侵染48 h,禾谷镰刀菌的菌丝开始爆发增长,并由寄生生长开始转为腐生型侵染。对于禾谷镰刀菌与二穗短柄草的互作已经有所研究[15]。在二穗短柄草小花内,当我们接种禾谷镰刀菌0~24 h,孢子已经完成萌发,经柱头蔓延至子房。在接种48 h,菌丝已经蔓延至整个接种小花。这和禾谷镰刀菌在小麦小花内侵染模式是非常相似的,但是禾谷镰刀菌并没有侵染进入二穗短柄草的子房内,这与小麦侵染方式存在差别。关于小麦赤霉病的抗性研究主要集中在II型抗性[22]。通过单花滴注的方法用来评价小麦II型抗性[23]。我们通过此方法接种二穗短柄草,发现禾谷镰刀菌孢子在小花内萌发后快速通过子房侵染整个小花,然后沿着小穗内穗轴侵染邻近的小花,菌丝并没有进入小穗内穗轴,这与禾谷镰刀菌在大麦中侵染模式相似[16]。而在小麦中菌丝在小花发病后,穿过穗轴侵染邻近的小花,但是当我们接种二穗短柄草小穗最下端小花,菌丝可以通过穗轴节点向下传染。因此,我们认为以此可以作为评价II型抗性的标准。
之前有人报道了小麦胚芽鞘接种禾谷镰刀菌作为赤霉病致病性鉴定的一种方法的可行性[17]。我们参照此方法并作了调整,接种短柄草胚芽鞘。我们发现,短柄草胚芽鞘和禾谷镰刀菌是可以产生互作,并且在第一天菌丝已经侵染进胚芽鞘,引起胚芽鞘正常发病,产生黄色或褐色的病斑,并且其侵染进程和方式与小麦非常相似[24]。但是具体的二穗短柄草与禾谷镰刀菌之间的互作模式以及是否可以作为小麦赤霉病II型抗性研究的一种评价标准还需要进一步的验证。
4 结论
本研究以模式植物二穗短柄草为研究对象,跟踪调查禾谷镰刀菌在二穗短柄草穗部和胚芽鞘的侵染模式,探究了二穗短柄草与禾谷镰刀菌的互作方式,为小麦赤霉病II型抗性研究提供了支持。
[1]Bai G,Shaner G.Management and resistance in wheat and barley to Fusarium head blight[J].Annu.Rev.Phytopathol, 2004,42:135-161
[2]Miller D.DON-past,present and future.National Fusarium Head Blight Forum.2012
[3]Bai G,Kolb FL,Shaner G,et al.Amplified fragment length polymorphism markers linked to a major quantitative trait locus controlling scab resistance in wheat[J].Phytopathology,1999,89(4):343-348
[4]程顺和,张 勇,张伯桥,等.控制小麦赤霉病流行的主要因素分析[J].江苏农业学报,2003,19(1):55-58
[5]张凯鸣,马鸿翔,陆维忠,等.小麦赤霉病与DON积累的抗性及其相关SSR位点差异[J].作物学报,2006,32(12):1788-1795
[6]McMullen M,Jones R,Gallemberg D.Scab of wheat and barley:a re-emerging disease of devastating impact[J].Plant Disease,1997,81:1340-1348
[7]Patricia AC,Daryl JS,Julian T,et al.Fine mapping Fhb1,a major gene controlling fusarium head blight resistance in bread wheat(Triticum aestivum L.)[J].TheorEtical andApplied Genetics,2006,112:1465-1472
[8]Buerstmayr H,Ban T,Anderson JA.QTL mapping and marker-assisted selection for Fusarium head blight resistance in wheat:a review[J].Plant breeding,2009,128(1):1-26
[9]刘光欣,陈佩度,周 波,等.小麦-大赖草易位系对赤霉病抗性的聚合[J].麦类作物学报,2006,26(3):34-40
[10]李海峰,孙其信.模式植物短柄草研究新进展[J].西北植物学报,2012,32(3):633-638
[11]Vogel JP,Garvin DF,Mockler TC,et al.Genome sequencing and analysis of the model grass Brachypodium distachyon[J].Nature,2010,463(7282):763-768
[12]Thole V,Alves SC,Worland B,et al.A protocol for efficiently retrieving and characterizing flanking sequence tags (FSTs)in Brachypodium distachyon T-DNAinsertional mutants[J].Nature protocols,2009,4(5):650-661
[13]Garvin DF.Brachypodium:a new monocot model plant system emerges[J].Journal of the Science of Food and Agriculture,2007,87(7):1177-1179
[14]Catalán P,Shi Y,Armstrong L,et al.Molecular phylogeny of the grass genus Brachypodium P.Beauv.based on RFLP and RAPD analysis[J].Botanical Journal of the Linnean Society,1995,117(4):263-280
[15]Draper J,Mur LAJ,Jenkins G,et al.Brachypodium distachyon.A new model system for functional genomics in grasses[J].Plant Physiology,2001,127:1539–1555
[16]Carin J,Diter W,Wilhelm S,et al.Infection patterns in barley and wheat spikes inoculated with wild-type and trichodiene synthase gene disrupted Fusarium graminearum[J].Proceedings of the National Academy of Sciences of the United States ofAmerica PNAS,2005,46(102):16892–16897
[17]Wu AB,Li HP,Zhao CS,et al.Comparative pathogenicity of Fusarium graminearum isolates from China revealed by wheat coleoptile and floret inoculations[J].Mycopathologia,2005,160:75–83
[18]Opanowicz M,Vain P,Draper J,et al.Brachypodium distachyon:making hay with a wild grass[J].Trends in Plant Science,2008,13:1360–1385
[19]Mur LAJ,Allainguillaume J,Catalan P,et al.Tansley review:exploiting the brachypodium toolbox in cereal and grass research[J].New Phytologist,2011,191:334–347
[20]Lewandowski SM,Bushnell WR,Evans CK.Distribution of mycelial colonies and lesions in field-grown barley inoculated with Fusarium graminearum[J].Phytopathology,2006,96(6):567-581
[21]Kang Z,Buchenauer H.Cytology and ultrastructure of the infection of wheat spikes by Fusarium culmorum[J]. Mycological Research,2000,104(9):1083-1093
[22]Schroeder HW,Christensen JJ.Factors affecting resistance of wheat to scab caused by Gibberella zeae[J]. Phytopathology,1963,53:831-838
[23]Parry DW,Jenkinson P,McLeod L.Fusarium ear blight(scab)in small grain cereals-a review[J].Plant Pathology, 1995,44:207-238
[24]Zhang XW,Jia LJ,Zhang Y,et al.In planta stage-specific fungal gene profiling elucidates the molecular strategies of Fusarium graminearum growing inside wheat coleoptiles[J].The Plant Cell,2012,24(2):5159-5176
Pathogenicity and Infection Process of Fusarium graminearum against Brachypodium distachyon
SU Pei-sen,WANG Biao,WANG Hong-wei,KONG Ling-rang,LIAn-fei*
College of Agronomy/Shandong Agricultural University,Taian 271018,China
Fusarium head blight(FHB)of wheat is mainly caused by Fusarium graminearum.It results in yield reduction and deteriorates seed quality.As a new monocotyledonous model plant,Brachypodium distachyon(Bd21)is able to interact with F.graminearum but often shows relatively resistant phenotype at normal growth condition.In this paper,we studied the progress of F.graminearum against B.distachyon 21 spikes at different conditions and confirmed the optimal condition for type II resistance evaluation at 28℃,75%humidity.In the early stage of F.graminearum infection of B.distachyon,the spores mainly germinated on pistil,then the hyphae quickly moved to ovary and extended to the bottom of the floret and entered into spikes nodes,extending down along the rachis.In addition,when F.graminearum infected the coleoptile of B. distachyon,hyphae can enter the coleoptile cells and stretch downward.B.distachyon can play an important role in the study of wheat type II resistance.
Fusarium head blight;Brachypodium distachyon;type II resistance
S51
:A
:1000-2324(2017)03-0379-05
2016-10-07
:2016-10-11
苏培森(1989-),男,硕士研究生,主要从事作物分子遗传育种工作.E-mail:pssu2014@163.com
*通讯作者:Author for correspondence.E-mail:lianfei@sdau.edu.cn

