定量CT对老年髋部骨折患者的股骨近端形态结构研究
许乐洋 范永前△ 林伟龙 杨丰建 陈 聪 林上进 潘依潇
(1复旦大学附属华东医院骨科 上海 200040; 2上海市老年医学临床重点实验室 上海 200040)
髋部骨折是骨质疏松性骨折最常见的部位之一,它对肢体的活动、功能等方面造成严重损害,大大降低老年人的生活质量,甚至带来生命危险[1-2]。由WHO提供的数据发现,到2050年,在发生髋部骨折的女性人群中,亚洲将占半数以上。识别髋部骨折高风险人群能有效地采取干预策略,减少骨折负担。
目前,骨质疏松诊断的金标准是骨密度(bone mineral density,BMD),通过双能X线吸光测量仪(dual-energy X-ray absorptiometry,DXA)进行测定。然而,DXA测定BMD反映的只是骨骼中骨矿含量,而骨矿含量仅是骨质疏松相关髋部骨折众多危险因素中的一个,那么DXA是否能够提供额外的非BMD的信息来预测骨折风险呢?在此领域有很多临床和基础研究,Goodyear等[3]采用传统的放射学影像获得髋关节的形态和质地来预测骨折风险,称为主动形态建模,同时在此基础上改进应用主动外表建模来获取股骨头和股骨颈内的BMD强度类型,发现从DXA影像中获得的外形和外表的信息同样可以预测髋部骨折,但是由此预测髋部骨折人群仅增加3%。Ayoub等[4]发现髋部骨折的人群中股骨颈压缩强度指数(femoral neck compressive index,FN CSI)、股骨颈表面骨密度(femoral neck bone mineral apparent density,FN BMAD)和骨小梁指数(trabecular bone score,TBS)明显低于非骨折人群,但是上述指标尚未从生物力学的角度对髋部骨折的风险进行预测。
绝大部分老年髋部脆性骨折是由身体向侧方倾倒时所产生的应力瞬间施加在髋部所导致,这种侧方应力会导致骨的屈曲以及轴向压缩。生物力学研究表明,当施加在骨骼上的外力超过了其发生弹性形变(可逆)和塑形形变(不可逆)所能吸收的最大能量时就会发生骨折。通过DXA测得的BMD值只能反映部分骨强度情况[5-6],甚至有研究发现许多骨折高风险人群的BMD在正常范围内,所以单一的BMD指标并不能理想地预测骨的力学性能。而由学者Beck等[7]提出的髋部几何结构分析(hip structural analysis,HSA)被认为是较好的评价骨质量的方法。许多相关的研究都发现髋部几何结构的改变与骨折的发生率有关[8-10]。通过HSA可以帮助我们全面了解骨的几何结构,对BMD起到了很好的补充优化作用。
当利用DXA进行HSA分析时,只能有效地分析平面图像,当肢体摆放位置变化时其分析所得数值就会发生相应的改变。并且,其默认平面是对称的,但现实中股骨颈和股骨粗隆间区域的横截面并不对称,所以得出结果只能是一个估算值。而定量CT(quantitative CT,QCT)是对基于CT扫描的三维图像进行分析[11]。结合外置质量控制体模以及校准体模使其能呈现出活体骨组织的真正几何结构,从几何学的视角展现某一特定横截面骨的矿物质信息,可以帮助我们全面了解骨的几何结构,是一种真正三维的体积BMD测量技术。利用QCT对髋部几何结构做进一步分析有助于评估骨强度,为髋部骨折的风险预测提供理论依据。既往的研究多聚焦于股骨颈骨折,但股骨颈骨折和股骨粗隆间骨折在流行病学上仍存在差异,将两种骨折人群分开进行研究,更有助于阐释髋部骨折的风险。
资 料 和 方 法
研究对象本研究共纳入复旦大学附属华东医院2016年3月至2017年1月因髋部脆性骨折(股骨颈骨折、股骨粗隆间骨折)收住入院的老年患者93例,其中男性21例,女性72例,股骨粗隆间骨折31例,股骨颈骨折62例。患者年龄70~96岁,平均年龄(82.31±7.76)岁;其中男性21例,平均年龄(81.61±10.06)岁,女性72例,平均年龄(82.51±7.03)岁;股骨粗隆间骨折31例,平均年龄(84.61±6.50)岁,股骨颈骨折62例,患者平均年龄(81.16±8.13)岁。纳入标准:(1)脆性骨折患者,即跌倒外伤(指在平地活动时人体重心高度跌倒发生的骨折);(2)骨折后48 h内来院就诊;(3)年龄>70岁。排除标准:(1)患有严重骨代谢疾病,如Ⅰ型糖尿病、未经过治疗的甲亢、过早绝经(<45岁)、慢性营养不良、慢性肝病、肾性骨营养不良、库欣综合征等;(2)服用影响骨代谢的药物,如皮质类固醇激素、降钙素、双膦酸盐等;(3)酗烟酒史;(4)恶性肿瘤治疗中;(5)本次骨折前卧床达1个月以上;(6)既往髋关节置换术或髋部骨折内固定术手术史;(7)高能量损伤导致的髋部骨折如高空坠落、车祸;(8)年龄<70岁。纳入研究的患者均填写髋部骨折信息记录表,采集信息包括年龄、性别、民族、身高、体重、体质指数、摔倒时的情况以及详细的既往病史和药物服用史。 本研究经复旦大学附属华东医院伦理委员会批准,研究对象均签署知情同意书。
研究方法均在术前对健侧髋关节行QCT BMD测量及运用配套软件分析髋部骨结构参数。
QCT测量 髋部BMD测量:采用SOMATOM Definition Flash 64排CT扫描机(德国SIEMENS公司)加垫Mindways公司的5样本固体体模扫描健侧髋关节。扫描范围:从髂嵴至股骨上段;扫描参数:管电压120 kV,管电流150 mAs,床高155.5 mm,SFOV 500 mm,层厚1mm,标准算法重建。扫描时将校准体模放置于患者髋关节下方,患者取仰卧位,双手上举并抱头。将CT原始图像从CT主机传输至QCT工作站自动合成测量文件后,采用QCT Pro v 4.2.3软件中的“Slice Pick”截取CT定位片图像,从髋臼顶至股骨小粗隆下3~5 cm。采用QCT Pro软件中CTXA(computed tomography X-ray absorptiometry) Hip软件分析模块,在 CT 横断面图像上浏览包含股骨颈的层面,将含有绿色十字的定位框放置在待测一侧的股骨颈中心位置。软件自动去除软组织并生成近端股骨横断面、矢状面、冠状面的重建图像,手动调整图像,使横断面上股骨颈长轴与水平线平行,冠状位与矢状位上股骨干长轴与竖直线平行,测量髋部及感兴趣区(region of interest,ROI)区域的骨密度(图1、2)。

A:The horizontal line was parallel to the long axis of the femoral neck;B and C:The vertical line was parallel to the long axis of the femoral shaft.
图1髋部CT重建图像
Fig1CTreconstructimageofhip
髋部几何参数测量 采用BIT v 2.0分析软件。软件自动将ROI置于股骨颈最窄区域的中心,将ROI自动分为11层轴位图像,层厚1 mm(图3)。因亚洲人种股骨颈轴长较白种人短,为避免截取到粗隆区域的骨质,所以通常取1~6层进行髋部几何参数的分析。记录股骨颈区域的最小横截面积(cross-sectional area,CSA)(cm2)、横截面转动惯量(cross-sectional moment of inertia,CSMI)(cm4)、截面模量Z值(cross-sectional modulus Z,Z score)(cm3)、屈曲比率(buckling ratio,BR)、皮质骨厚度(crotical bone thickness,CTh)(mm) 以及髋关节轴线长度(hip axis length,HAL)(mm)。另外,软件还可自动将每一层面分隔为16个扇形区域,并将16个扇形区域划分为4个象限(图3),扇形编号2~5为前上象限(superoanterior,SA),扇形编号6~9为前下象限(inferoanterior,IA),扇形编号10~13为后下象限(inferoposterior,IP),扇形编号14~1为后上象限(superoposterior,SP),BIT软件自动计算出各象限CTh,并生成报告。
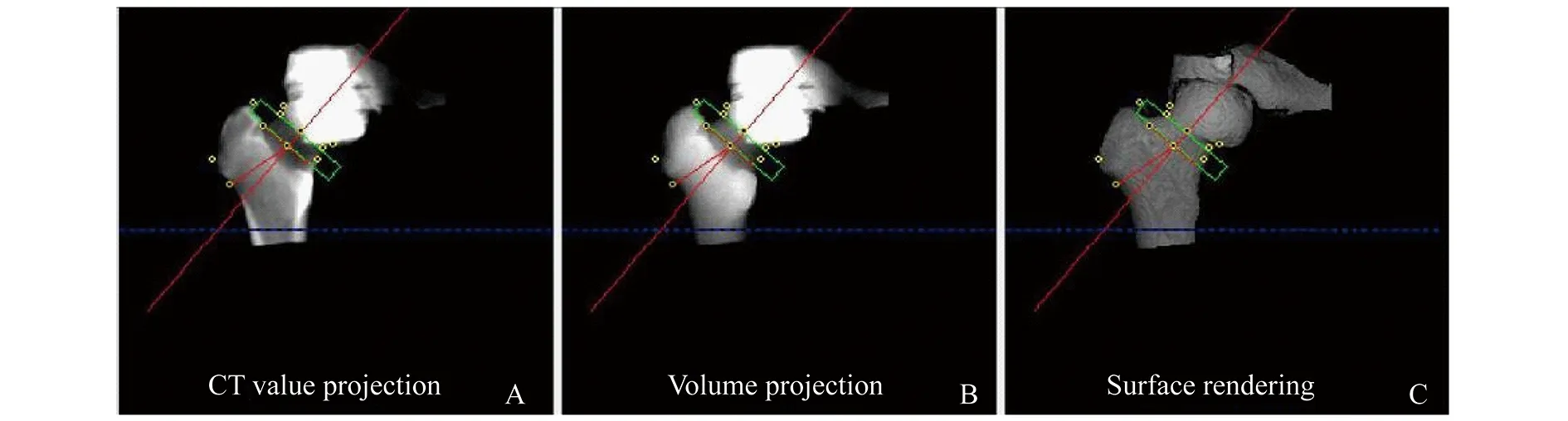
图2 自动选取ROIFig 2 Automatic selection of the ROI
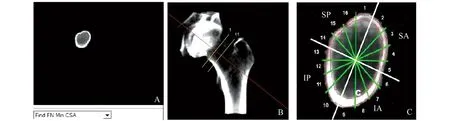
A:Select the minimal CSA automatically;B:The minimal CSA was divided into 11 layers;C:Each layers was splited into 4 quadrants.
图3BIT软件测量股骨颈最小横截面上的相关参数
Fig3ThefemoralneckminimalCSAmeasuredbyBIT
结 果
QCT测量BMD可区分皮质骨与松质骨,对比两种髋部骨折在全髋(total hip,TH)、股骨颈(femoral neck,FN)、粗隆(trochanter,TR)、粗隆间(intertrochanter,IT)的总体BMD,以及皮质骨与松质骨BMD,两种髋部骨折的BMD参数均无统计学意义(表1)。
对比两种髋部骨折的髋部几何结构参数,股骨颈骨折组的CSA为(1.39±0.25)cm2,小于粗隆间骨折组[(1.53±0.29)cm2,P<0.05];而股骨颈骨折组的HAL为(108.54±7.37)mm,大于粗隆间骨折组[(105.06±6.59)mm,P<0.05]。两组其余髋部几何参数比较,差异均无统计学意义。
由表2可知,两种骨折在股骨颈区域的平均CTh在股骨颈骨折组为(1.16±0.38)mm,略小于粗隆间骨折组(1.17±0.35)mm,但两组间差异无统计学意义(P>0.05)。进一步利用BIT分析软件,将股骨颈轴位按象限进行分析。在SA中,股骨颈骨折组的CTh小于粗隆间骨折组[(0.42±0.40)mmvs.(0.59±0.29)mm,P<0.05]。两组在其他象限差异均无统计学意义(表3)。


ElementsIntertrochanteric fracture (mg/cm3)Femoral neck fracture (mg/cm3)tPTotal TH202.17±40.39202.93±37.96-0.0880.930 FN217.84±38.02217.84±38.02-0.0010.999 TR141.64±29.40141.61±31.040.0040.997 IT236.45±54.27241.27±48.30-0.4360.664Cortical bone TH1 237.27±402.931 174.40±146.25 0.7980.438 FN1 333.37±642.221 361.96±459.24-0.2470.806 TR1 109.55±1 012.567 437.04±5 766.85-0.7680.806 IT1 054.30±118.181 024.99±98.991.2610.211Trabecular bone TH88.13±13.3290.13±14.45-0.6440.520 FN82.54±12.3786.24±15.37-1.1640.247 TR89.83±12.1092.04±15.85-0.6810.497 IT87.51±17.3389.15±17.24-0.4290.669
TH:Total hip;FN:Femoral neck;TR:Trochanter;IT:Intertrochanter.


Hip fracture typeCSA (cm2)CSMI (cm4)CTh (mm)Z (cm3)HAL (mm)BRIntertrochanteric fracture1.53±0.291.48±0.841.17±0.350.84±0.45105.06±6.5916.93±5.17Femoral fracture1.39±0.251.62±1.621.16±0.380.90±0.78108.54±7.3715.75±3.79t2.2650.3050.0260.373-2.2221.248P0.0260.6580.9790.6930.0290.215
CSA:Cross-sectional area;CSMI:Cross-sectional moment of inertia;CTh:Crotical bone thickness;Z:Cross-sectional modulus Z;HAL:Hip axis length;BR:Buckling ratio.

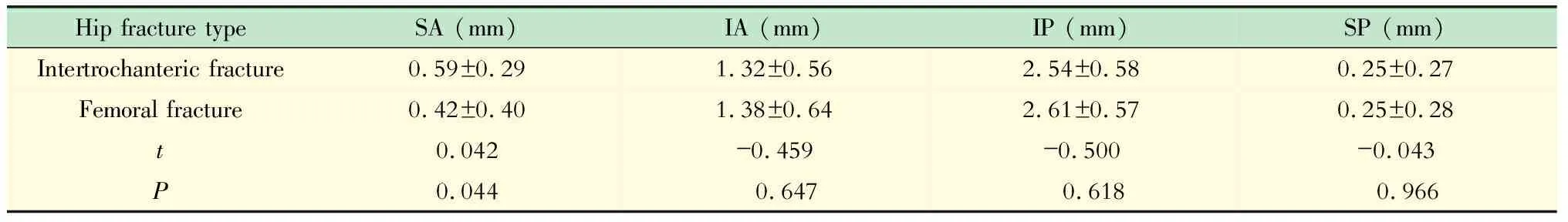
Hip fracture typeSA (mm)IA (mm)IP (mm)SP (mm)Intertrochanteric fracture0.59±0.291.32±0.562.54±0.580.25±0.27Femoral fracture0.42±0.401.38±0.642.61±0.570.25±0.28t0.042-0.459-0.500-0.043P0.044 0.647 0.618 0.966
SA:Superoanterior;IA:Inferoanterior;IP:Inferoposterior;SP:Superoposterior.
为了进一步排除混杂因素的干扰,运用协方差分析,将年龄与性别作为协变量进行控制,发现两组在髋部各部位的BMD差异依然无统计学意义,在髋部几何参数上的差异与上述表格一致,表明年龄与性别并未对两种髋部骨折的BMD及几何结构的差异造成影响(表4~6)。


ValueTotalCortical boneTrabecular boneTHFNTRITTHFNTRITTHFNTRITF0.3460.4900.2690.0350.1240.8220.4370.4970.1270.1090.0100.408P0.5580.4860.6050.8530.7250.3670.5100.4830.7220.7420.9200.525
Abbreviations as in Tab 1.

表5 两种髋部骨折髋部几何结构参数协方差分析(控制年龄及性别协变量)Tab 5 Analysis of covariance of two kinds of hip fractures in hip geometric parameters (control age and sex covariance)
Abbreviations as in Tab 2.

表6 两种髋部骨折股骨颈轴位各象限皮质骨厚度协方差分析(控制年龄及性别协变量)Tab 6 Analysis of covariance of two kinds of hip fractures in cortical bone thickness of each quadrant (control age and sex covariance)
Abbreviations as in Tab 3.
讨 论
骨骼健康的综合情况通过骨强度来反映,骨强度由骨量与骨质量(骨骼几何形状、骨材料性能等[12])来体现。所以BMD仅可解释部分骨强度变异,其余的变异需用骨结构等其他因素来解释。甚至有研究发现许多骨折高风险人群的BMD在正常范围内,所以单一的BMD指标并不能理想地预测骨的力学性能。
过去近30年,DXA测量骨密度已经被广泛应用于临床,并且近年来采用双能DXA自带的HSA软件能获得髋部骨结构的几何参数,DXA的局限性是不能够清晰的反映出髋部较为复杂的三维结构特点。QCT法在20世纪80年代正式用于临床,在临床CT机的基础上,增添了外置质量控制体模以及校准体模,把获取的CT值用羟基磷灰石的密度进行精确替代。不同于传统的DXA测量BMD,QCT测量的是真正的体积BMD,提高了测量的敏感度和精确度。其不受骨骼大小及形态的影响,可区分松质骨和皮质骨,同时还能够基于CT的三维数据反映骨的立体结构。此外,CT能够将获取的横断面图像进行高精度分辨,防止因重叠造成的误差。QCT的临床应用价值已得到国际公认[13]。
通过QCT测量髋部骨结构的参数,我们可以从常规的BMD检查中得到更多关于骨形态结构方面更加精确的信息,从三维的视角展现某一特定横截面骨矿物质信息,从而帮助我们全面了解骨的几何结构,提供额外的非BMD的信息来预测骨折风险,对传统的单一的BMD测量起到了很好的补充优化作用[14-15]。本研究的数据也显示(表2),利用QCT测量的髋部几何结构参数与DXA的结果具有良好的相关性,国外一些研究也证实了DXA与QCT的HSA结果高度相关[16-17]。
作为髋部最为薄弱的区域,股骨颈区的骨强度指标可能也是髋部区域中最为敏感的,其对髋部各种类型骨折风险都有预测意义。既往的研究聚焦于髋部骨折与正常对照人群,而将股骨颈骨折及粗隆间骨折这两种最为常见的髋部骨折分开研究并不多见,将两者分开研究更有助于细化髋部骨折的风险预测。所以本研究选取两种骨折人群中股骨颈区域的相关BMD及HSA参数进行比较,以期发现两种骨折类型之间的异同。
本研究利用QCT对比了两种髋部骨折在全髋、股骨颈、粗隆、粗隆间的BMD,并区分皮质骨与松质骨,但在上述部位的BMD差异均无统计学意义。
既往的研究对松质骨的关注程度远远超过皮质骨。骨小梁丢失和富含骨小梁的椎体骨折作为骨质疏松的特征,是过去半个多世纪研究骨脆性结构的主流,减少椎体骨折是许多临床及药物试验的终点,这转移了人们对皮质骨的注意力。但事实上,约80%的骨折是非椎体骨折,并且这些骨折多数发生在皮质骨区域,约70%与年龄相关的四肢骨骨量丢失都发生在皮质骨。DXA在计算某一截面的CTh时,默认这一截面的皮质骨是均匀对称的,然而我们知道实际上皮质骨是不对称的。QCT明显区别于DXA的方面在于,其能够对从CT上所获得的数据在三维结构上进行成像,并且能够取得ROI区域股骨颈全长的连续CT值,从而测定生物力学参数。
本研究比较两种髋部骨折股骨颈区域的皮质骨平均厚度,股骨颈骨折组,略小于粗隆间骨折组,但两组间无统计学意义[(1.16±0.38) mmvs.(1.17±0.35) mm]。进一步利用BIT v 2.0软件,将股骨颈横断面划分成4个象限后发现,在SA中股骨颈骨折组的皮质骨厚度小于粗隆间骨折组[(0.42±0.40)mmvs.(0.59±0.29)mm,P<0.05]。
一项AGES-Reykjavik的研究[18]认为在股骨颈外上象限的CTh是最好的风险预测指标,股骨粗隆间骨折与股骨颈骨折的病例之间比较,股骨颈下方的厚度明显变薄。Poole等[19]应用皮质骨地图(cortical bone mapping,CBM)对整个近端股骨的皮质进行研究,发现股骨颈骨折的病例在股骨颈的外上区域指甲大小的区域皮质薄30%,而这在股骨粗隆间骨折的病例中并不明显。
股骨颈75%为皮质骨,25%为松质骨,大粗隆50%为皮质骨,50%为松质骨,髋部和椎体皮质骨和松质骨分布不同,皮质骨承担了更多的负荷。有研究表明,在完全剔除股骨颈所有松质骨后,骨的强度并未受到多少影响,因此可以推测,松质骨对股骨颈的骨强度影响有限,但皮质骨对骨强度影响较为明显[20]。特别是在老年人摔倒时,皮质骨所承担的损坏载荷将是决定老年人髋部骨折与否的关键。
年龄的增长使得股骨近端的皮质厚度降低,进而使髋部结构强度发生改变[21]。已有相关研究指出,HAL作为髋部几何结构的重要参数之一,与股骨颈骨折相关,老年女性HAL增加1个标准差,骨折的可能性就会提升1.8倍[22]。同时还有研究发现,在发生髋部骨折的老年人群中,HAL要大于同龄的正常人[23]。那么,HAL是否也是导致不同类型髋部骨折的原因?
Duboeuf等[24]认为HAL是股骨颈骨折的预测因子,OR值为 1.64,但并非粗隆间骨折的相关因素。Gnudi等[25]研究表明,粗隆间骨折的女性一般HAL较短,但也有相关报道认为HAL与髋部骨折及骨折类型无关。本研究显示,股骨颈骨折组的HAL大于粗隆间骨折组,且差异具有统计学意义[(108.54±7.37)mmvs.(105.06±6.59)mm,P<0.05]。可以推测,髋轴长增加,使得力臂增加,发生股骨颈骨折的危险性加大。
股骨颈的CSA反映股骨颈的粗细程度,本研究对比两种髋部骨折的CSA,股骨颈骨折组的横截面积小于粗隆间骨折组[(1.39±0.25)cm2vs.(1.53±0.29)cm2,P<0.05]。说明股骨颈较细的老年人摔倒可能更容易造成股骨颈骨折。本研究测量的是股骨颈最小CSA,比单纯测量股骨颈的宽度或内外皮质直径更能代表股骨颈的粗细程度。
在古典力学中,转动惯量是刚体绕轴转动时惯性的量度,转动惯量在旋转动力学中的角色相当于线性动力学中的质量,可理解为一个物体对于旋转运动的惯性,其用于建立角动量、角速度、力矩和角加速度等数个量之间的关系,是衡量刚体抵抗旋转运动的惯性的物理量。横截面的转动惯量(cross-sectional moment of inertia,CSMI)值等于π的1/4与骨的内外半径4次方的差值的乘积。简言之,当CSMI值增加时,骨的抗折弯能力也随之增加。截面模量Z值等于CSMI除以形心距离(即质量中心到内侧或外侧表面距离中数值较大的一个距离),它与该截面的最大弯曲应力呈负相关,是某一截面弯曲强度的参数,一个横截面在屈曲时所能承受的最大应力取决于该截面的截面模量,当Z值增加时骨的抗折弯能力也会随之增加。BR为骨的最大外半径(质量中心到皮质骨外侧缘最大距离)与平均皮质骨厚度的比值。有研究表明[26-27],BR被认为是“骨不稳定”的指标,具有明确的判断值,当BR>10,就会导致局部结构的不稳定以致结构破坏,对于骨组织即会造成骨折的发生。即CSMI和Z越大,BR越小,骨质量越佳,骨的抗折弯能力越强。
Gnudi等[28]研究表明,髋部骨折患者的CSMI和Z值降低,BR增高;Lacroix 等[29]发现,BR是髋部骨折的独立风险预测因子。本研究中,两种髋部骨折的CSMI、Z值及BR的差异均无统计学意义,提示 CSMI、Z值和BR也许不是造成不同类型髋部骨折的因素,但也有可能与两组研究人群平均年龄均超过80岁有关。
综上所述,结合QCT的参数可推测HAL较长,股骨颈CSA较小,股骨颈前上象限CTh较薄的老年人跌倒后可能更易发生股骨颈骨折。本研究在HSA的研究基础上,结合最新的QCT技术,对近端股骨的形态和结构进行分析,并在髋部骨折中将股骨颈骨折和股骨粗隆间骨折分开进行研究,以期提高对这两类髋部骨折的风险预测,争取早期采取干预策略。两种髋部骨折在髋部几何结构上存在差异的机制,还需进一步研究。

