2015ATA超声模式与TI-RADS在甲状腺结节定性诊断中的应用
李小娟,温德惠*,张利英,李朝喜,王月红,武宇宏
(1河北北方学院附属第一医院超声医学科,张家口 075000;2河北北方学院附属第一医院头颈外科;*通讯作者,E-mail:lucky0726cindy@163.com)
甲状腺癌通常表现为甲状腺结节,在健康人群中,甲状腺触诊对甲状腺结节的检出率仅为4%-7%,高分辨率超声检出率高达19%-67%,其恶性风险比例仅为5%-15%[1,2]。有研究表明,到2019年,甲状腺癌将成为美国女性第三个最常见的癌症[3]。因此,有效地评估甲状腺结节的恶性风险有着重要的意义。Ha等[4]于2009年提出了甲状腺影像与报告系统(thyroid imaging reporting and data system,TI-RADS),规范了甲状腺结节的超声诊断报告。同年Park等[5]以12项超声特征为参考指标,提出了更加具体的TI-RADS分类标准。其在临床上得到了广泛应用,并显示出良好的诊断效能。2015年美国甲状腺学会(American Thyroid Association, ATA)《成人甲状腺结节与分化型甲状腺癌分层诊断指南》(2015 ATA)对甲状腺结节评估提出了“超声恶性风险分层”的概念[6,7], 其在中国人群的诊断价值尚未明确。本文研究的目的在于比较TI-RADS与2015ATA指南指出的超声恶性风险分层对本地区甲状腺良恶性甲状腺结节鉴别诊断的效能。
1 资料与方法
1.1 临床资料
回顾性分析2015-12~2016-11河北北方学院附属第一医院收治的甲状腺结节患者425例共483个甲状腺结节。其中女337例(79.3%),男88例(20.7%),年龄16-85岁(35±10.5)岁。结节中单发结节201个,多发结节282个;位于峡部的10个,右侧叶210个,左侧叶263个。纳入标准:①结节经组织病理学或细胞穿刺学(FNAC)证实;②术前行甲状腺超声检查。排除标准:①甲状腺高分辨率超声图像资料不全,相应数据不完整;②甲状腺细胞病理报告系统结果或术后病理资料不全;③细针穿刺细胞学(FNAC)不能明确结节性质者。
1.2 检查方法
实验设备:使用Toshiba Aplio500彩色多普勒超声诊断仪,线阵探头,频率4-11 MHz。使用机器预设的甲状腺应用模式,由固定的主治医师以上经验丰富的医师进行检查。
检查方法:患者取仰卧位,头部略后仰,充分暴露颈前区。行甲状腺常规连续多切面扫查,确定结节位置。应用灰阶超声观察结节大小、位置、内部结构(实性、囊性或海绵状比例)、内部回声(以甲状腺实质及周围肌层回声为参照,分为高回声、等回声、低回声)、边缘、钙化类型(微钙化<1 mm,粗钙化>1 mm)、形态(是否纵横比>1)及淋巴结情况等,发现病灶后根据2015 ATA指南和TI-RADS分类标准分别对结节进行分级。
1.3 超声评价标准
1.3.1 TI-RADS分级标准 将甲状腺疾病共分为6类:0级,没有结节;1级,囊性结节,增强效应,高度良性;2级,囊实性结节,回声不均,可伴粗大钙化灶,可能良性;3级,实性低回声,回声均匀,边界清晰,性质不能确定;4级,具有1-2项恶性特征,可能恶性;5级,具有超过3项恶性特征,高度恶性。
1.3.2 2015 ATA指南分层标准 ①良性结节:主要为囊性结节;②极低度可疑恶性:“海绵”样的结节;囊实性结节的实性部分不偏心,无明显超声恶性特征;③低度可疑恶性:等回声或高回声实性结节;囊实性结节的实性部分偏心,无明显超声恶性特征;④中度可疑恶性:实性低回声结节,无明显超声恶性特征;⑤高度可疑恶性:实性低回声或囊实性结节中的实性成分为低回声的结节;同时具有以下一项或多项超声恶性特征[3,8]。
1.3.3 恶性超声特征 ①边缘不规则(浸润性、小分叶或毛刺);②微钙化;③纵横比大于1;④边缘钙化中断,低回声突出钙化外;⑤甲状腺被膜受侵。
1.4 统计学方法

2 结果
2.1 病理检查结果
483个结节其中良性316个,平均最大径(27.4±6.5)mm;恶性结节167个,平均最大径(21.2±4.6)mm。其中316个良性结节包括结节性甲状腺肿214个(67.8%),甲状腺腺瘤86个(27.2%),甲状腺炎性改变16个(5.0%);167个恶性结节包括甲状腺乳头状癌153个(90.7%),甲状腺滤泡状癌4个(2.6%),髓样癌8个(5.3%),淋巴瘤2个(1.4%)。
2.2 483个结节不同恶性风险评估标准与病理结果的对照
2.2.1 2015 ATA分级标准与病理结果对比 2015 ATA分级标准每级结节的恶性率分别为:极低度可疑恶性1.8%、低度可疑恶性18.8%、中度可疑恶性37.8%、高度可疑恶性87.5%,2015年ATA未明确指出的类型(5.6%)恶性率为22.2%,各分类间的差异对甲状腺结节良恶性鉴别有统计学意义(P<0.05,见表1)。
表12015ATA分级标准与病理结果
Table12015ATAclassificationstandardandpathologicalresults
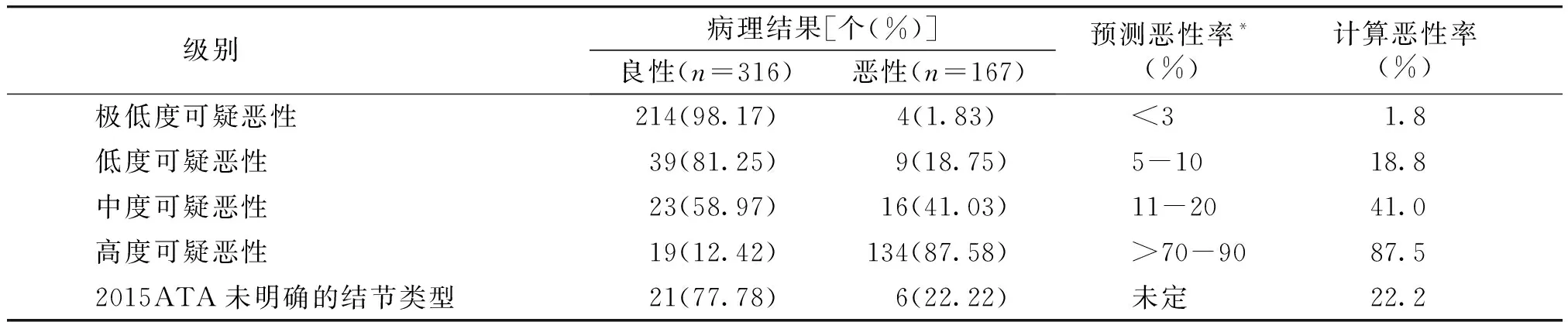
级别 病理结果[个(%)]良性(n=316)恶性(n=167)预测恶性率*(%)计算恶性率(%)极低度可疑恶性214(98.17)4(1.83) <31.8低度可疑恶性39(81.25)9(18.75) 5-1018.8中度可疑恶性23(58.97)16(41.03) 11-2041.0高度可疑恶性19(12.42)134(87.58) >70-9087.52015ATA未明确的结节类型21(77.78)6(22.22) 未定22.2
*预测恶性率为根据参考文献[3,9]列出的标准
2.2.2 TI-RADS分类标准与病理结果对比 TI-RADS分类标准每类结节的恶性率1级、2级、3级、4级、5级分别为6.2%,22.8%,33.3%,87.0%,93.9%,各分类间的差异对甲状腺结节良恶性鉴别有统计学意义(P<0.05,见表2)。
表2TI-RADS分类标准与病理结果
Table2TI-RADSclassificationstandardandpathologicalresults

级别病理结果[个(%)]良性(n=316)恶性(n=167)预测恶性率*(%)计算恶性率(%)1级255(93.75)17(6.25) 0-76.22级27(77.14)8(22.86) 8-2322.83级18(66.67)9(33.33) 24-5033.34级13(13.00)87(87.00) 51-9087.05级3(6.12) 46(93.88) 91-10093.9
*预测恶性率为根据参考文献[10]列出的标准
2.3 TI-RADS和2015 ATA指南分层标准最佳诊断界点的确定
对于TI-RADS,假设1-2级为甲状腺良性结节的诊断标准,计算得出敏感度、特异度、Youder指数和ROC曲线下面积分别为85.0%,89.2%,0.736和0.816。然后假设2-5级为甲状腺恶性结节的诊断标准即1级为甲状腺良性结节的诊断标准,计算得出敏感性、特异性、Youder指数和ROC曲线下面积分别为89.8%,80.1%,0.698和0.615。由于后者的Youder指数和ROC曲线下面积均小于前者,因此,TI-RADS分级的最佳诊断界点为2级。
对于2015ATA,假设极低度可疑恶性为甲状腺良性结节的诊断标准,计算得出敏感性、特异性、Youder指数和ROC曲线下面积分别为97.6%,67.7%,0.764和0.886。然后假设中度、高度可疑恶性和2015 ATA未明确的结节类型作为甲状腺恶性结节的诊断标准即极低度、低度可疑恶性为甲状腺良性结节诊断标准,计算得出敏感度、特异度、Youder指数和ROC曲线下面积分别为92.2%,80.06%,0.520和0.752。由于前者的Youder指数额和曲线下面积均大于后者,因此,2015 ATA指南分层标准的最佳诊断界点为极低度可疑恶性。
2.4 两种不同分级标准诊断效能的比较
2015 ATA及TI-RADS的曲线下面积分别为0.886和0.816,说明诊断均具有一定的准确性,且2015 ATA较TI-RADS具有更高的诊断效能。TI-RADS的特异度、准确率、阳性预测值高于2015 ATA指南(P<0.001),2015 ATA的敏感度显著高于TI-RADS(P<0.001),2015 ATA指南未提及的结节类型敏感度、特异度、阳性预测值、阴性预测值、准确率分别为88.0%,80.1%,70.0%,92.7%,82.8%(见表3)。
3 讨论
高分辨率超声是检测甲状腺疾病最为敏感的影像学检查方法,主要包括治疗前结节的恶性风险评估、推荐细针穿刺抽吸(FNA)、颈部淋巴结的转移风险评估、治疗后监测原发病灶的残留和复发转移,以及良性结节的随访、监测,其中甲状腺结节恶性风险评估对临床起着至关重要的作用[11]。TI-RADS是目前甲状腺结节良恶性病变鉴别诊断中最常用的超声诊断方法。2015ATA指南超声模型是最新提出的超声分类方法[12],目前在中国人群中的诊断价值尚未明确。本文通过2015 ATA指南与TI-RADS两种标准的对比研究,表明TI-RADS的特异性、准确性、阳性预测值高于2015 ATA指南,但是2015 ATA的敏感性显著高于TI-RADS分级。
表32015ATA与TI-RADS诊断效能的比较(%)
Table3Comparisonofdiagnosticefficiencybetween2015ATAandTI-RADS(%)

分类标准敏感度 特异度 阳性预测值 阴性预测值 准确率 TI-RADS85.0(142/167)*89.2(282/316)*80.7(142/176)*91.9(282/307)87.8(424/483)*2015ATA97.6(163/167)67.7(214/316)61.5(163/265)98.2(214/216)78.1(377/483)未明确提及的结节类型88.0(147/167)80.1(253/316)70.0(147/210)92.7(253/273)82.8(400/483)
与2015ATA相比,*P<0.001
Park等[5]提出的TI-RADS分类标准中,其推荐的恶性率依次为0%-7%、8%-23%、24%-50%、51%-90%、91%-100%。在本研究中TI-RADS分类标准,1级、2级、3级、4级及5级结节恶性率依次为6.2%,22.8%,33.3%,87.0%,93.9%。本研究结果与Park等[5]预测的恶性率范围相符。黄娴等[13]采用Park等[5]提出的TI-RADS对322例结节分级,计算得出1级、2级、3级、4级和5级的恶性率分别为3.4%,10%,40%,87.5%和94.1%。其中3级以上恶性率与本研究结果相近,但是1级和2级结节的恶性率低于本研究结果,这可能是由于本研究选取的对象恶性率较高。同时本研究发现3级及以上结节恶性率明显升高,需进一步检查。Park等[5]也提出3级以上结节需要进行FNA检测来明确结节的性质。马步云等[14]国内学者对Park等[5]提出的甲状腺分级标准进行了改良,将TI-RADS诊断标准中的3级分为3A(良性倾向)和3B(恶性倾向),以此计算出的各级恶性率分别为0%,6.3%,28.6%,44.4%,86.8%和100%,建议1和2级结节以定期随访观察为主,3级以上结节需要进行FNA检测或手术治疗。
2015 ATA指南超声模型提出的甲状腺超声恶性风险分层将结节分为5层,其各层推荐恶性率依次为<1%、<3%、5%-10%、10%-20%、70%-90%。在本次研究中发现高度、中度、低度及极低度可疑恶性率分别为87.5%,37.8%,18.8%,1.8%,低度、中度的恶性率较2015年ATA指南稍高。可能原因如下:本研究选取的研究对象恶性比率较高;超声图像为静态图像,可能造成一定的差异;不同的可疑超声特征(微钙化、边缘不规则、纵横比>1、低回声)对恶性程度评估的权重的不同。本研究表明TI-RADS分级的特异性、准确性、阳性预测值高于2015 ATA指南,2015 ATA指南的敏感度则高于TI-RADS分级,而Yoon等[8]的研究表明2015 ATA指南特异性高于TI-RADS分级,这可能是由于本研究选择的是Park分级标准而Yoon采用的是Kwak分级标准[15],Park分级标准主要是建立逻辑回归方程评估甲状腺结节恶性风险,相对较为准确。此外,2015 ATA指南未明确提及的结节,主要是具有一项或多项恶性征象的高回声、中等回声及部分囊性回声结节。而在本次研究中发现27例结节无法根据2015 ATA指南进行分级,此类结节多具有中等回声或高回声并伴有微钙化、边缘不规则、纵横比大于1、边缘钙化中断以及甲状腺被膜受侵等1个或多个可疑恶性征象。多数研究认为等/高回声提示良性,但是,Horvath等[6]提出的TI-RADS模型指出,当等回声无包膜结节伴微小钙化时,其恶性风险可超过80%。在Yoon等[8]研究中显示,3.4%的结节未能行ATA分级,其恶性风险为18.2%,低于本研究(22.2%),且其各个分级的恶性风险与本研究结果相比也偏低,这可能与研究人群的不同、超声医生的经验差异有关。
本研究存在的不足:样本量较小,具有一定的局限性。本次研究中FNA诊断率较高(67.1%),这可能导致一些恶性病变的漏诊。本研究图像为静止声像图,对结果可能造成一定的差异。
综上,本研究表明:2015 ATA指南和TI-RADS分类标准均对甲状腺结节恶性风险评估具有较高的准确率,TI-RADS分级的特异度、准确率、阳性预测值均高于2015 ATA,而2015 ATA的敏感度显著高于TI-RADS分级;2015ATA指南中未明确指出的结节类型具有相对较高的恶性率(22.2%),在临床工作中应高度重视。TI-RADS分类标准,计算较为复杂,更适合科学研究。2015 ATA指南中提出的超声恶性风险分层根据回声的类型联合恶性征象对结节进行评估,简明、易懂,敏感性和准确率较高,不易漏诊。

