真菌感染性胰腺坏死的临床分析:附46例报告
宁彩虹,黄耿文,申鼎成,林嘉晏,曹昕彤,纪连栋
(中南大学湘雅医院 胰胆外科,湖南 长沙 410008)
感染性胰腺坏死(infected pancreatic necrosis,IPN)是急性重症胰腺炎的主要死因之一,病死率达15%~45%[1-3]。由于广谱抗生素的广泛使用、肠外营养的长期应用、长期留置静脉导管以及侵入性操作应用的增加等原因,真菌性IPN的发病率有上升趋势[4-7]。然而,由于单纯抗真菌药物对真菌性IPN的治疗效果十分有限[8-9],外科手段在真菌性IPN的治疗中常发挥关键性作用。本文回顾性分析中南大学湘雅医院胰胆外科8年间连续收治的145例IPN患者,对真菌性IPN病例资料进行重点分析,旨在分析真菌性IPN的发病情况以及外科治疗与临床转归。
1 资料与方法
1.1 病例资料
回顾性分析2010年1月—2018年7月间中南大学湘雅医院胰胆外科收治的145例IPN患者临床资料,患者均符合急性坏死性胰腺炎诊断标准[10-12],并且胰周引流液的细菌或真菌培养为阳性。其中男102例,女43例;平均年龄46.9岁;胆源性65例,高脂血症性57例,其他原因23例;真菌性IPN 46例(31.7%),非真菌性IPN 99例(68.3%),其中41例同时合并细菌和真菌感染。46例真菌性IPN中,按照2012年修订的亚特兰大分类标准[10]分为中度重症21例,重症25例;病因主要包括胆源性(43.5%,20/46)、高脂血症性(43.5%,20/46)和其他原因(13.0%,6/46)。真菌性IPN与非真菌性IPN患者一般资料见表1。
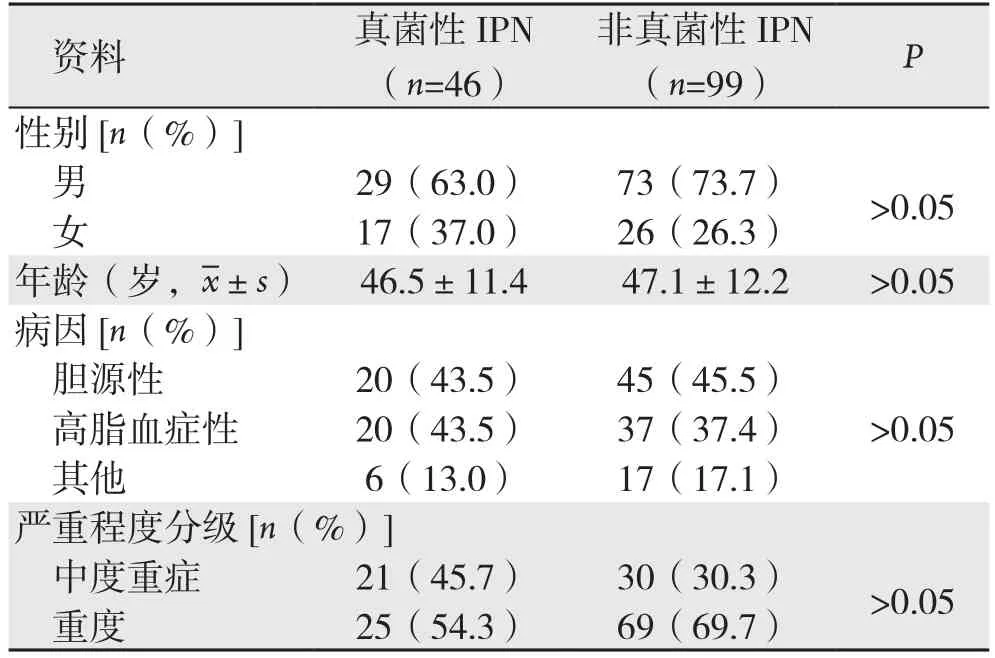
表1 真菌性IPN与非真菌性IPN患者一般资料Table 1 The general data of patients with fungal and non-fungal IPN
1.2 治疗方法
所有患者均按照急性胰腺炎诊治指南进行规范化治疗[11-13],包括早期积极液体复苏、器官功能支持、以肠内营养为主的营养治疗等,根据引流液培养结果及药敏试验合理选择敏感的抗生素或抗真菌药物。对于抗生素或抗真菌药物治疗无效的IPN,积极采取外科治疗方法,包括经皮穿刺置管引流(PCD)[14-16]、微创入路腹膜后胰腺坏死组织清除术(MARPN)[17-18]以及开放胰腺坏死组织清除术[18-19]等。根据患者具体情况,分别采取升阶梯策略或降阶梯策略[19-20]。
1.3 统计学处理
采用SPSS 23.0统计学软件对研究数据进行统计学分析。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以例数(百分数)[n(%)]表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 真菌性IPN的病原学及发病趋势
真菌性IPN发病率有逐年上升趋势,2017—2018年真菌性IPN占比达40.7%(图1)。根据引流液微生物培养结果,46例患者均为念珠菌感染,主要为白色念珠菌,占50.3%(25例次),其次为光滑念珠菌(14例次)和热带念珠菌(7例次)。

图1 真菌性IPN病例占比的年代分布Figure 1 Time distributions of cases with fungal IPN
2.2 真菌性IPN与非真菌性IPN患者的治疗与临床结局比较
46例真菌性IPN患者中,41例采取升阶梯治疗策略,5例采取降阶梯治疗策略。外科干预总次数159次,平均3.5次/例,PCD 1.7次/例,MARPN 1.3次/例,开放手术0.4次/例,相较于非真菌性IPN,真菌性IPN的外科干预次数以及MARPN手术次数明显增多(均P<0.05)。而两组间病死率、并发症率(包括肠瘘、胰瘘、出血等)、升阶梯治疗、ICU住院时间、外科干预后住院时间等均无统计学差异(均P>0.05)(表2)。
2.3 真菌血症患者与非真菌血症患者临床资料比较
46例真菌性IPN患者中,合并真菌血症4例,病死率高达75.0%(3/4),3例患者均死于感染性休克。非真菌血症42例,病死率14.3%(5/42),死因包括多器官功能不全(MODS)2例,感染性休克2例,失血性休克1例,两组病死率的差异有统计学意义(P<0.05)。而两组间性别、年龄、死因、外科干预次数、ICU住院时间以及外科干预后住院时间等均无统计学差异(均P>0.05)(表3)。
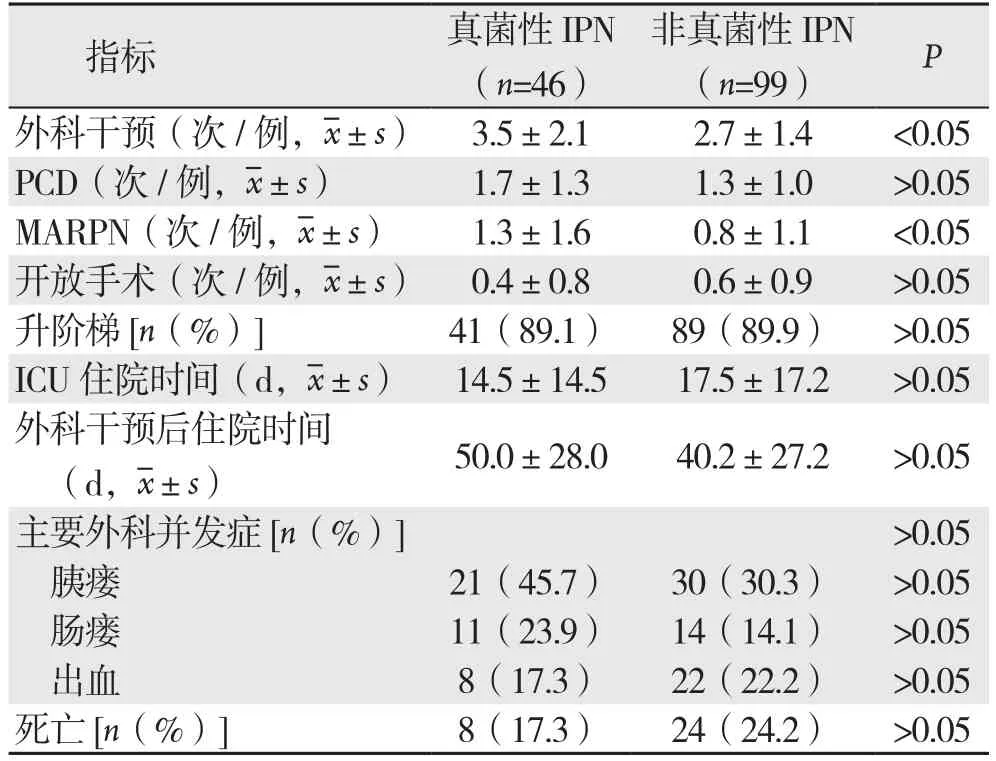
表2 真菌性IPN与非真菌性IPN患者的治疗及临床结局比较Table 2 Comparison of the treatment methods and clinical outcomes between patients with fungal and non-fungal IPN

表3 真菌血症与非真菌血症病例资料比较Table 3 Comparison of the clinical data between patients with and without bloodstream fungal infection
3 讨 论
近年来,由于重症医学技术和理念的进步,越来越多的急性重症胰腺炎患者得以从早期的MODS中得以幸存。胰腺坏死积液继发的感染正成为急性胰腺炎患者的主要死因。尤其对于同时合并持续性器官功能衰竭与IPN的危重型胰腺炎(CAP),病死率更是高达40%~100%[3,21]。以往的临床资料显示,IPN的主要病原菌包括各种革兰氏阴性和阳性的细菌,尤其是肠源性细菌的比例较高。但是,随着广谱抗生素和全胃肠外营养的广泛应用、留置静脉导管针以及侵入性操作的增加等因素,真菌性IPN的发生率呈逐渐上升的趋势。本组资料亦证实了这一点,近两年真菌性IPN的占比高达40.7%。其机制可能与肠道菌群紊乱、肠黏膜屏障受损、肠道通透性增加、肠道细菌移位以及机体的淋巴细胞功能障碍等相关[4-8]。除此之外,真菌性IPN的其它危险因素还包括男性、年龄>40岁、高APACHEⅡ评分、早期肾功能衰竭、早期机械通气、ERCP操作、糖尿病、入院时低血压、住院时间>4周等[6,8]。因此,临床上,对于有上述危险因素的患者,尤其是当常规抗菌药物治疗无效时,应考虑可能存在真菌感染。预防性应用抗真菌药物是否能有效预防胰腺坏死积液继发的真菌感染以及降低胰腺炎的病死率,至今仍然有较大争议。He等[22-23]认为预防性应用抗真菌药物(大蒜素或小剂量氟康唑)可降低急性重症胰腺炎患者真菌感染的发生率。但Chakrabarti等[24]则认为预防性使用氟康唑反而增加急性重症胰腺炎患者念珠菌的感染率,且可能增加患者病死率。
一旦诊断真菌性IPN,应积极根据药敏结果选用抗真菌药物。但是,目前的共识是,单纯应用抗真菌药物的治疗效果十分有限[8-9]。感染源控制(source control)仍是治疗真菌性IPN的关键措施[6]。既往,传统的开腹胰腺坏死组织清除术是治疗IPN的金标准。近年来,由于影像学、内镜学和外科等多学科的合作,微创技术不断涌现,并且逐渐替代传统开放手术,成为治疗IPN的金标准,大大降低了IPN患者的病死率与并发症发生率[17]。本中心145例IPN病例中,细菌性IPN 99例,同时合并细菌和真菌感染的IPN 41例,单纯真菌性IPN 5例。本中心的经验表明:以PCD、MARPN、以及内镜下引流或清创手术为代表的各类微创手术已成为治疗IPN的主流。对于有反复持续性高热等脓毒症表现、CT提示局限性坏死灶(单腔或多腔)包裹良好且液化充分的患者,首选B超/CT引导下PCD治疗,通过引流管对冲、调整引流管位置与口径达到充分引流;对于靠近胃十二指肠壁的坏死灶,除了PCD外,可通过超声内镜引导下坏死组织引流术(ETD)放置引流管或支架引流;固态坏死组织较多、有分隔、PCD后脓毒症仍不能控制时,进一步升阶梯行MARPN手术,通过反复多次手术以达到坏死组织彻底清除;而对于微创技术无法控制感染或合并肠瘘、大出血等严重并发症的患者,传统开放手术仍具有十分重要的价值[13-18]。
至于真菌性IPN的临床结局,一直颇有争议,文献报道的病死率为0~84%[4-5,7-9,25-29]。Reuken等[5,25-28]认为真菌感染增加急性胰腺炎患者的并发症率和病死率,并可能延长患者的ICU住院时间及总住院时间,合并真菌血症患者的病死率更高。但Vege等[29]认为真菌感染并不增加急性胰腺炎患者的病死率。本组研究中,真菌性IPN的病死率为17.3%,外科干预后住院时间为(50.0±28.0)d,与非真菌性I P N患者之间无统计学差异(P>0.05)。但真菌性IPN患者往往需要更多的外科干预,且当同时合并真菌血症时,患者的死亡风险明显增高(P<0.05)。因此,合理选用抗真菌药物及彻底的感染源控制是治疗真菌性IPN的关键措施。

