镍-磷电铸层中磷的质量分数的影响因素
宋云波,刘召昌
(1.东北大学 信息科学与工程学院,辽宁 沈阳110011;2.山东理工大学 化学与化工学院,山东 淄博255000)
0 前言
电铸具有复制和重复精度高等优点,在精密、异型及微/纳米制造方面具有广泛的应用[1-2]。为克服单金属电铸存在的缺陷,逐渐形成了合金电铸技术,其中最常见的是类金属元素磷[3-4]。镍的晶体结构为面心立方结构,晶格常数为3.520 A。一般情况下,当磷的质量分数较低(不大于8%)时,镍-磷镀层为晶态结构。虽然磷的质量分数超过了磷在镍中的固溶度(0.17%),但仍然以固溶体的形式存在,形成磷在金属镍中的过饱和固溶体。随着磷的质量分数的增大,镍的面心立方结构容纳不下磷原子,晶格受到扰乱,使镀层逐渐失去晶态特性。当磷的质量分数较高时,得到镍-磷的非晶态镀层。电铸层的晶型随磷的质量分数的变化而变化。当磷的质量分数小于8%时为晶态,大于15%时为非晶态,8%~15%时为混合状态[5]。非晶态结构属于热力学亚稳态,在一定温度下会发生晶化而改变结构,影响电铸层的性能。因此,有必要研究工艺参数对电铸层中磷的质量分数的影响。
1 实验
1.1 实验材料
基体材料为黄铜,试样尺寸为10.0 mm×15.0 mm×0.2 mm。
1.2 工艺流程
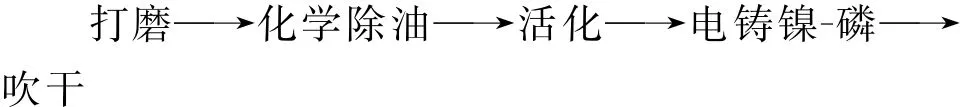
1.3 主要工序说明
(1)化学除油
NaOH 20~60 g/L,Na2CO320~60 g/L,Na3PO320~30 g/L,温度50~70℃,时间10~20 min。
(2)电铸镍-磷
NiSO4·6H2O 160~200 g/L,H3PO330~50 g/L,CH3COOH 30~60 mL/L,柠檬酸15~20 g/L,添加剂1~2 g/L,pH值2.0~3.5,电流密度1.5~3.0 A/dm2,温度50℃。
1.4 性能测试
采用日立S-3400型扫描电子显微镜观察电铸层的形貌。采用扫描电子显微镜附带的EDS能谱分析仪测试电铸层的成分。
2 结果与讨论
2.1 电流密度对电铸层中磷的质量分数的影响
图1为不同电流密度下所得电铸层的能谱图。表1为电流密度对电铸层成分的影响。
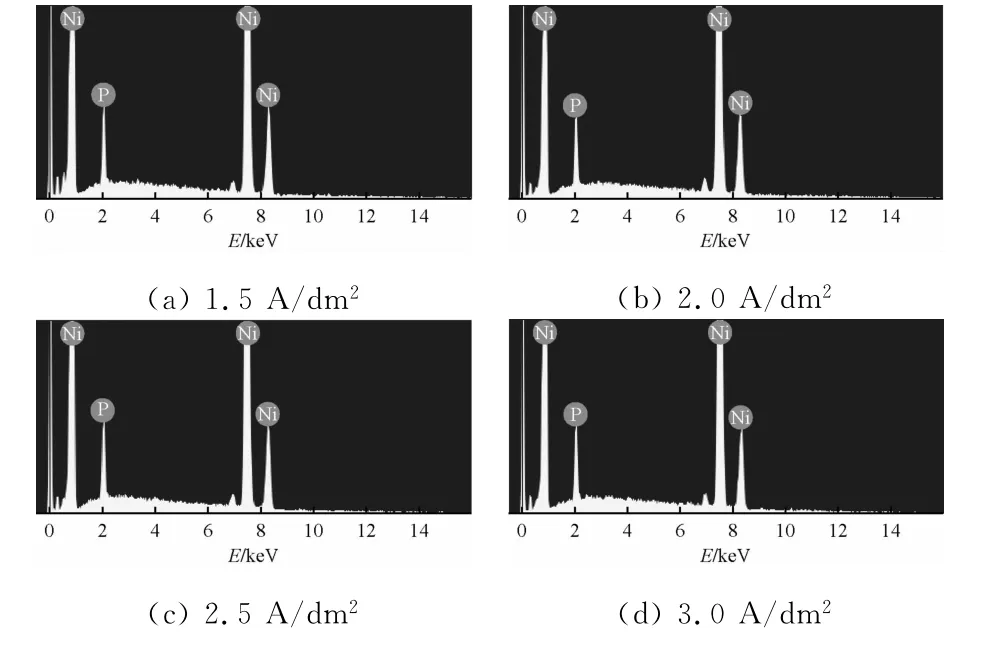
图1 不同电流密度下所得电铸层的能谱图

表1 电流密度对电铸层成分的影响
由表1可知:随着电流密度的增大,电铸层中磷的质量分数逐渐降低[6]。此变化趋势可以用镍磷共沉积的间接机制解释。共沉积的理论模型为:

在阴极表面,具有电化学活性的Ni2+比H3PO3更容易放电。向电解液中加入H3PO3,可以加速Ni2+的还原。当电流密度较小时,外加电流主要用于反应(1)和反应(2)。此时,增大电流密度可以加快后面两个反应,使电铸层中磷的质量分数增大。当电流密度较大时,增大电流密度可以同时加快前三个反应。而反应(3)可以为最后一个反应提供足够的反应物,促进反应的进行。Ni2+比H3PO3更容易在阴极表面放电,反应(4)是一般的化学反应,对电流密度的变化依赖较小,导致电铸层中磷的质量分数减小。
2.2 H3 PO3对电铸层中磷的质量分数的影响
图2为不同H3PO3的质量浓度下所得电铸层的能谱图。表2为H3PO3的质量浓度对电铸层成分的影响。

图2 不同H3 PO3的质量浓度下所得电铸层的能谱图
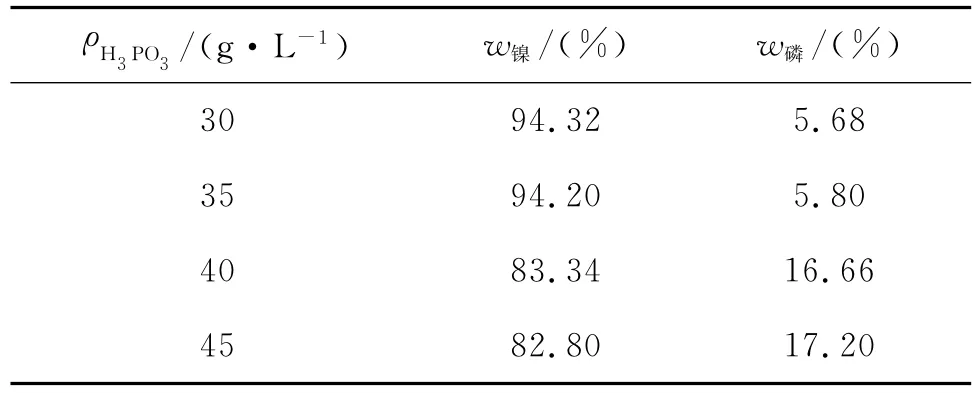
表2 H3 PO3的质量浓度对电铸层成分的影响
由表2可知:电铸层中磷的质量分数随H3PO3的质量浓度的增加而增大。H3PO3中的P不能通过阴极还原直接析出,可以假设为配位离子[7]。用镍磷共沉积机制解释,随着H3PO3的质量浓度的增加,会促使反应(3)向右进行,产生的PH3会进一步促进反应(4)的进行,使得电铸层中磷的质量分数增大。当电解液中H3PO3的质量浓度达到一定值时,阴极吸附的配位离子会达到极大值[8],故电铸层中磷的质量分数趋于稳定。
2.3 pH值对电铸层中磷的质量分数的影响
图3为不同pH值下所得电铸层的能谱图。表3为pH值对电铸层成分的影响。
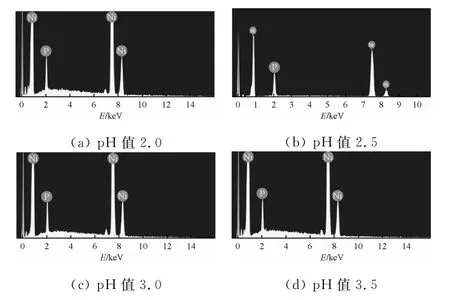
图3 不同pH值下所得电铸层的能谱图
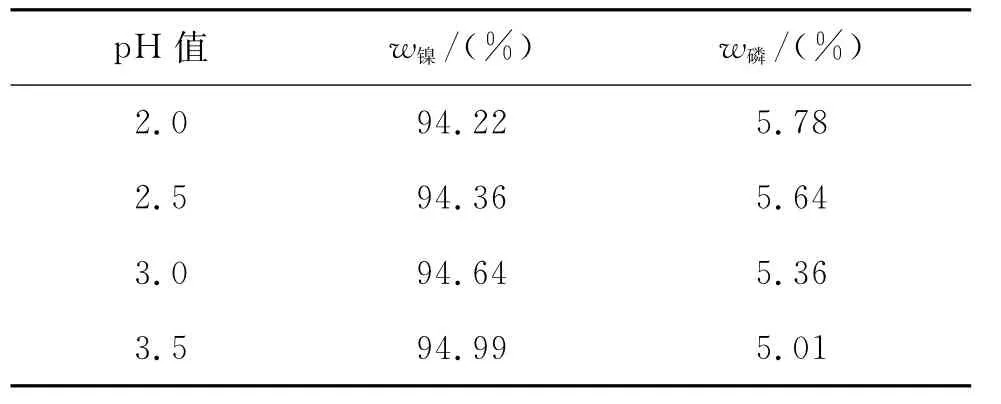
表3 pH值对电铸层成分的影响
由表3可知:随着pH值的增加,电铸层中磷的质量分数逐渐减小。由镍磷共沉积机制可知,随着pH值的增加,电解液中H+的浓度逐渐减小,使得式(3)的反应速率减小,导致PH3减少,进而影响反应(4)的进行。溶液中的粒子扩散到溶液/基体界面需要一定的时间。pH值较高时,电沉积速率较快,阴极氢气泡可以有效地搅拌电解液,导致电铸层的截面产生片状结构。另一种解释是,pH值不同时,Ni2+与配位剂形成的螯合物的稳定性发生变化。随着pH值升高至中性,酸性介质中稳定存在的螯合物将解离,形成弱的螯合物,使电铸层中磷的质量分数降低[9]。
3 结论
随着电流密度的减小、H3PO3的质量浓度的增加、pH值的减小,电铸层中磷的质量分数逐渐增大。

