Fenton法处理配位含镍废水的研究
张 彦,严晨之,沈 洋,王云丽,范凯霞,沈拥军
(南通大学 化学化工学院,江苏 南通226019)
0 前言
镀镍是应用最广泛的镀种之一[1-2]。在电镀行业快速发展的同时,也造成了许多环境污染问题,重金属污染就是其中一种。镍作为重金属的一种,会在环境及动植物体内累积,并且不可降解,影响动植物的生长发育,尤其是会对人体健康造成危害[3]。在电镀过程中,配位剂对镀件的质量起着重要作用,但也提高了废水处理的难度。要实现电镀行业的可持续发展,就必须找到更加高效的处理方法。本文采用Fenton法处理配位含镍废水,并研究了反应温度、废水初始pH值、H2O2的质量浓度、FeSO4·7H2O与H2O2的质量比、初始EDTA的质量对废水处理效果的影响。
1 实验
1.1 实验试剂
NiSO4·6 H2O、EDTA、30%的 H2O2、FeSO4·7 H2O、NaOH、H2SO4,以上试剂均为分析纯。
1.2 实验仪器
BSA124S型电子分析天平,AA320N型原子吸收分光光度计,SHA-C型水浴恒温振荡器,微孔滤膜(25.00 mm×0.22μm),PHS-25型酸度计。
1.3 实验方法
量取100 mL EDTA-Ni2+废水(Ni2+的质量浓度为11.2 mg/L,EDTA的质量浓度为150 mg/L),调节废水初始pH值为3,然后加入1.8 mL H2O2溶液和0.036 g FeSO4·7H2O,即H2O2的质量浓度为6 g/L,m(FeSO4·7H2O)∶m(H2O2)=0.06。控制反应温度依次为20℃、30℃、35℃、45℃、60℃、70℃,在同一反应温度下依次振荡5 min、15 min、30 min、45 min、60 min和90 min后取样。向取出的溶液中加入NaOH溶液,调节pH值为碱性,静置沉淀30 min。取上清液用微孔滤膜过滤,最后用火焰原子吸收分光光度法检测滤液中Ni2+的质量浓度并计算其去除率。采用控制变量法分别调节废水的初始pH值、H2O2的质量浓度、Fe2+和H2O2的质量比、初始EDTA的质量,反应45 min后取样,检测滤液中Ni2+的质量浓度并计算其去除率。
2 结果与讨论
2.1 反应温度对EDTA-Ni2+废水处理效果的影响
在初始pH 值为3、H2O26 g/L、m(FeSO4·7H2O)∶m(H2O2)=0.06的条件下,考察不同反应温度下Ni2+的去除率随反应时间的变化情况,结果如图1所示。由图1可知:在反应时间相同的条件下,反应温度越高,废水的处理效果越好。反应温度过低,反应速率慢,所需反应时间长。因此,处理废水时需要选择合适的反应温度。对于一般的化学反应,随着反应温度的升高,反应平均动能增大,反应速率加快;对于一个复杂的反应体系,反应温度升高不仅加速主反应的进行,还加速副反应和相关逆反应的进行。最终确定最佳的反应温度为45℃。

图1 不同反应温度下Ni2+的去除率随反应时间的变化情况
2.2 初始pH值对EDTA-Ni2+废水处理效果的影响
在反应温度为45℃、H2O26 g/L、m(FeSO4·7H2O)∶m(H2O2)=0.06的条件下反应45 min,研究初始pH值对EDTA-Ni2+废水处理效果的影响,结果如图2所示。由图2可知:当初始pH值为3时,废水的去除效果最好,Ni2+的去除率最高(为88.66%)。当初始pH值为2时,Ni2+的去除率仅为66.64%。可见,过酸不利于Fenton反应的进行。当初始pH值大于4时,废水的处理效果逐渐下降,但趋势平稳。当溶液处于中性时,Ni2+的去除率为79.53%。而当溶液处于碱性时,Ni2+的去除率仍大于76.93%。这可以用Fenton试剂的经典理论来解释。Fenton试剂是由H2O2和Fe2+组成的具有强氧化性的体系。Fe2+的催化能力与其在水中的存在状态有关。由于反应过程中存在着Fe2+和Fe3+的转化问题,过高的酸度不利于Fe3+向Fe2+转化,使得催化效果受到影响,反应不能正常进行。当pH值为中性或碱性时,Fe2+的形态则会发生变化,这种变化会导致催化效果变差,甚至使其失去催化能力。因此,处理EDTA-Ni2+废水时将初始pH值调至3。
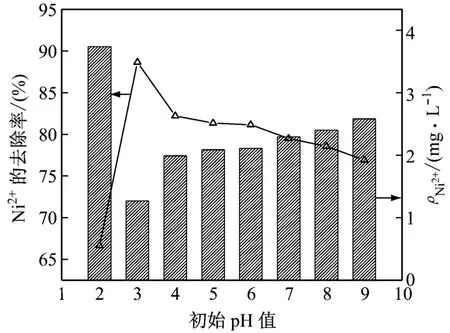
图2 初始pH值对废水处理效果的影响
2.3 H2O2的质量浓度对EDTA-Ni2+废水处理效果的影响
在初始pH值为3、反应温度为45℃、m(FeSO4·7H2O)∶m(H2O2)=0.06、反应时间为45 min的条件下,研究H2O2的质量浓度对EDTANi2+废水处理效果的影响,结果如图3所示。由图3可知:当H2O2的质量浓度为4~10 g/L时,随着H2O2的质量浓度的增加,Ni2+的去除率呈上升趋势。而当H2O2的质量浓度超过10 g/L时,Ni2+的去除率有所下降。这是因为H2O2的质量浓度越高,反应生成的羟基自由基就越多,废水处理效果也就越好。但随着H2O2的质量浓度的增加,过量的H2O2会与体系中的羟基自由基反应,导致羟基自由基的浓度减小,并且过量的H2O2会将Fe2+氧化成Fe3+,使得Fe2+的有效利用率降低,不利于反应的进行。最终确定H2O2的最佳质量浓度为10 g/L。

图3 H2O2的质量浓度对废水处理效果的影响
2.4 FeSO4·7H2O与H2O2的质量比对EDTANi2+废水处理效果的影响
在初始pH值为3、反应温度为45℃、H2O210 g/L、反应时间45 min的条件下,研究FeSO4·7H2O与H2O2的质量比对EDTA-Ni2+废水处理效果的影响,结果如图4所示。由图4可知:随着FeSO4·7H2O与H2O2的质量比的增大,Ni2+的去除率不断增大;当FeSO4·7 H2O与H2O2的质量比大于0.06时,Ni2+的去除率逐渐趋于平缓。当Fe2+的投加量较小时,生成的羟基自由基浓度较低,不利于反应的进行,废水处理效果较差。增加Fe2+的投加量时,羟基自由基随Fe2+的增多而增多,生成充足的羟基自由基,促进了Fenton反应的进行,使得废水处理效果变好。当FeSO4·7H2O与H2O2的质量比为0.06时,Ni2+的去除率达到94.14%,原废水的破络基本完成。
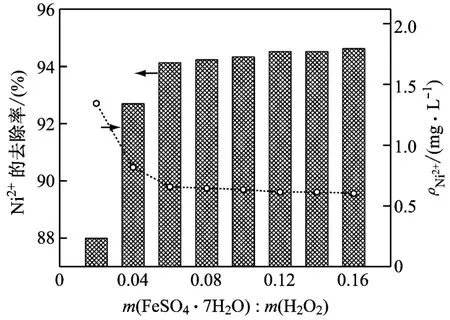
图4 Fe2+与H2O2的质量比对废水处理效果的影响
2.5 初始EDTA的质量对EDTA-Ni2+废水处理效果的影响
在初始pH值为3、反应温度为45℃、反应时间为45 min、H2O210 g/L、m(FeSO4·7H2O)∶m(H2O2)=0.06的条件下,保持初始Ni2+的质量浓度为11.2 mg/L,研究初始EDTA的质量对EDTA-Ni2+废水处理效果的影响,结果如图5所示。由图5可知:随着初始EDTA质量的增加,在同样的反应条件下,Ni2+的去除率越来越低,废水处理效果越来越差。

图5 初始EDTA的质量对废水处理效果的影响
3 结论
(1)在采用Fenton法处理EDTA-Ni2+废水的过程中,反应温度升高能缩短反应到达平衡的时间。最合适的反应温度为45℃。
(2)在采用Fenton法处理EDTA-Ni2+废水的过程中,当初始pH值为3时,废水处理效果最好。
(3)Fenton反应的机制非常复杂,存在多个反应。Fenton试剂会对反应起到一定的促进或阻碍作用。在 H2O2的质量浓度为10 g/L、FeSO4·7 H2O与H2O2的质量比为0.06时,Ni2+的去除率达到94.14%。

