成年鸡小脑浦肯野细胞向海马结构及副高纹状体直接投射的透射电镜观察❋
张集祥 孔 雪 王 军 王政富 陈 芳 赵海全 刘为民
(佛山科学技术学院, 佛山 528231)
长期以来,小脑被认为是调节运动功能的脑结构,但在过去的10年中,小脑的认知功能已经逐渐为人们确认,特别是其在导航中的功能已为实验所证实[1-4]。例如,利用转基因小鼠LT-PKC1,研究者表明小脑皮层出现的长时程突触后抑制(LTD)在基于海马内地图而进行的路径优化上具有重要作用,小脑缺乏平行纤维对浦肯野细胞树突的LTD时,将会严重影响海马位置细胞的发放[1,4]。许多研究都表明小脑对于海马发挥其空间认知和空间记忆功能产生重要影响。但是,小脑对海马的支配途径却一直不太明确,在哺乳动物仅见Heath等[5]1974年在成年恒猴和猫所做的研究,表明存在小脑顶核向海马CA2、CA3、齿状回、杏仁核的基外侧核以及下托的直接投射,但是有关小脑皮质是否有向海马结构的直接投射仍未见报道。副高纹状体为海马结构外侧的脑结构,在端脑背侧形成明显的背侧矢状隆起。Watenabe等[6]认为鸟类的副高纹状体主要处理物体在哪里的信息,其内脑皮(entopallium)负责处理物体的形状、颜色、质感等物体本身的信息;Wild等[7]证实鸽子副高纹状体嘴侧端发出纤维到达小脑皮质,终止于小脑皮质的三个层里,属于非攀缘-非苔藓纤维,表明禽类的副高纹状体与小脑在功能上和形态上有密切联系。本实验室前期的工作表明,在青年鸡存在小脑皮质的浦肯野细胞向海马的直接投射[8],本研究进一步利用电损毁-透射电镜观察了成年鸡小脑向海马和副高纹状体的直接投射。
1 材料和方法
1.1 实验动物
4月龄粤禽黄鸡20只,雌雄不拘,体重约1.8kg,购自佛山南海种鸡场。
1.2 主要试剂
多聚甲醛购自天津百世化工有限公司;戊二醛购自天津大茂化学试剂厂;锇酸由中山大学医学院电镜室提供;水合氯醛(分析纯)购自天津科密欧化学试剂有限公司;辣根过氧化物酶(horseradish peroxidase, HRP, RZ=3, SigmaⅣ型)、硝普钠(亚硝基铁氰化钠, Sodium nitroferricyanide)、四甲基联苯胺(3,3′,5,5′-四甲基联苯胺,TMB)、二甲胂酸钠均购自Sigma-Aldrich公司。
1.3 主要仪器
江湾Ⅰ型C小动物脑立体定位仪,上海奥尔科特生物科技有限公司;KD-500型推拉式三用切片机,KD-Ⅳ电脑快速制冷器,浙江科迪仪器设备有限公司;1μl微量进样器,上海光正医疗仪器有限公司;Tiger显微图像分析系统,暨南大学组织学与胚胎学教研室;LKB-V型超薄切片机,Leika公司;Philips CM-10型透射电镜,荷兰Philips公司。
1.4 HRP逆行追踪
按3ml/kg经腹腔注射10%水合氯醛溶液进行全麻,将动物固定于江湾Ⅰ型C小动物脑立体定位仪,开颅,将已吸取40%HRP水溶液的玻璃微针(内径20~40μm)固定于立体定位仪的电极夹持器上,在正中矢状面(以矢状窦判定)稍偏左侧的部位向端脑海马进针,注射量0.6μl,留针15min,缝合创口。术后存活3d,按Mesulam[9]方法灌注固定,取端脑两半球、小脑和脑干,翌日制冰冻连续切片。切片经TMB成色,自然干燥后中性红复染,脱水、透明、中性树脂封片后显微镜观察,摄影。
1.5 电凝损毁小脑术
按3ml/kg经腹腔注射10%水合氯醛溶液进行全麻,将动物固定于江湾Ⅰ型C小动物脑立体定位仪,外科方法开颅,于电极夹持器固定一自制的损毁电极(单电极),电极尖端暴露1~1.5mm,按预先确定位置向小脑Ⅵ叶表层进针约2.5mm(硬膜下),然后接通直流电正极,负极接于动物肛门上,通以5mA的直流电4min。术后缝合伤口,密切观察护理。
1.6 透射电镜观察
动物存活7d,重新深度麻醉,绑缚固定,开胸,经升主动脉灌注0.7%禽生理盐水400ml,然后灌注用0.1mol/L二甲胂酸钠-盐酸缓冲溶液(pH7.4)溶解的含3%多聚甲醛、1.25%戊二醛的固定液500ml。注毕取脑,投入2.5%戊二醛溶液中4℃过夜,翌日取小脑作冷冻连续切片,甲苯胺蓝染色,上行乙醇脱水,二甲苯透明,中性树脂封片,观察损毁准确性。对于损毁部位准确的个体,选左侧海马结构的海马(Hp)、旁海马内侧区(APHm)和副高纹状体(HA)的前后部及端脑谷(Va)部位取电镜材料(图1),2.5%戊二醛后固定4h,PBS漂洗,锇酸固定2h,上行梯度丙酮脱水,Epon 812浸透包埋,作半薄切片(厚1μm),以进行光镜定位,然后制作超薄切片,常规电镜染色,于Philips CM-10型透射电镜下观察照相。

图1 端脑电镜观察的取材部位,★示端脑的取材部位。A: 距“0”点向前6.8mm;B: 距“0”点向前8.6mm。Hp: 海马;APHm: 旁海马内侧区;APHi: 旁海马中间区;APHim: 旁海马中间区内侧部;APHil: 旁海马中间区外侧部;APHI: 旁海马外侧区;HA: 副高纹状体;HD: 背高纹状体;Va: 端脑谷;IHA: 间副高纹状体;HV: 腹高纹状体.
Fig 1 The sites of sampling in the telencephalon for electron microscope observation, ★ showed the sites of sampling in the telencephalon. A: At the level of 6.8mm anterior to the zero point; B: At the level of 8.6mm anterior to the zero point. Hp: Hippocampus; APHm: Medial subdivision of parahippocampus; APHi: Intermediate subdivision of parahippocampus; APHim: Medial part of the intermediate subdivision of parahippocampus; APHil: Lateral part of the intermediate subdivision of parahippocampus; APHI: Lateral subdivision of parahippocampus; HA: Hyperstriatum accessorium; HD: Hyperstriatum dorsale; Va: Vallecula telencephali; IHA: Intermedium hyperstriatum accessorium; HV: Hyperstriatum ventrale.
2 结果
2.1 HRP追踪小脑内标记细胞
鸡小脑内第Ⅰ~Ⅹ叶皮质中的浦肯野细胞层均可见被逆行标记的浦肯野细胞(图2),其中Ⅷ、Ⅸ、Ⅹ叶的标记细胞最多,标记细胞以对侧较多,细胞内标记颗粒疏淡,但清晰可见。
2.2 电凝损毁部位
与哺乳类小脑一样,禽类的小脑皮层也分为3层,包括分子层(molecular layer, ML)、浦肯野细胞层(Purkinje cell layer, PCL)和颗粒层(granular layer, GL)[10]。本实验采用5mA正电极刺入小脑Ⅵ叶内,电凝4min,产生损毁(图3A、C),此点位于Ⅵ叶皮质部位,可见其内浦肯野细胞层和颗粒层细胞均受到损毁,大量浦肯野细胞和颗粒细胞消失成为空白区,部分分子层内无明显细胞结构,结构模糊,电损毁位置和效果均较为理想。
2.3 海马结构的溃变终末与溃变纤维
采取电凝损毁小脑Ⅵ叶后,在海马结构的Hp、APHm部位和副高纹状体的前后部位及脑谷部位均可观察到溃变的终末,在Hp、APHm内可观察到极少量的溃变纤维。
溃变纤维为细的薄髓纤维,电镜下见髓鞘分层解散,轴浆皱缩,部分轴索内出现结构异常的膜性结构(图4G)。

图2 HRP注射位点及小脑标记细胞。A: 海马结构的HRP注射点,低倍镜,×26.8,白色箭头示注射点;B: 小脑Ⅵ叶皮质中被标记的浦肯野细胞,低倍镜,×66;C: 为B图矩形框的放大,高倍镜(油镜)下标记的浦肯野细胞,×680;↑示标记的浦肯野细胞;VL: 侧脑室;Hp: 海马;APHm: 旁海马内侧区;APHim: 旁海马中间区内侧部.
图3 小脑Ⅵ叶皮质电损毁部位。A: 小脑损毁部位,矢状切面,低倍放大,↑表示损毁位置,冰冻切片,未经染色;B: 为A经甲苯胺蓝染色,↑表示损毁位置;C: 为B图中矩形框部的局部放大图,高倍放大(×132),↑示损毁的浦肯野细胞层,★示颗粒细胞消失形成的空白区,◆示结构模糊的分子层;ML: 分子层;PCL: 浦肯野氏细胞层;GL: 颗粒层.
Fig 2 The injection site of the horseradish peroxidase and the labeled cells in the cerebellum. A: Lower magnification (×26.8) of the site of the horseradish peroxidase injection in the hippocampal formation, the white arrowhead showed the injection site; B: Lower magnification (×66) of the labeled Purkinje cells in the cerebellar cortex of the folium Ⅵ in the cerebellum. C: The higher magnification (oil immersion objective, ×680) of the labeled Purkinje cells in the enlargement of the rectangle in B. ↑showed the labeled Purkinje cells; VL: Lateral ventrical; Hp: Hippocampus; APHm: Medial subdivision of parahippocampus; APHim: Medial part of the intermediate subdivision of parahippocampus.
Fig 3 Site of electric destroying in the cerebellar cortex of the folium Ⅵ. A: Lower magnification of the destroyed site in the cerebellum, sagittal section; ↑ indicating the destroyed site. B: Lower enlargement of the same section in A, stained with toluidine blue, ↑ indicating the destroyed site. C: Higher enlargement (×132) of the rectangule in B, ↑ showed the destroyed Purkinje cells, ★ showed the destroyed area in the granular cell layer, ◆ showed the irregular structure in the molecular layer near the destroyed site. ML: Molecular layer; PCL: Purkinje cell layer; GL: Granular layer.
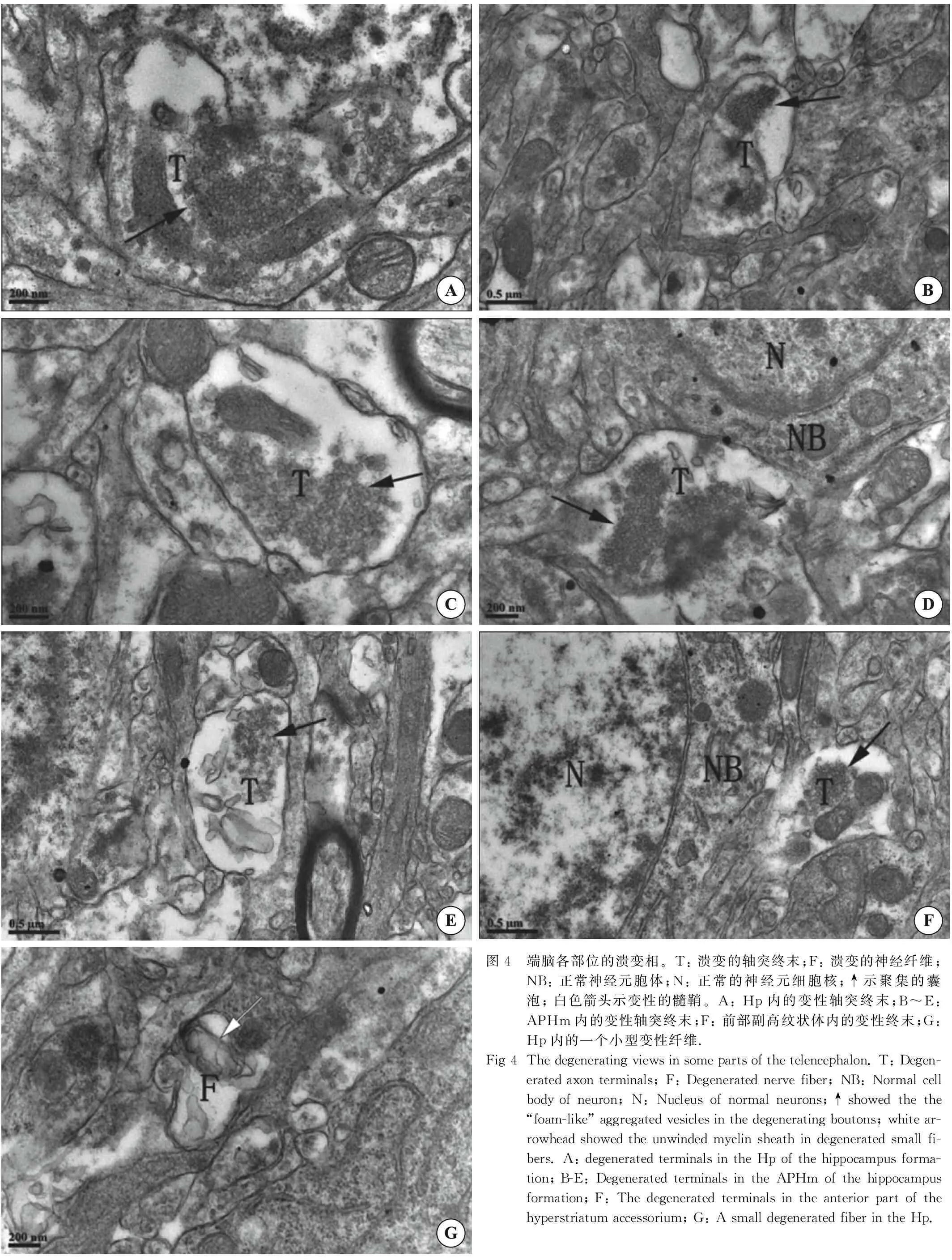
图4 端脑各部位的溃变相。T: 溃变的轴突终末;F: 溃变的神经纤维;NB: 正常神经元胞体;N: 正常的神经元细胞核;↑示聚集的囊泡; 白色箭头示变性的髓鞘。A: Hp内的变性轴突终末;B~E: APHm内的变性轴突终末;F: 前部副高纹状体内的变性终末;G: Hp内的一个小型变性纤维.Fig 4The degenerating views in some parts of the telencephalon. T: Degen-erated axon terminals; F: Degenerated nerve fiber; NB: Normal cell body of neuron; N: Nucleus of normal neurons;↑showed the the “foam-like” aggregated vesicles in the degenerating boutons; white ar-rowhead showed the unwinded myclin sheath in degenerated small fi-bers. A: degenerated terminals in the Hp of the hippocampus forma-tion; B-E: Degenerated terminals in the APHm of the hippocampus formation; F: The degenerated terminals in the anterior part of the hyperstriatum accessorium; G: A small degenerated fiber in the Hp.
溃变终末常见出现于结构正常的神经元胞体旁,常见的溃变相有: (1) 终末内囊泡聚集,形成所谓“泡沫型”变性,大部分变性终末内囊泡为圆形清亮小泡,无核心,聚集的囊泡团周围有明显的空白区;线粒体结构模糊;部分变性终末可见与神经元胞体形成轴-体突触(图4A、D、F);(2) 水肿型变性,终末内出现大片低电子密度的空白区,部分高电子密度结构聚集,线粒体孤立而明显,其周边电子密度低(图4C);(3) 异常膜结构型,在终末内出现结构异常的的变性膜结构(图4E)。
2.3.1 海马结构的Hp和APHm内的溃变结构 Hp内可见较多的溃变终末,溃变终末内囊泡为圆形清亮小泡,聚集,聚集团外围是大片的电子空白区,可见溃变终末与神经元胞体形成轴-体突触(图4A),并可观察到少量的溃变纤维(图4F);APHm内也可观察到多量溃变终末,且其变性终末多见于与树突形成的轴树突触(图4B、C),少量突触为轴体突触(4D)。
2.3.2 副高纹状体前、后部内的溃变情况 HA前部内只见少量的溃变终末(图4F),且溃变不明显,未见溃变纤维;HA后部较前部位溃变终末多,且溃变程度显著,但未观察到溃变纤维。
2.3.3 端脑谷 几乎见不到典型的溃变终末,偶见终末内囊泡聚集,但囊泡团周围空白区少而狭窄。不明显。
3 讨论
本实验采用电凝损毁小脑Ⅵ叶皮质部位,探讨小脑向端脑的海马结构、副高纹状体和端脑谷部位的直接投射。在损毁对侧的海马结构的Hp、APHm部位内均可观察到多量的溃变终末和少量溃变纤维,但APHm部位观察到的溃变终末和纤维不如Hp部位观察到的多;在副高纹状体的前后部位只可观察到少量溃变终末,这说明小脑向端脑的直接投射主要投射到海马结构,且大部分集中在海马结构的Hp。王政富等[11]曾采用红藻氨酸选择性损毁青年鸡小脑Ⅵ叶浦肯野细胞,在海马结构APHm内观察到溃变终末。笔者在成年鸡中却观察到这一位置出现的变性终末和纤维较少,可能是因为禽类在成长发育过程中,其小脑向海马结构的直接投射逐渐减少造成的。在动物的幼年时期,中枢神经系统尚未完善,存在不同来源神经投射的相互竞争[12],朱宁等[13]研究表明海马结构的神经联系在发育过程中不断地清除出生后大量的异常的神经联系,从而达到神经系统的高效性,避免冗余和错误建设。
关于脊椎动物小脑向海马结构进行信息输送的研究是目前小脑功能研究的热点问题,涉及到小脑乃至前庭感觉系统参与动物空间认知和空间记忆的形成[14]。在哺乳动物,小脑汇集了躯体本体的和外感的大量信息,小脑整合后信息的输出经浦肯野细胞到达顶核、齿状核和间置核(栓状核和球状核),换元中继后到达丘脑的腹外侧核后部和腹后外侧核,由后两者再中继发出到大脑新皮质的体躯感觉区,形成个体对所处环境的空间认知以及个体本身姿势的知觉[3]。海马结构是近20年发现的另一个重要的空间认知和空间记忆的脑结构,其内存在大量的位置细胞、网格细胞、边缘细胞、头部朝向细胞,发挥着空间认知、空间记忆、空间导航的作用,然而这类神经元是如何获得自体和客体的空间信息,一直没有明确的答案。禽类的海马结构具有类似于哺乳动物海马结构的功能和形态。本实验结果再次印证了笔者前期的观察,即在鸡存在着小脑向海马结构的直接投射。本实验也进一步证明,在成年鸡同样具有直接的小脑向海马结构的投射,并且这种投射包括了副高纹状体。