儿童胃胃肠间质瘤伴淋巴结转移1例并文献复习
崔晓晗,李汝东,刘昊,王旭东
(130041长春,吉林大学第二医院 胃肠营养及疝外科)
胃肠间质瘤(gastrointestinal stromal tumors,GIST)是一类临床上少见的肿瘤,占胃肠道肿瘤的1%~3%[1],发病率为百万分之14至20。一般成人中多见,好发年龄段为50~70岁,儿童发病十分罕见。儿童与成人的好发部位均为胃[2],约占总病例数的60%[3]。儿童GIST患者国内外报道均罕见,其中儿童GIST伴淋巴结转移发病率极低[4]。本中心于2016年11月30日收治一例儿童胃GIST患者,本文结合其发病机制、病理及免疫组化特征、临床及辅助检查、诊断、治疗及其预后等多方面,进行深入总结分析,以求提高儿童胃GIST的诊治水平。
1 临床资料
患者女,10岁,因“面色苍白1年半,呕吐、腹痛、腹泻3天”于2016年11月30日入院。于入院前1年半患儿出现面色苍白、乏力,就诊于当地医院,检查血红蛋白低(具体含量不详),诊断为“缺铁性贫血”。入院体格检查:重度贫血貌,上腹部饱满,左上腹部轻压痛,其余体格检查未见阳性体征。HGB:44.0g/L。CT平扫+增强示:胃窦部及胃小弯侧见巨大不规则囊实性肿块影,其内密度不均,CT值:28~75HU。病灶与胃壁及周围肠管分界欠清,增强扫描呈明显不均匀强化,肿瘤实质强化明显,周围片状高密度及囊性部分未见强化,胃窦部壁略厚。腹膜后及胃小弯旁见多发结节状软组织密度影,大者位于胃小弯旁,短径约8.5mm。增强扫描明显强化(图1)。2016年12月12日于全身麻醉下行剖腹探查术,术中见腹腔内无腹水,肿瘤位于胃窦小弯近前壁,延伸至胃后壁,向上至近胃底,大小约8.5cm×3.0cm×2.5cm,活动度尚可,向后侵犯胰腺,向左侵犯脾,VIII、XI组淋巴结肿大,考虑为胃间质瘤可能性大,决定行胃大部切除术加淋巴结清扫,行残胃空肠远端毕Ⅱ式吻合(输入端对小弯)。切除物见图2。术后常规病理示:GIST(上皮样细胞型),肿物最大径13cm,核分裂像约10个/50HPF ,高危险度(图3)。免疫组化:CD117(+)、DOG1(+)。术后患者恢复良好,术后第5天进流食,第7天进半流食,第10天拆线出院。建议患者行PDGFRA和c-kit 基因检测,协助评估使用酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)作靶向治疗,但因经济原因,患者未行基因检测及口服靶向药物。术后随访8个月,复查CT及胃镜未见肿瘤复发。
2 讨 论
GIST被认为起源于胃肠道肌间神经丛的Cajal细胞(ICC)相关或向其分化的干细胞,是来源于胃肠道或腹腔内其他软组织的间叶源性肿瘤[5]。组织学上,该肿瘤通常可分为:梭形细胞型(70%)、上皮样细胞型(20%)和梭形细胞-上皮样细胞混合型 (10%)。免疫组化检测CD117阳性率为94%~98%,DOGl阳性率为94%~96%,且二者具有高度一致性[6-8]。在成人中,约有85%~95%的患者存在KIT基因的突变,约有5%的患者存在血小板源性表皮生长因子受体(PDGFRA)基因的突变[9-13]。相比较而言,仅有不到15%的儿童GIST患者存在KIT或PDGFRA突变[14-15]。尽管儿童野生型GIST缺乏KIT和PDGFRA基因突变,但其CD117水平与成人存在KIT和PDFGRA的患者相似。这表明儿童野生型患者可能与成人患者的发病机制不同[16]。GIST好发于50~70岁的男性,年龄小于40岁患者少见。虽然GIST在所有年龄段甚至新生儿均有病例报道,儿童和年轻患者十分罕见,仅占所有GIST患者总数的1.4%[17]。就GIST患者整体而言,男性(54%)发病率高于女性(46%)。但在儿童GIST患者中,女性发病率高于男性[16]。胃间质瘤多发于胃底与胃体,通常成人患者在患病早期可伴有远处转移,以肝脏转移及腹腔转移最为常见,肺转移及骨转移少见,淋巴结转移十分罕见。成人患者淋巴结转移率不高于6%,儿童患者淋巴结转移率高于成人[18-19]。
诊断上,由于儿童GIST的发病率低,国内外少有报道,患者可能出现慢性失血引起的贫血、肿瘤破溃导致的急腹症(主要包括小肠或结肠梗阻,腹部疼痛以及出血)来院就诊。尽管儿童GIST少见,但与成人相同的是内镜及超声内镜仍是GIST初步诊断的主要方法,确诊仍需病理检查,胃钡餐造影、超声、MRI、CT、 PET-CT均可做为GIST的诊断评估方法。本例患者始发临床症状以贫血伴腹痛、呕吐、腹泻最显著,容易误诊为缺铁性贫血。GIST患者可伴癌症易感性综合症,主要包括: Carney 三联征, Carney-Stratakis 综合症,Ⅰ型神经纤维瘤性病 (NF-1)和家族性GIST。Carney 三联征包括:胃间质瘤、肺多发软骨瘤、肾上腺副神经节瘤[20]。其中三联征者占22%,前二联征者占78%,Carney三联征患者好发于年轻女性,但在GIST患者中十分少见。
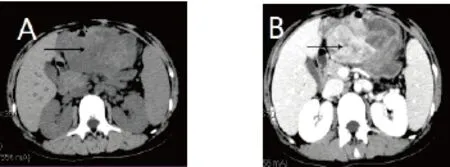
图1术前患者全腹平扫+增强CT图A:全腹CT平扫示:病灶与胃壁及周围肠管分界欠清。图B:全腹增强CT示:增强扫描呈明显不均匀强化,肿瘤实质强化明显,周围片状高密度及囊性部分未见强化,胃窦部壁略厚。
>Fig.1 Preoperative patient's full abdominal plain scan + enhanced CT. Fig.A: Total abdominal CT scan plus enhancement shows that the lesion is not clearly defined by the boundary between the stomach wall and the surrounding intestinal tract. Fig.B: Total abdominal augmentation CT showed that the enhanced scan showed obvious uneven enhancement, the tumor parenchyma was obviously enhanced, the surrounding flaky high density and cystic part were not enhanced, and the antrum wall was slightly thicker.
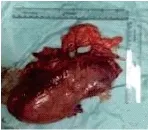
图2 手术切除的大体标本,大小约为13*10cm,包膜完整 。
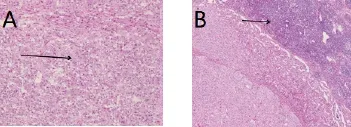
图3术后间质瘤的病理切片。图3A示:胃间质瘤切除病理图片(苏木精—伊红染色×50),箭头所示为胃壁组织内肿瘤细胞,核分裂像约10个/50HPF。图3B示:胃间质瘤转移淋巴病理图片(苏木精—伊红染色×50),箭头所示为淋巴结内转移的肿瘤细胞。
Fig.3 Pathological section of postoperative stromal tumors. Fig.3A shows a pathological picture of gastric stromal tumor resection (hematoxylin-eosin staining × 50), and arrows indicate tumor cells in the stomach wall tissue, and the mitotic figures are about 10/50 HPF. Fig.3B shows a gastric stromal tumor metastatic lymphoid pathology picture (hematoxylin-eosin staining x 50), and arrows indicate tumor cells metastasized within the lymph nodes.
儿童GIST若KIT或PDGFRA基因突变为阳性,则其治疗方法与成人类似。对于无转移且术前评估可切除的肿瘤,手术切除是目前最主要的治疗方法[21]。胃大部分切除虽不能减少肿瘤复发的风险,但由于其能够明显改善肠道功能,所以仍优于楔形切除[21]。由于成人胃GIST淋巴结转移罕见,且清扫淋巴结是否对患者生存期影响差异无统计学意义,所以成人患者一般手术不常规清扫淋巴结。目前绝大多数学者认为,所有GIST都应被认为是恶性潜能肿瘤,且儿童GIST淋巴结转移率高于成人,所以儿童患者是否需要常规行淋巴结清扫还需商榷[19,22]。由于该例患者术中扪及肿大的第VIII、XI组淋巴结,遂行远端胃大部切除术加淋巴结清扫术,术后恢复良好,术后第10天营养评估较术前明显改善。
在成人患者中,服用伊马替尼可以明显延长患者生存期,中位生存时间从20个月到57个月[23~24]。但在野生型患儿中,伊马替尼的客观反应率及肿瘤进展中位数明显低于成年的KIT/PDGFRA基因突变GIST患者。而舒尼替尼在野生型患者的中抑制WT KIT的效力是伊马替尼的10倍[25]。但在儿童型患者中,伊马替尼与舒尼替尼谁应作一线用药虽尚无统一意见,但儿童患者应用二者后愈后均好于成人[21]。

