营养组合物对再障大鼠干细胞增殖的影响
单宇佳,王华新,赵立芬,刘 兵,杨佩满 ,吴文国,贾 莉
(1大连医科大学检验医学院,辽宁大连 116044;2大连医科大学病理学与法医学教研室,辽宁大连 116044;3大连医科大学组织胚胎学教研室,辽宁大连 116044; 4大连金斧生物科技发展有限公司, 辽宁大连 116012)
再生障碍性贫血是由多种病因、多种发病机理引起的一种恶性血液疾病。临床实验证据表明,再障中骨髓造血细胞数量极度减少,严重限制了对再障发病机制的研究,获得性骨髓衰竭的动物模型可以帮助深入了解引起骨髓衰竭的机制[1-3]。大多数再障患者会出现厌食、恶心及其他胃肠道症状,导致营养不足[4]。再障的治疗以免疫抑制治疗为主,患者接受治疗后,会出现严重的消化功能障碍,电解质不平衡和代谢异常,出现并发症的风险大大增加[5-7]。因此,营养干预成为再障患者治疗前后应考虑的重要问题。研究表明,营养组合物在再障小鼠营养康复中发挥了关键作用[8-9]。本研究采用X射线、环磷酰胺、氯霉素三联应用的方法建立再障大鼠模型,探讨自制营养组合物对再生障碍性贫血大鼠各器官干细胞增殖的影响,旨在为营养组合物对再障的临床治疗应用提供科学依据。
1 材料和方法
1.1 实验材料
实验动物:SD大鼠100只,大连医科大学实验动物中心;营养组合物,大连金斧生物科技发展有限公司,该组合物包含赖氨酸、精氨酸、甘氨酸、核苷酸、大豆磷脂、维生素C、维生素D、维生素B12、叶酸、铁、硒等36种物质组成,按原方比率配方,经水煎、超声、浓缩,配制成口服液,分装备用;环磷酰胺、氯霉素,上海华联制药有限公司;兔抗大鼠CD90、CK19 抗体,兔抗大鼠CD133、OCT4抗体,兔抗大鼠Lgr5、Musashi-1抗体,兔抗大鼠Nestin、CD133抗体,武汉三鹰生物技术有限公司;羊抗兔二抗及SP免疫组化检测试剂盒,北京中杉金桥生物技术有限公司。
1.2 大鼠再障模型的建立
第1天X射线2.5Gy(美国瓦里安2 300C/D,6 MV,X射线,照射距离25cm,剂量率300 cGy /min)照射后,于第4、6、8天分别给予环磷酰胺35mg/kg、氯霉素45 mg/kg腹腔注射。第15天重复以上步骤。正常对照组给予等量生理盐水相应部位注射。
1.3 实验分组及流程
根据动物药理学的药品剂量和综合实验的设计准则,本实验分为:(1)正常对照组;(2)再障模型组;(3)营养组合物高剂量组,以2 266.95mg/(kg·d)对大鼠灌胃;(4)营养组合物中剂量组,以1 511.3mg/(kg·d)对大鼠灌胃;(5)营养组合物低剂量组,以1 057.91mg/(kg·d)对大鼠灌胃,每组20 只。
实验流程:应用X射线照射及注射环磷酰胺、氯霉素的方法建立再障大鼠模型。从第5天开始,营养组合物高、中、低剂量组分别以相应剂量对大鼠进行灌胃,每天1次,直至第60天,颈椎脱臼处死大鼠,留取对应的样品标本进行后期检测。
1.4 实验方法
将处死的SD大鼠解剖,留取肝脏、肾脏、胃、肠、脑标本,置于10%甲醛中固定,依次经过常规脱水、石蜡浸泡包埋、切片后进行免疫组织化学染色。步骤如下:石蜡包埋切片、脱蜡、水化;PBS洗片2~3次,每次5min;在玻片上滴加3% H2O2(80%甲醇),室温静置10min;PBS洗2~3次各5min;抗原修复;PBS洗2~3次各5min;滴加正常山羊血清封闭液,室温20min。滴加一抗50μL,4℃过夜。过夜后需在37℃复温45min。PBS洗3次各5min;滴加二抗40~50μL,室温静置,或37°C 1h;PBS洗3次各5min;DAB显色5~10min,在显微镜下掌握染色程度;PBS或自来水冲洗10min;苏木精复染2min,盐酸酒精分化;自来水冲洗10~15min;脱水、透明、封片、镜检。
1.5 统计学分析

2 结果与分析
2.1 营养组合物对再障大鼠肝脏干细胞的影响
本研究采用免疫组化检测再障大鼠肝干细胞标志物CD90、细胞角蛋白19(CK19)的表达情况。结果显示,与正常对照组相比,再障模型组大鼠肝干细胞数量明显减少(图1),再障大鼠经营养组合物灌胃后,大鼠肝干细胞的含量增加,并且随着营养组合物剂量增加而增加,表明营养组合物促进再障大鼠肝干细胞的增殖。
2.2 营养组合物对再障大鼠肾脏干细胞的影响
本研究采用免疫组化检测再障大鼠肾脏干细胞标志物CD133、OCT4的表达情况,结果显示,与正常对照组相比,再障模型组大鼠CD133、OCT4的表达量显著降低(图2),营养组合物处理再障大鼠后,其表达量随营养组合物剂量增加而增加,表明营养组合物促进再障大鼠肾脏干细胞的增殖。
2.3 营养组合物对再障大鼠胃干细胞的影响
本研究采用免疫组化检测再障大鼠胃干细胞标志物Lgr5及Musashi-1的表达。结果显示,与正常对照组相比,再障模型组大鼠胃干细胞Lgr5的表达量明显减少(图3);营养组合物处理再障大鼠后,Lgr5的表达随营养组合物剂量增加而增多;然而各组胃干细胞Musashi-1的表达无明显变化。以上结果表明,营养组合物具有促进再障大鼠胃干细胞的增殖。

图1 营养组合物对再障大鼠肝脏干细胞的影响(400×)注:# P<0.05 再障组与正常组;*P<0.05 营养组合物组与再障组

图2 营养组合物对再障大鼠肾脏干细胞的影响(400×)注:# P<0.05再障组与正常组;*P<0.05营养组合物组与再障组
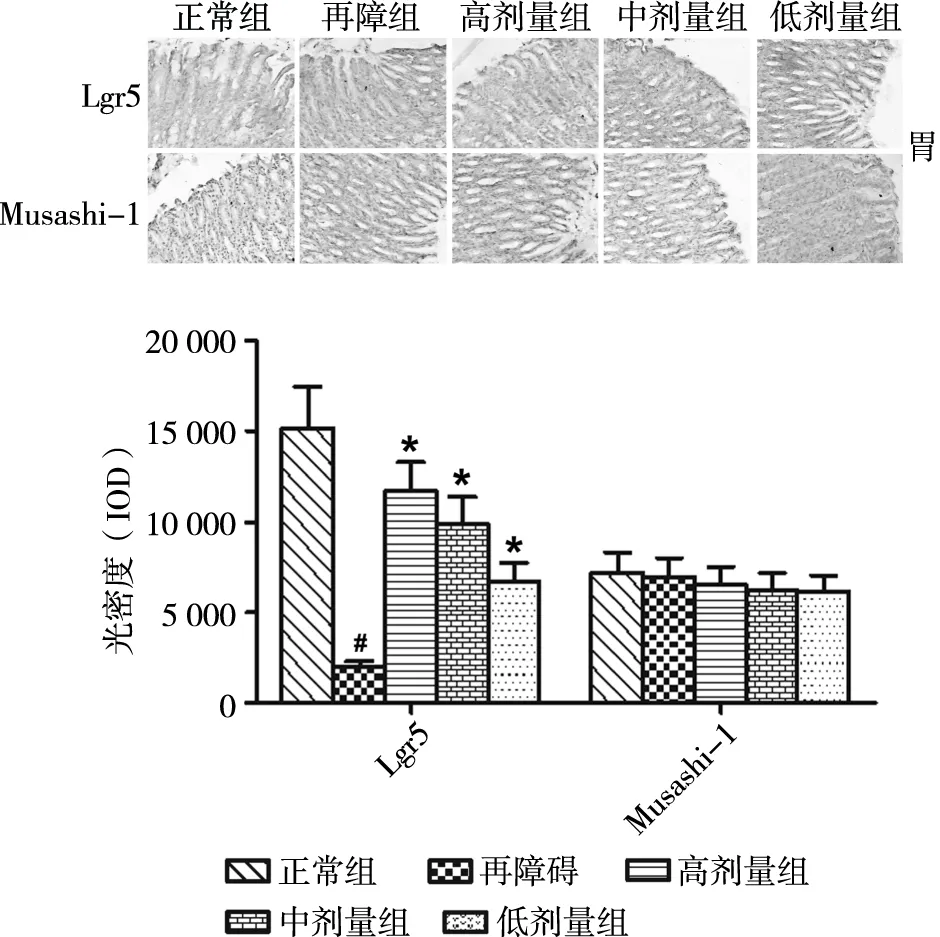
图3 营养组合物对再障大鼠胃干细胞的影响(200×)注:# P<0.05 再障组与正常组;*P<0.05 营养组合物组与再障组
2.4 营养组合物对再障大鼠肠粘膜干细胞的影响
本研究采用免疫组化检测再障大鼠肠道干细胞标志物Musashi-1、 Lgr5的表达。结果显示,各组小肠干细胞数量无明显变化(图4),表明营养组合物对再障大鼠小肠干细胞的增殖无显著作用。
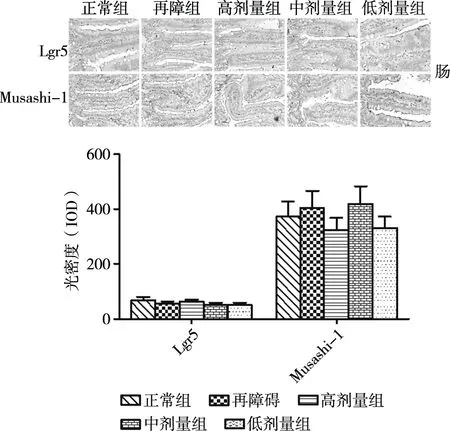
图4 营养组合物对再障大鼠肝脏干细胞的影响(200×)注:# P<0.05 再障组与正常组;*P<0.05 营养组合物组与再障组
2.5 营养组合物对再障大鼠神经干细胞的影响
本研究采用免疫组化检测再障大鼠神经干细胞标志物Nestin、CD133的表达情况,结果显示,营养组合物处理再障大鼠后,Nestin、CD133的表达无显著变化(图5),表明营养组合物对再障大鼠脑神经干细胞的增殖无显著影响。
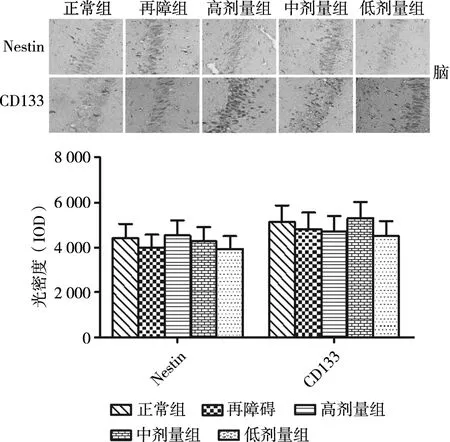
图5 营养组合物对再障大鼠肝脏干细胞的影响(400×)注:# P<0.05再障组与正常组;*P<0.05营养组合物组与再障组
3 讨论
引起再生障碍性贫血(AA)的主要原因为T 淋巴细胞介导的免疫功能发生紊乱,其发病机理为T 淋巴细胞发生异常激活,进而分泌过量的造血负调控因子,通过某些机制抑制造血干/祖细胞增殖分化,从而诱导造血干细胞凋亡,在此过程中表现为明显的抑制骨髓造血活性[10]。大多数严重再障患者采用抗胸腺细胞球蛋白和环孢菌素进行免疫抑制治疗来改善血细胞计数及存活率[11]。再障患者另一治疗选择为异基因造血干细胞移植[12]。此外,支持治疗、预防感染和输血支持对于再障患者也是至关重要的[13]。虽然临床上已有较完善的治疗方法和指征,但实际疗效仍然不理想。因此,探讨营养组合物治疗再障大鼠的可能作用机制具有较高的临床意义。
营养组合物含有多种氨基酸、磷脂、核苷酸等多种营养成分,其中脑磷脂、卵磷脂是线粒体及造血干细胞组分,甘氨酸参与合成甘氨酰胺合成酶参加嘌呤核苷酸合成。据报道,营养组合物具有促进造血干细胞增殖和增强血红蛋白合成的功能。此外,核苷酸类营养物不仅有助于基因的复制、损伤基因的自主修复、基因表达,也有助于线粒体的增殖[14]。有研究学者发现,在AA小鼠模型中,营养组合物对骨髓造血微环境有明显的保护和修复作用,可促进小鼠干细胞增殖和增加线粒体的数目[15]。
Wilson等[16]证实了增殖的卵圆细胞可分化为成熟的肝细胞及胆管细胞,并指出这类细胞为肝脏内原始肝干细胞。国内研究报道,当肝脏受到药物刺激或其他原因造成严重损伤肝时,卵圆细胞可被激活并增殖、分化为肝实质细胞和胆管上皮细胞,使得肝功能得以重建和修复[17]。肾小管上皮细胞具有免疫调节作用,在肾组织损伤修复过程中具有强大的再生能力[18-22],这种强效的再生可有效恢复肾脏功能。肾脏组织干细胞对于维持肾脏功能至关重要[23-24]。胃肠道干细胞具有分化为胃肠组织中几乎所有的细胞的能力,对维持胃肠黏膜更新及保持组织内环境稳定起着至关紧要的作用[25]。神经干细胞来源于中枢神经系统,可以修复损伤的神经系统。以上干细胞均属于成体干细胞,其来源之一为骨髓造血干细胞的分化。本实验显示,营养组合物可使AA大鼠的肝脏、肾脏、胃的干细胞标志物表达增加,但对AA大鼠的肠粘膜和神经干细胞标志物的表达无影响,说明营养组合物在一定程度上可促进AA大鼠肝脏、肾脏、胃干细胞的增殖,而对肠粘膜和神经干细胞的增殖无显著差异作用。此过程中其潜在的可能机制为营养组合物可促进骨髓造血干细胞向肝、肾、胃干细胞的发育、增殖、分化,改善骨髓造血微环境或骨髓重建。◇

