食源性沙门氏菌分离株致病性研究和毒力相关基因检测
刘书宏,吴科敏,周辰瑜,梁竞臻,韦 平*
沙门氏菌(Salmonella)是无芽孢革兰氏阴性直杆菌[1],是一种重要食品源性病原菌,极易污染食品、水源及畜产品,人一旦摄入了含有大量沙门氏菌的动物性食品,可导致食源性中毒,引发急性胃肠炎、败血症等[2-3],世界上每年都会有数以百万计的人死于沙门氏菌感染[4]。无论是发达国家还是发展中国家,沙门氏菌都是严格检疫和监控的对象[5]。在我国,由沙门氏菌引起的食物中毒也是居细菌性食物中毒的首位[6]。因此畜禽产品中,沙门氏菌的存在对食品安全、兽医公共卫生等构成严重威胁。沙门氏菌在自然界中分布广泛,极易污染食物、水源、土壤等。沙门氏菌血清型复杂,目前已发现超过2 500 种[7],绝大多数血清型能在人和动物间交叉感染,对鲜肉食品中分离到的主要血清型的沙门氏菌进行致病力研究可以验证这些不同血清型的食源性沙门氏菌对人的潜在危害。近年来,随着现代分子生物学技术的不断发展和应用,人们发现细菌的致病力是大量细菌毒力相关基因相互作用的结果[8]。沙门氏菌毒力相关基因主要分布在毒力岛、菌毛、鞭毛、脂多糖和质粒等上[9]。根据本研究所2008年至今对广西地区鲜肉食品中沙门氏菌污染情况的监测结果,实验选取了分离率最高的S. agona、S. derby和对人危害较大的S. enteritidis、S. typhimurium,对其致病力以及毒力基因的分布进行研究,以了解广西地区畜禽鲜肉产品中沙门氏菌的致病力强弱,从而防范食源性沙门氏菌对公共安全的潜在威胁,并为广西地区防控食品源性沙门氏菌,开展食品卫生安全防控工作提供科学依据。
1 材料与方法
1.1 菌株、动物与试剂
从市售鲜肉中分离的沙门氏菌优势血清型分离株:S. agona、S. derby、S. enteritidis、S. typhimurium。
4 周龄左右的SPF级昆明系小白鼠,体质量18~22 g,雌雄各半,购自广西医科大学实验动物中心。
缓冲蛋白胨水、木糖赖氨酸脱氧胆盐培养基、麦康凯琼脂、营养琼脂、沙门氏菌生化试剂盒 广东环凯微生物科技有限公司;沙门氏菌诊断血清(60 种) 宁波天润生物技术有限公司;2×Taq Master Mix、DL2000 plus Marker、普通质粒小提试剂盒(离心柱型) 北京康为生物科技有限公司;引物由北京六合华大基因科技有限公司合成。
1.2 仪器与设备
电热恒温培养箱 宁波江南仪器厂;ETC811聚合酶链式反应(polymerase chain reaction,PCR)仪日本东胜公司;小型高速离心机 德国Eppendorf公司;凝胶成像系统 英国UVITEG公司;DYY-8C电泳仪北京六一仪器厂。
1.3 方法
1.3.1 动物致病性实验
1.3.1.1 半数致死量的测定
首先通过递加法预实验确定最大耐受剂量(maximum tolerated dose,LD0)、绝对致死剂量(absolute lethal dose,LD100)以及组间剂量,然后将50 只昆明小鼠随机分成5 组,每组10 只,其中一组为对照组。将实验组的每只昆明小鼠分别腹腔注射0.5 mL不同浓度的攻毒分离株菌液,攻毒浓度见表1。对照组腹腔注射0.5 mL的生理盐水。隔离饲养,每天观察数次,连续观察7 d,记录小鼠的精神状态、外观变化以及死亡情况。分别按改良寇氏法[10]计算攻毒株的半数致死量(median lethal dose,LD50)。
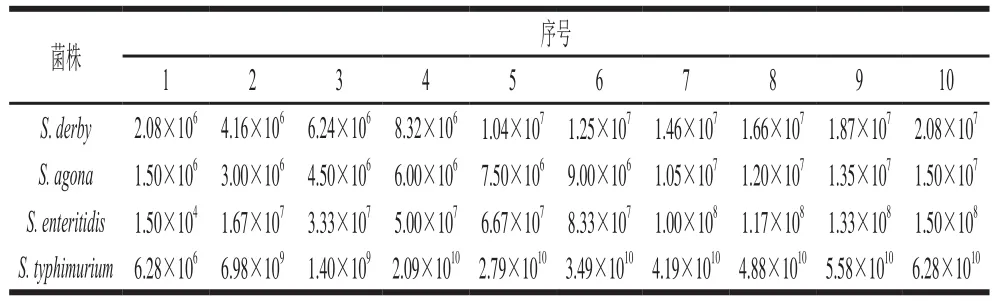
表1 沙门氏菌攻毒浓度Table 1 Salmonella infection concentrations CFU/mL
1.3.1.2 攻毒小鼠剖检并回收细菌
对攻毒后死亡的小鼠剖检观察各组织脏器病变。按照GB/T 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[11]对死亡小鼠进行沙门氏菌的检测分离并回收细菌;回收细菌经生化鉴定和血清分型判断是否为攻毒分离株。7 d后对未死亡的小鼠进行致死处理。
1.3.1.3 病理组织学观察
对肉眼观察病变明显的器官制作石蜡切片,并进行常规苏木素-伊红(hematoxylin-eosin,HE)染色。光学显微镜观察攻毒后小鼠脏器的病理组织学变化。
1.3.2 毒力基因检测
1.3.2.1 引物合成
根据GenBank中收录的沙门氏菌与毒力相关的质粒基因、菌毛基因、肠毒素基因以及毒力岛基因,并参考文献[12-17],Primer Premier 5软件设计了以下毒力基因引物(表2)。
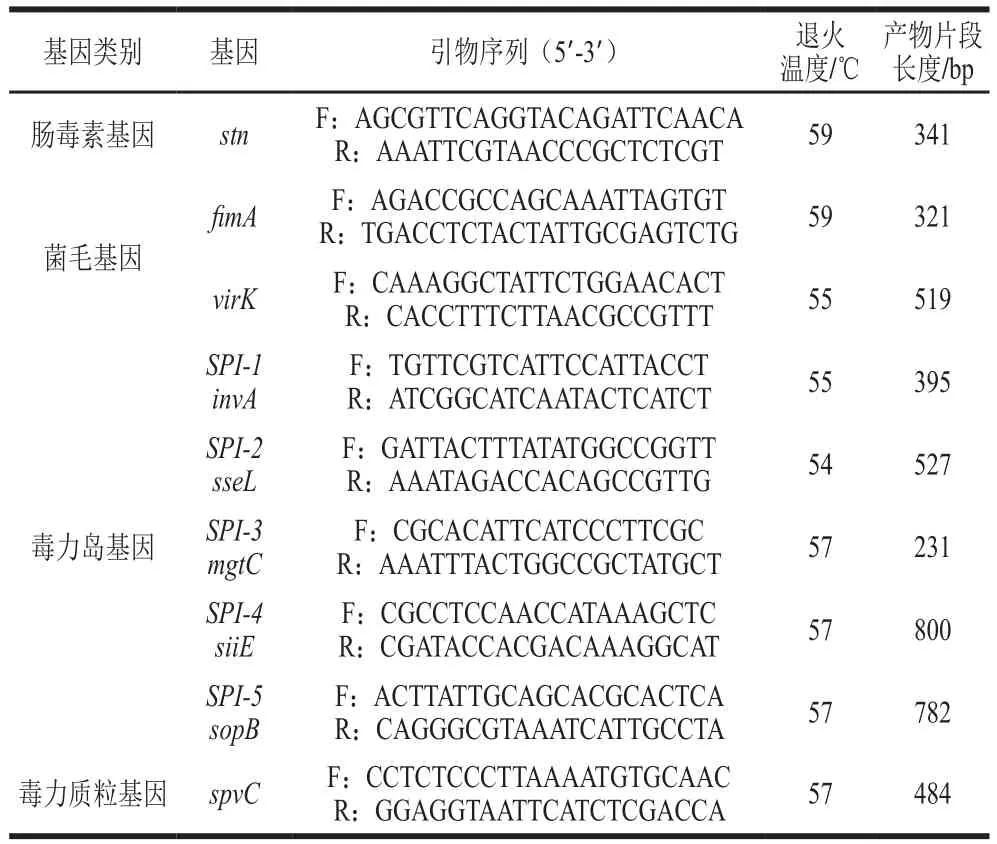
表2 毒力相关基因PCR引物及其序列Table 2 PCR primers for virulence genes
1.3.2.2 总DNA和质粒的提取
热裂解法提取总DNA:接种环取纯培养的食源菌一环,放入盛有50 μL 25 mmol/L NaOH溶液的EP管中,混匀,于100 ℃水浴加热10 min,然后加入4 μL的1 mol/L Tris-HCl,将上述混悬液12 000 r/min离心5 min,最后取上清液作为PCR扩增的模板。按试剂盒说明书提取质粒。
1.3.2.3 PCR扩增与检测
反应体系:12.5 μL的2×Taq mix,20 μmol/L上、下游引物各0.5 μL,2 μL DNA模板,加灭菌超纯水配制成25 μL的体系;PCR条件:94 ℃预变性2 min,94 ℃变性30 s,退火30 s,72 ℃延伸35 s,循环32 次,最后72 ℃终延伸2 min。将PCR扩增产物进行1%的琼脂糖凝胶电泳,最终通过凝胶成像系统拍照、观察结果。
2 结果与分析
2.1 优势血清型分离株的致病力实验结果
2.1.1 攻毒小鼠的观察
将攻毒分离株接种小鼠后,小鼠均出现精神沉郁、被毛粗乱、发抖、运动减少以及饮食欲下降等症状,且实验组在接种后的7 d内先后均有不同程度的死亡,回收的细菌经生化实验与血清型鉴定,确定其与攻毒菌株的血清型相同。其LD50见表3。攻毒株S. agona、S. derby、S. enteritidis、S. typhimurium对小鼠致死率分别为70%、70%、60%、40%。对照组表现正常,没有小鼠死亡。说明攻毒分离株对小鼠均有致病力,且致死率不同。攻毒分离株的LD50显示,本研究中的S. enteritidis、S. agona、S. derby对昆明小鼠的致病力相似,而S. typhimurium较弱。
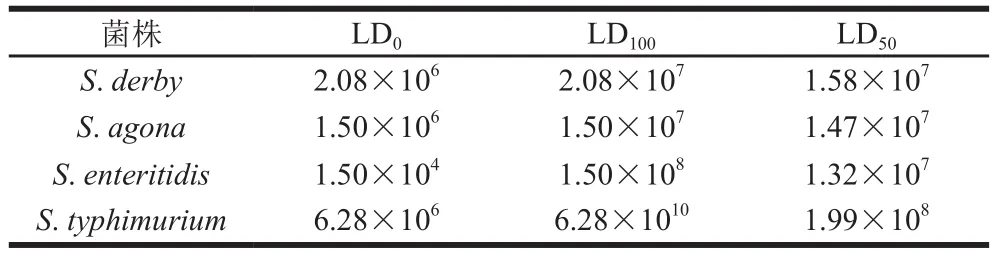
表3 沙门氏菌分离株的LD50检测结果Table 3 LD50 of Salmonella isolates CFU/mL
2.1.2 攻毒小鼠的剖检变化
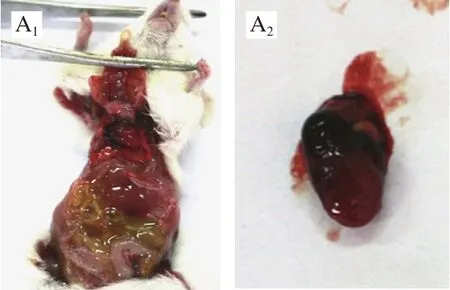
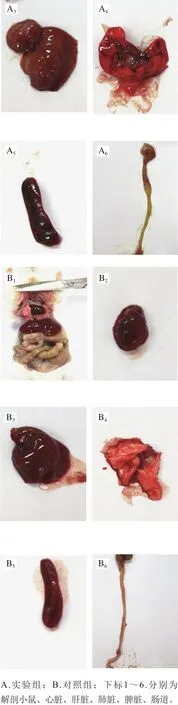
图1 小鼠剖检病变Fig. 1 Necropsy lesion of mice
由图1可见,4 种血清型的沙门氏菌对小鼠所致病变相同,小鼠腹腔积液,心脏肿大,肝脏变黄,脾脏肿大、充血;肠壁变薄,肠道内有黄色液体;症状明显者还表现出肺脏的严重肿大、出血,肠道的萎缩、黏连。
2.1.3 攻毒小鼠的病理组织学观察

图2 小鼠病理组织学观察结果Fig. 2 Histological photomicrographs of splanchnic tissues
由图2可见,4 种血清型的沙门氏菌对小鼠的病理组织学变化影响相似,感染致死的小鼠肝脏病变明显,胞浆或胞核内出现大小不等的空泡,整个细胞呈蜂窝状结构,肝细胞胞浆或胞核内出现大小不等的空泡,整个细胞呈蜂窝状结构,肺脏出血、肺泡隔结缔组织增生,间质增宽,心肌出现梭状细胞,肠绒毛、腺体脱落。
2.2 优势血清型分离株毒力基因的检测结果
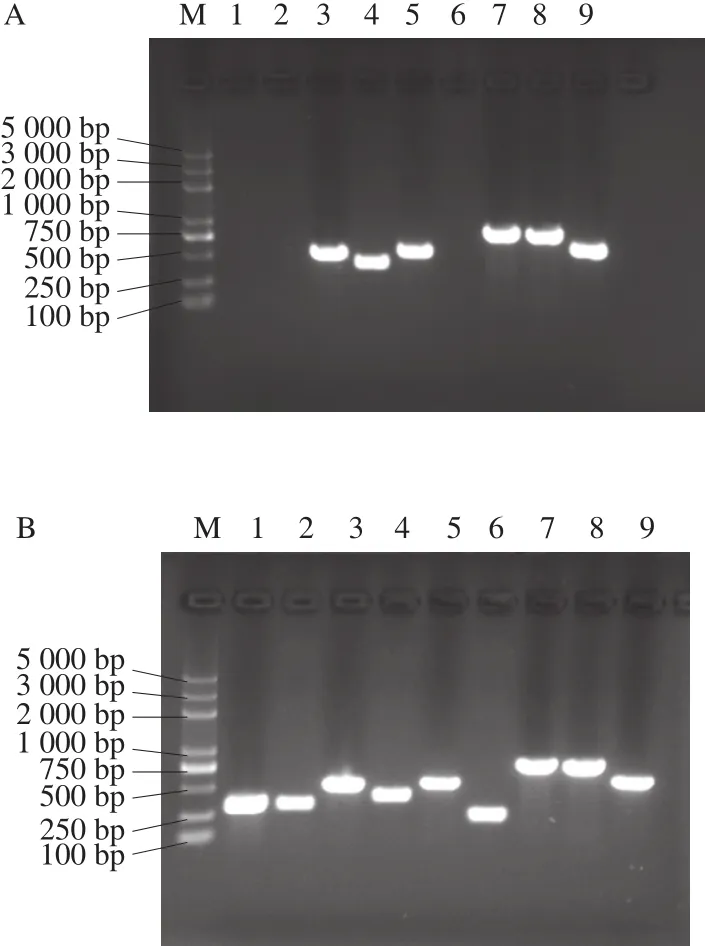
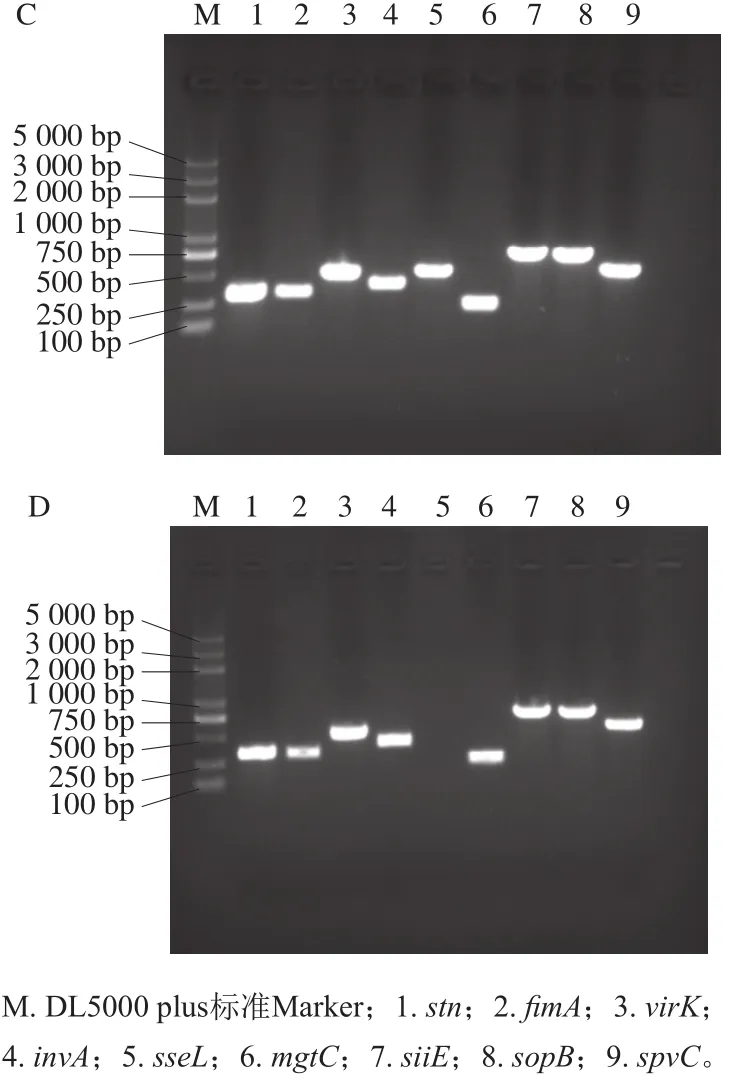
图3 毒力基因S. agona(A)、S. derby(B)、S. enteritidis(C)、S. typhimurium(D)PCR检测结果Fig. 3 PCR patterns of virulence genes in S. agona (A), S. derby (B),S. enteritidis (C) and S. typhimurium (D)
对致病力实验中的攻毒株毒力基因的检测结果显示(图3),S. enteritidis与S. derby对所测的stn、fimA、virK、sseL、mgtC、siiE、sopB、spvC、invA 9 种毒力基因均有检出;S. typhimurium除了SPI-2中的sseL,其他8 种基因均有检出;S. agona检出virK、sseL、siiE、sopB、invA、spvC共6 种。
2.3 优势血清型分离株的致病力与其毒力基因之间的相关性
根据4 种血清型沙门氏菌LD50的结果显示,S. agona、S. derby、S. enteritidis的LD50相近,S. typhimurium最大,因此说明S. agona、S. derby、S. enteritidis的致病力相近,而S. typhimurium最弱。毒力相似的S. agona、S. derby、S. enteritidis中sseL基因均被检出,而致病力最弱的S. typhimurium中,只有sseL基因未被检出。这说明本研究中不同血清型的分离株对小鼠的致病力表型与毒力基因中sseL基因密切相关。
3 讨 论
优势血清型的致病力实验结果显示,实验中的攻毒分离株对昆明小鼠均有致病力,且不同血清型分离株对小鼠的致死率不同。LD50显示,S. enteritidis、S. agona、S. derby对小鼠的致病力相似,S. typhimurium的致病力相对较弱。毒力基因的检测结果显示,致死率较高的S. agona、S. derby、S. enteritidis均有SPI-2中sseL基因的检出,致病力相对较弱的S. typhimurium则没有检出sseL基因。说明沙门氏菌分离株致病性的强弱与毒力岛SPI-2中的sseL基因密切相关。
SPI是位于染色体上负责编码毒力基因簇的染色体片段[18]。目前已有SPI-1、SPI-2、SPI-3、SPI-4、SPI-5等20多个毒力岛被发现[19]。其中SPI-2的基因可编码Ⅲ型分泌系统2(T3SS-2)的结构蛋白、效应蛋白、伴侣蛋白等。有研究证明,SPI-2的突变能使伤寒沙门氏菌对小鼠的毒力降低1 000 倍[20-21]。sseL是SPI-2中重要的操纵子,沙门氏菌sseL基因可编码T3SS-2效应蛋白SseL。效应蛋白SseL是一种去泛素酶,能够抑制宿主细胞的核因子κB信号通路,抑制机体炎性作用,在小鼠体内发挥毒力起着重要作用[22]。SseL蛋白还能够延迟巨噬细胞对Salmonella的毒性作用,而且对巨噬细胞具有一定的杀伤能力,使菌体逃避巨噬细胞辅酶杀伤作用[23-24],是沙门氏菌发挥毒力作用的重要因子。此外,薛颖[25]证明sseL基因缺失株与野生株虽然体外竞争生长能力差异不显著,但是体内竞争生长能力在3 d时显著弱于野生株。因此推断可能是sseL发生突变或缺失导致SPI-2基因突变,S. typhimurium的毒力降低,对小鼠的致病力减弱。另外,老鼠和人类基因组相似度很高,其基因数目和人类均有3万 个左右,有99%的基因都能在人类基因组中找到相应的同源基因,对之进行比较研究可得知很多关于人类疾病和生理机能的信息[26-27]。因此,通过对小鼠进行致病力实验可检测食源性沙门氏菌的毒力,有效地预测和推断食源性沙门氏菌对食品安全和人类健康的危害。
近年来,广西地区市售鲜肉中分离的沙门氏菌以S. agona、S. derby为主[28-30],由S. enteritidis、S. typhimurium引发的食物中毒事件在各地均屡有发生[31-33]。沙门氏菌分离株对磺胺异恶唑、四环素、甲氧嘧啶、复方新诺明产生了很强的耐药性,耐药率均在50%以上,多重耐药率高达60.5%[34]。因此,对这4 种血清型的Samonella分离株的致病力及毒力基因的检测具有重要意义。本研究表明,本地区市售鲜肉中流行的S. enteritidis、S. agona、S. typhimurium、S. derby 4 种血清型沙门氏菌分离株对昆明小鼠有较强的致病力,且不同血清型对小鼠的致病力差异与毒力基因的分布有关。因此,有关部门应继续加强本地区食源性沙门氏菌的监测,严控本地区市售鲜肉食品的卫生与安全,减少食源性沙门氏菌对人类的危害,保障人们的身体健康与生命安全。

