超高压对大豆球蛋白抗原性及结构的影响
赵益菲,布冠好*,陈复生
大豆富含营养物质,大约含有40%的蛋白质[1]。大豆蛋白由于其良好的营养价值和功能特性,已被作为一种蛋白原料广泛应用于食品工业中[2]。然而,大豆是八大致敏食物成分之一,其中两种储藏蛋白β-伴大豆球蛋白和大豆球蛋白被认为是主要的致敏性蛋白[3-4]。而大豆球蛋白的含硫氨基酸是β-伴大豆球蛋白的3~4 倍[5],从营养学方面讲,大豆球蛋白更具研究意义。大豆球蛋白即大豆11S球蛋白,是一种六聚体蛋白质,每个亚基单位均含有一个酸性链(A链)和碱性链(B链),除了存在于G4亚基中的酸性链A4之外,大豆球蛋白的每个亚基都通过单个二硫键相互连接成一个环[6]。大豆易过敏的消费者必须避免摄入大豆及其衍生产品,但是由于其用途的广泛性,避免摄入大豆及豆制品具有一定困难;所以通过一定的加工手段降低或消除大豆蛋白的过敏原性具有重要的实际意义。
消费者对食品安全问题的需求,以及营养损失对食品感官质量的不利影响促使了非热技术的出现。超高压作为一种非热加工技术,能修饰蛋白质中的二、三、四级结构,即其中的氢键、离子键、疏水键等非共价键[7]会被影响,从而改变抗原结构,导致蛋白质的致敏性发生改变。Hu Chunqiu等[8]研究了高压诱导花生蛋白质的构象变化,其结果表明随着压力的增大,花生过敏原对免疫球蛋白(immunoglobulin,Ig)E结合能力下降。Li Huijing等[9]报道超高压处理后大豆蛋白的抗原性降低了50%以上(300~500 MPa,20 min),与未处理蛋白相比,超高压处理后的蛋白质具有较高的疏水性。Hildebrandt等[10]证明卵蛋白经超高压处理(400~700 MPa、20 min)后,其免疫反应性随着压力的增加而降低,蛋白质结构和功能特性(包括发泡和乳化)的变化与压力的大小呈正相关。
目前,作为一种新型的加工技术,超高压技术已经有一定的相关研究[11-12],但其对大豆球蛋白的影响研究较少。因此,本实验以脱脂豆粉为原料,利用碱溶酸沉法提取大豆球蛋白,以压力、时间以及蛋白质量浓度为单因素,对大豆球蛋白进行超高压处理,利用间接竞争酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)实验及免疫印迹法对大豆球蛋白的免疫活性进行定性和定量分析,研究超高压对大豆球蛋白结构特性的影响,以期为食品加工过程中选择合适的超高压条件来降低大豆蛋白致敏性提供参考。
1 材料与方法
1.1 材料与试剂
脱脂大豆粉(蛋白质量分数52.36%) 河南省鲲华生物技术有限公司;牛血清白蛋白(albumin bovine serum,BSA)、3,3’,5,5’-四甲基联苯胺(tetramethylbenzidine dihydrochloride,TMB)单组分显色液 北京索莱宝科技有限公司;大豆球蛋白标准抗原(glycinin 3171)、酶标二抗(HRP标记的羊抗兔IgG) 美国Sigma公司;凝胶配制试剂盒 武汉博士德生物工程有限公司;其他试剂均为市售分析纯。
1.2 仪器与设备
LGJ-18高速冷冻离心机 上海安亭科学仪器厂;pH计 意大利HANNA公司;HHP-600-3L超高静压处理装置 包头科发有限公司;DYY-6D型电泳仪 北京市六一仪器厂;Multiskan FC酶标仪 美国赛默飞世尔仪器有限公司。
1.3 方法
1.3.1 大豆球蛋白的提取
参考Thanh等[13]的方法提取大豆球蛋白,并根据Liu Chun[14]和宋佳[15]等的方法对其进行优化。室温下,脱脂大豆粉用pH 8.5、0.03 mol/L Tris-HCl溶液浸提,料液比为1∶15(m/V),45 ℃下搅拌1 h后,高速冷冻离心机4 ℃ 10 000 r/min离心20 min,取上清液。然后向上清液中加入NaHSO3和CaCl2固体,使其浓度分别为0.01 mol/L和5 mmol/L,采用1 mol/L HCl和1 mol/L NaOH溶液调节pH值至6.4,4 ℃冷沉过夜。10 000 r/min离心20 min,将沉淀物和上清液分离。将沉淀物溶于pH值为7.0的磷酸盐缓冲液中,4 ℃透析2 d,每3 h换一次水,冷冻干燥保存备用。
1.3.2 大豆球蛋白的超高压处理
将提取的大豆球蛋白用磷酸盐缓冲液(pH 7.0)稀释至设定的蛋白质量浓度,并置于(耐高温高压)无菌均质袋(8 cm×10 cm)中,以真空包装机密封,不留气泡。压力设置为100~600 MPa时,蛋白质量浓度为5 mg/mL,加压时间为20 min;加压时间设定为5~30 min时,蛋白质量浓度为5 mg/mL,压力为500 MPa;蛋白质量浓度设置为5~50 mg/mL时,加压时间为20 min,压力为500 MPa。分析不同条件下大豆球蛋白的抗原性、经不同压力处理之后的免疫活性和结构。
1.3.3 大豆蛋白抗原性的测定
蛋白抗原性的具体测定采用间接竞争ELISA方法,具体参考文献[16-17]。
标准抗原包被酶标板→样品抗原与一抗混合→洗涤→封闭液封闭→洗涤→与一抗混合的样品加入酶标板→洗涤→加入羊抗兔二抗→洗涤→TMB显色→浓硫酸终止反应→酶标仪显示结果。
1.3.4 大豆球蛋白免疫原性的测定
采用免疫印迹法检测大豆球蛋白的免疫原性[18]。将超高压后的样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)之后,用硝酸纤维素膜进行转膜,转膜完成后37 ℃下封闭1 h;漂洗干净后,4 ℃一抗孵育硝酸纤维素膜18 h,二抗室温避光孵育膜2 h,最后进行膜显色。观察显色情况,收集图像进行免疫原性的分析。
1.3.5 大豆球蛋白分子质量的测定
将超高压处理后的蛋白配制成2 mg/mL溶液,然后与上样缓冲液按1∶1(V/V)的比例混合均匀。将样品液置于沸水浴中煮沸4 min,使蛋白变性。取标准分子质量蛋白10 μL,用微量进样器进样,样品进样量为10 μL。在电泳外槽中加入电极缓冲液,接通电源,进行电泳。1.3.6 大豆蛋白质二硫键结构的测定
采用非还原性电泳测定大豆球蛋白二硫键结构,采用12%分离胶和5%的浓缩胶进行非还原型SDS-PAGE凝胶的配制。除了整个过程不添加β-巯基乙醇,实验过程与SDS-PAGE步骤一致[19]。
1.3.7 大豆球蛋白二级结构的测定
称取冻干后的样品2 mg,按照1∶50(m/m)的比例加入溴化钾,研磨成均匀粉末,压成透明薄片。设定傅里叶变换红外光谱仪的测定波数范围为4 000~400 cm-1,分辨率为4 cm-1,扫描次数32 次[20]。最后利用Peak fit 4.12软件分析蛋白质的二级结构。
1.3.8 大豆球蛋白表面疏水性的测定
将处理过的样品蛋白溶于10 mmol/L磷酸盐缓冲液(pH 7.0)中,使蛋白溶液的初始质量浓度为5 mg/mL,之后用同一磷酸盐缓冲液逐步稀释[21],每组压力设6 种稀释度,将20 µL 8.0 mmol/L 8-苯氨基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS)溶液加至4 mL的样品液中,混合均匀,晃动40 s 后,在激发波长390 nm、发射波长470 nm、狭缝5 nm的条件下测定其荧光强度。
1.4 数据统计与分析
采用SPSS 16.0软件处理数据,每组实验重复测定3 次,取其平均值,并进行邓肯氏显著性分析,P<0.05表示差异显著。采用OriginPro 8.0软件绘图。
2 结果与分析
2.1 大豆球蛋白的SDS-PAGE图
经Tris-HCl浸提和碱溶酸沉法提取的大豆球蛋白电泳结果如图1所示,经凯氏定氮测得大豆球蛋白的蛋白质量分数为97.8%,大豆球蛋白各特征条带与大豆分离蛋白中的大豆球蛋白部分相吻合,且A、B两个亚基条带清晰,提取纯度较高,经Gel-pro analyzer凝胶定量分析软件测定其蛋白纯度为88.6%。
2.2 不同条件对大豆球蛋白抗原性的影响
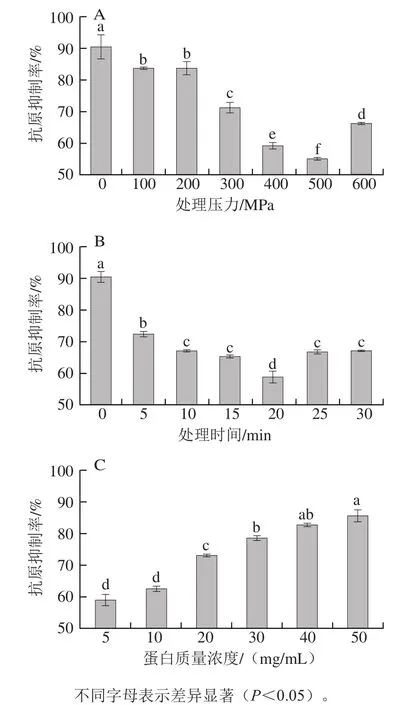
图2 处理压力(A)、处理时间(B)、蛋白质量浓度(C)对大豆球蛋白抗原性的影响Fig. 2 Effects of pressure (A), pressurization time (B), and protein concentration (C) on the antigenicity of glycinin
由图2A、B可以看出,大豆球蛋白的抗原性随着处理压力的增加以及处理时间的延长先降低后升高,在压力为500 MPa、加压时间为20 min时,大豆球蛋白的抗原性从90.42%降低到54.77%,降低了35.65%;其原因可能是超高压诱导大豆球蛋白发生了变性,导致其抗原决定簇的线性表位被改变或被破坏,不能被IgG抗体识别[22-23],从而不能诱发免疫反应,最终降低了大豆球蛋白的抗原性。而继续增加压力和延长时间对抗原性的抑制效果反而不明显;可能是由于过大的压力使蛋白质的结构再一次发生变化[24],导致过敏原的表位又暴露出来,所以抗原性反而增强。从图2C可以看出,大豆球蛋白的抗原性随着蛋白质量浓度的增加呈现上升的趋势,其原因可能是底物蛋白质量浓度较高,致使作用到蛋白分子上的压力减小。综上所述,超高压处理能对大豆球蛋白的抗原性产生影响。
2.3 超高压处理对大豆球蛋白分子质量及免疫原性的影响

图3 不同压力条件下超高压处理后样品的SDS-PAGE图谱Fig. 3 SDS-PAGE patterns of glycinin subjected to different high hydrostatic pressure levels
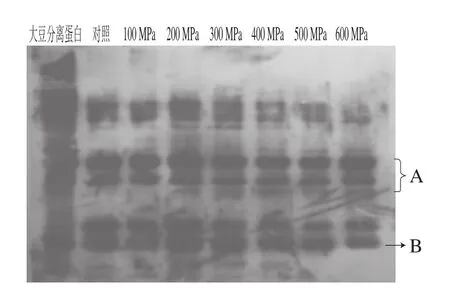
图4 不同压力条件下超高压处理后样品的免疫印迹图Fig. 4 Western blot patterns of glycinin subjected to different high hydrostatic pressure levels
由图3可知,随着压力的增加,大豆球蛋白的各个亚基条带的密度逐渐降低,说明大豆球蛋白经超高压处理后其亚基发生了解聚。由图4可知,未经过超高压处理的大豆球蛋白(对照)在其亚基位置处的免疫条带灰度较强,呈现较强的阳性反应;经过超高压处理的大豆球蛋白在其亚基处也均有免疫条带,500 MPa处理20 min后其条带的灰度明显弱于对照组,但条带并没有完全消失,说明超高压处理后大豆球蛋白免疫原性有一定程度的降低,但并不能完全消除。
2.4 超高压处理对蛋白质二硫键的影响

图5 不同超高压处理后样品的非还原性电泳图谱Fig. 5 Non-reduced SDS-PAGE of glycinin subjected to different high hydrostatic pressure levels
非还原性电泳与SDS-PAGE的区别是在整个实验过程中没有添加β-巯基乙醇(β-巯基乙醇是一种强还原剂,能使半胱氨酸残基间的二硫键断裂),不影响蛋白样品中的二硫键,可以更好地反映蛋白空间结构的改变。由图5可以看出,经过不同压力处理的蛋白质样品谱带发生了显著变化,大豆球蛋白的电泳图谱在压力100~200 MPa时条带基本相同,蛋白质的结构没有变化;当施加的压力增加到300 MPa时,出现了新的条带,说明在此处理压力下,大豆球蛋白发生解聚,空间结构被破坏[25];而再增大压力时,发现新出现的条带又逐渐消失,其原因可能是新条带经超高压处理后,解聚为较小肽链,没有进入到电泳图谱中。根据以上实验结果可以得出,超高压处理会使蛋白质发生解聚,连接多肽链之间的疏水键断裂,使蛋白质原本的高级空间结构解离成一个个单一的多肽链,甚至解聚为更小的肽链,进而可能引起大豆球蛋白的抗原性和免疫原性的变化[26]。
2.5 超高压处理对大豆球蛋白二级结构的影响
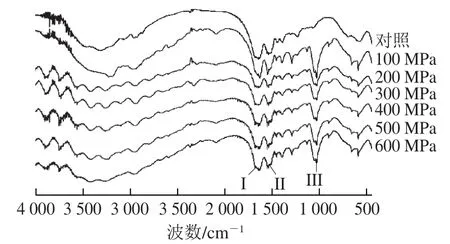
图6 超高压处理后大豆球蛋白的傅里叶变换红外光谱图Fig. 6 FTIR spectra of glycinin after high hydrostatic pressure treatment
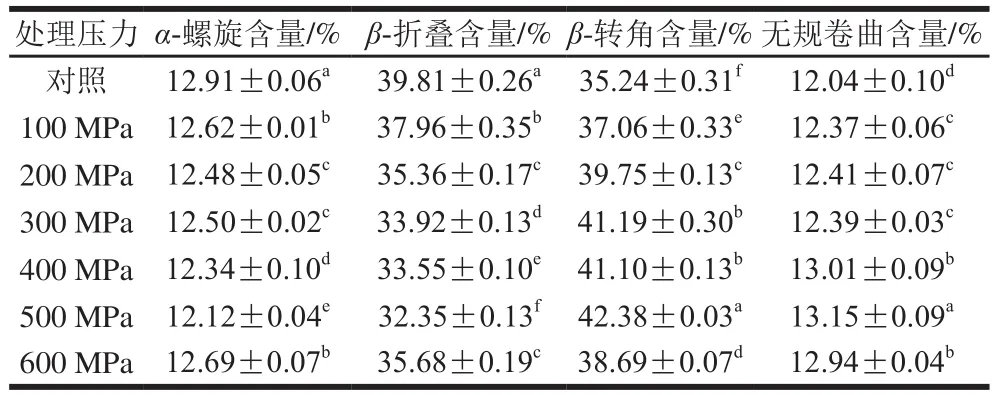
表1 超高压处理后大豆球蛋白的二级结构含量Table 1 Secondary structure contents of glycinin after high hydrostatic pressure treatment
蛋白质的傅里叶变换红外光谱一般有3 组特征吸收带,分别是酰胺I(1 600~1 700 cm-1)、酰胺II(1 530~1 550 cm-1)和酰胺III(1 260~1 330 cm-1)[27]。图6为超高压处理后大豆球蛋白的傅里叶变换红外光谱图,其中酰胺I带主要由C=O的伸缩振动引起的,同时也与N—H的平面扭曲和C—N的伸缩振动有关,酰胺I带对于蛋白质的结构分析最为重要,它与其二级结构之间存在着一定的对应关系[28-29]。利用Peak fit 4.12软件对超高压产物的酰胺I带进行去卷积二阶导数拟合出的蛋白二级结构含量见表1。样品中蛋白的二级结构主要以β-折叠和β-转角为主,且超高压处理主要改变了β-折叠和β-转角的含量。与未经超高压处理的大豆球蛋白相比,样品的二级结构中α-螺旋和β-折叠含量减少,β-转角和无规卷曲含量有所增加,说明超高压导致大豆球蛋白的二级结构发生了变化。其可能的原因是超高压使样品原有的高级结构解聚,肽链被打断,部分肽链扩散开,部分α-螺旋和β-折叠结构在超高压后转变为无规卷曲。通过对二级结构含量的分析发现超高压后的α-螺旋和β-折叠结构含量降低,这与Tang等[30]的结果相一致。由前面的图2A结果可知,随着压力的增加,大豆球蛋白的抗原性先增加后降低,其抗原性下降可能是由于二级结构中α-螺旋和β-折叠含量降低,而无规卷曲含量增加,空间结构发生改变导致了抗原表位的掩盖,进而使蛋白抗原性降低。
2.6 超高压处理对蛋白质表面疏水性及空间结构的影响
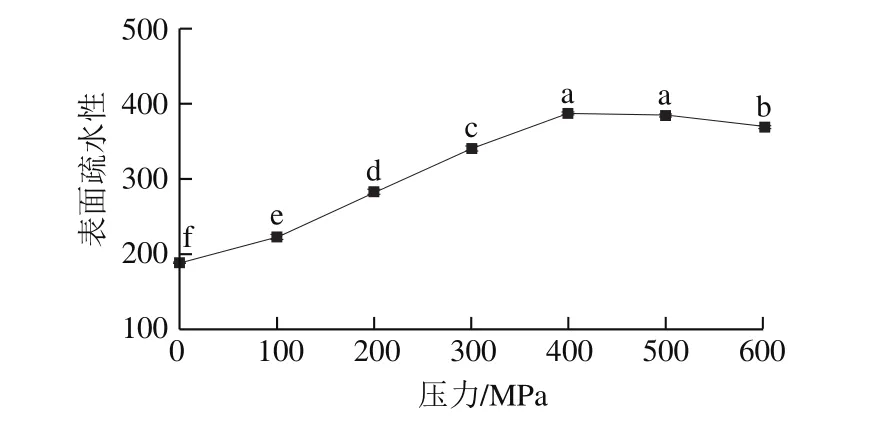
图7 超高压处理大豆球蛋白的表面疏水性Fig. 7 Surface hydrophobicity of glycinin after high hydrostatic pressure treatment
表面疏水作用是维持蛋白质三级结构的主要作用力,在维持蛋白质的三级结构的稳定和四级结构的形成中占有突出的地位[31]。蛋白质表面疏水性的变化可以反映蛋白质三级结构变化情况,由图7可知,大豆球蛋白的表面疏水性随着处理压力增加而增大,表明蛋白质经超高压处理后暴露出更多的疏水性区域,同时也说明大豆球蛋白的三级和四级结构经超高压处理后发生了变化。蛋白质结构的变化会引起抗原性的变化,大豆球蛋白的空间构象表位经超高压处理后被破坏,可能掩盖其抗原表位,从而导致其抗原性减弱[32]。
3 结 论
超高压作为一种新型的加工方式,能显著影响大豆球蛋白的抗原性。研究结果表明,不同压力、加压时间、蛋白质量浓度均对大豆球蛋白的抗原性有明显影响,其中在压力500 MPa、处理时间20 min、蛋白质量浓度为5 mg/mL时其抗原性降低效果最好,与没有高压处理的蛋白相比下降了35.65%。傅里叶变换红外光谱和荧光光谱分析结果表明超高压处理后大豆球蛋白中α-螺旋和β-折叠有序结构含量降低,无规卷曲含量增加,且暴露出更多的疏水性区域,因此可能引起蛋白中的构象性表位被破坏或掩盖,从而导致其抗原性降低。本研究深入分析了大豆球蛋白的抗原性与其结构变化的规律及相关性,为进一步探明超高压影响大豆球蛋白过敏原的作用机理提供了参考,同时为食品加工过程中选择合适的超高压条件来降低大豆蛋白致敏性提供了一定的理论依据。

