肠道菌群调控下的食物过敏机制研究进展
傅玲琳,谢梦华,王 翀,黄健健,钱 怡,王彦波,*
近些年,食物过敏人群数量快速增加,调查发现约8%的儿童和4%的成人对一种或多种食物有过敏症状,这被认为与环境变化和抗生素药物使用等因素有关[1]。食物过敏是对无害食物蛋白质(即过敏原)产生的不良反应,分为由免疫球蛋白(immunoglobulin,Ig)E介导、非IgE介导以及IgE和非IgE混合介导3 类,其反应时间短,多在数分钟到2 h内引发各类症状[2]。一般人摄入此类食物蛋白质通常因口服耐受产生IgG、IgM、IgA,从而清除抗原,机体不产生症状,但一些特殊人群摄入特定种类的过敏原会产生IgE[3],从而快速引发机体多个部位不同的症状反应,如皮肤的瘙痒、红肿、荨麻疹,呼吸道的哮喘、咳嗽,胃肠道的恶心、呕吐、腹泻等;反应严重时甚至导致休克和死亡[2]。食物过敏的产生与机体对食物抗原的口服耐受失调或者缺失有关[2]。研究表明,胃肠道中影响免疫耐受的两个主要因素是食物本身和共生微生物的组成与功能[4];因此,口服耐受的形成及维持与机体肠道内的共生微生物有密切关系。另外,特定益生菌菌株因其能够修饰抗原、修复肠屏障功能、调节紊乱菌群结构以及恢复局部或全身免疫调节,从而增强机体的免疫耐受,因此具有缓解食物过敏的潜力[5]。
本文主要从口服耐受和食物过敏产生的分子及细胞水平机理出发,阐述目前已报道的肠道共生微生物及其代谢产物调节食物过敏的主要机理,并归纳近些年文献中报道的具有抗过敏效果的益生菌种类,以期为食物过敏的预防及治疗提供新的思路,并最终减少食物过敏的发生。
1 食物过敏概述
1.1 食物过敏流行病学特点
地域环境、基因遗传、膳食结构、种族差异等是造成食物过敏流行病学地区分布差异的主要原因。研究表明多种因素会影响食物过敏的发病率,不可控因素如年龄(婴幼儿比成人易对食物过敏)、性别(儿童中男孩发病率高)、种族(非白种人比白种人发病率高)以及遗传基因及家族遗传病等;还有一些可控的潜在因素如特征性皮炎、卫生习惯、肠道菌群、维生素(VA和VD)缺乏、膳食结构(脂肪过多)、抗氧化剂和抗酸剂的使用(影响过敏原的消化)等[6]。地域环境、膳食结构使得不同地区食物过敏的主要过敏原种类有所不同,如亚洲主要为甲壳类及贝类过敏,美国为花生及牛奶过敏[7]。年龄对过敏发病率也有很大影响,调查发现在对鸡蛋、牛奶、小麦以及大豆过敏的儿童中,约70%~80%在成年后不再对相应过敏原有过敏反应[8-13],约50%在6 岁后就不再对鸡蛋和牛奶过敏,而花生过敏儿童仅有20%在成年后不再过敏,坚果过敏儿童中更是仅有10%[14-18]。
目前,对于同一地区或不同地区、同一人群或不同人群存在多个不同的食物过敏流行病学数据,主要是因为对于食物过敏的诊断还未有统一的标准。现临床上多通过病史和体检确认过敏原、皮肤点刺实验(skin prick test,SPT)和血清抗原特异性lgE(specific IgE,slgE)检测以及被奉为食物过敏诊断金标准的双盲安慰剂对照的食物激发实验(double-blind,placebo-controlled food challenge,DBPCFC)等方法判断食物过敏[18-19],这些方法各有优点与不足,不同的研究者往往会根据自身情况采用不同的诊断方法,从而使得食物过敏的流行病学数据一般都是基于自我的报告研究,得出的食物过敏流行病学数据存在差异,没有统一的标准和结果[18,20]。
1.2 口服耐受与食物过敏
1.2.1 肠道中食物抗原摄取
食物过敏原(大多为蛋白质)在进入机体后,会经过两个阶段被摄取吸收。第1阶段:食物蛋白首先经过胃肠道的消化分解变为小分子蛋白或多肽。研究表明蛋白的消化率对过敏原的致敏性有影响,Untersmayr等[21]利用小鼠模型对比了抗酸剂、鱼类蛋白共同口服灌胃致敏小鼠和鱼类蛋白单独灌胃致敏小鼠的致敏性差异,发现抗酸剂的使用会增加小鼠产生食物过敏的机率,表明酸(主要指胃酸)能降低食物蛋白的致敏性。这可能是因为若食物蛋白被完全消化,则无法形成完整的与IgE结合位点,故无法和嗜碱性粒细胞、肥大细胞表面的IgE结合,从而不能诱发食物过敏反应[22]。第2阶段:分解后的蛋白或多肽等主要通过5 种方式通过肠道屏障(图1):1)肠道相关的淋巴组织(gut associated lymphoid tissue,GALT)中某些组织,如派式结(Peyer’s patches,PP)和孤立淋巴滤泡中的微褶皱(microfold cells,M)细胞,可通过跨细胞途径从肠腔中摄取颗粒抗原(包括微生物)。随后,这些抗原被呈递到位于上皮细胞下方或者M细胞基底表面创造的“口袋”中的树突状细胞(dendritic cells,DCs);同时,周围的上皮细胞将产生趋化因子CCL20,与远端的DCs表面CCR6受体识别结合后使之迁移至此处[23];2)可溶性抗原通过上皮细胞的紧密连接扩散通过肠上皮细胞[23-25];3)通过肠上皮细胞的跨细胞途径[23-24];4)在某些条件下,肠上皮细胞能在基底外侧表面表达主要组织相容性复合物(major histocompatibility complex,MHC)II类蛋白,从而摄取抗原[23-24,26];5)CX3CR1+巨噬细胞通过延伸“触角”摄取肠腔中抗原,并可将抗原呈递给附近的CD103+DCs[27-29]。
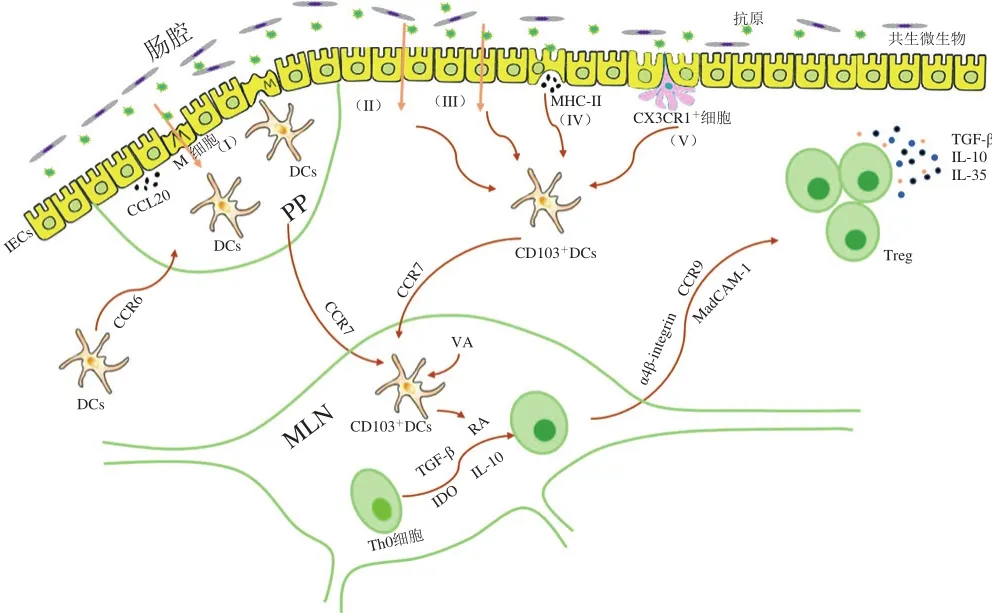
图1 肠道相关的淋巴组织中抗原摄取及产生口服耐受的机理Fig. 1 Mechanisms of antigen uptake and oral tolerance to antigens in GALT
1.2.2 口服耐受产生机理
机体对自身抗原及无害的非自身抗原的免疫无应答称为免疫耐受[2]。免疫耐受在机体正常生长繁殖中起着至关重要的作用,人体对进入机体的病原体会产生多种免疫应答,从而清除病原体,而免疫耐受保证了机体对食物中外源蛋白不产生应答。为维持免疫耐受,机体不但要识别自身抗原和非自身抗原,还要区分非自身抗原对机体是否有害[24],而胃肠道在这一过程中则扮演着重要角色。对于机体不同部位(肠道、皮肤等)、不同抗原(可溶性抗原、肠道微生物等),免疫耐受机理略有差异,本文侧重于阐述食物蛋白通过肠道黏膜系统引起口服耐受。
如图1所示,口服耐受主要由CD103+DCs介导[2],CD103+DCs携带已通过肠道屏障的抗原,迁移至肠系膜淋巴结(mesenteric lymph node,MLN)中,并将抗原呈递给初始辅助性T细胞(helper T cells,Th)0,从而促进Th0细胞分化为调节性T细胞(regulation T cells,Treg)[26],Treg的分化涉及多重机制:1)CD103+DCs受Aldh1a2调控表达视黄酸脱氢酶2(retinaldehyde dehydrogenase2,RALDH2),将VA转化视黄酸(retinoic acid,RA),从而促进Th0细胞分化为Treg,并提高Treg表面肠道归巢受体CCR9的含量[30-32]。研究表明,视黄酸不仅能促进T细胞的归巢反应,还能促进B细胞的归巢反应,并且能与DCs分泌的白细胞介素(interleukin,IL)-5、IL-6产生协同作用,诱导IgA分泌[33]。2)CD103+DCs表面的αvβ8上调从而激活周围潜在的转化生长因子-β(transforming growth factor-β,TGF-β),进而促进Treg分化和口服耐受的形成[34-35]。3)CD103+DCs自身也可产生TGF-β,从而促使Th0细胞分化为Treg[24,36]。4)CD103+DCs能够表达一种参与色氨酸代谢的酶——吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygense,IDO),促进Treg分化[2,24]。研究表明,抑制IDO的活性将会抑制Treg分化,并转而促使Th0细胞分化为Th1和Th17细胞[37]。随后,MLN中的CD103+DCs诱导新形成的Treg表面上肠道归巢受体CCR9、α4β7以及β7整合素的配体——黏膜血管地址素细胞黏附分子1(mucosal vascular addressin cell adhesion molecule 1,MadCAM-1)的表达,从而使Treg从MLN迁移至小肠固有层(抗原被摄入的地方),从而形成或维持口服耐受[23,38-39]。口服耐受中涉及多种Treg,如产IL-10的Tr1、Th3、Foxp3+Treg[23],且目前大量研究表明Foxp3+Treg在口服耐受中起着至关重要的作用[4,29,32,39]。抗原特异性的Foxp3+Treg通过产生细胞因子TGF-β、IL-10、IL-35抑制肠道固有层中对食物的不良反应[40]。
1.2.3 食物过敏产生机理
大量研究表明,食物过敏是由口服耐受被打破或缺失所引起,多种通路在此过程中发挥着重要的调控作用[29,32]。食物过敏原可经口腔摄入或者与皮肤接触,从而引发过敏反应,且有文献报道,食物抗原经口摄入易诱导口服耐受,而皮肤接触则易诱导食物过敏[41]。
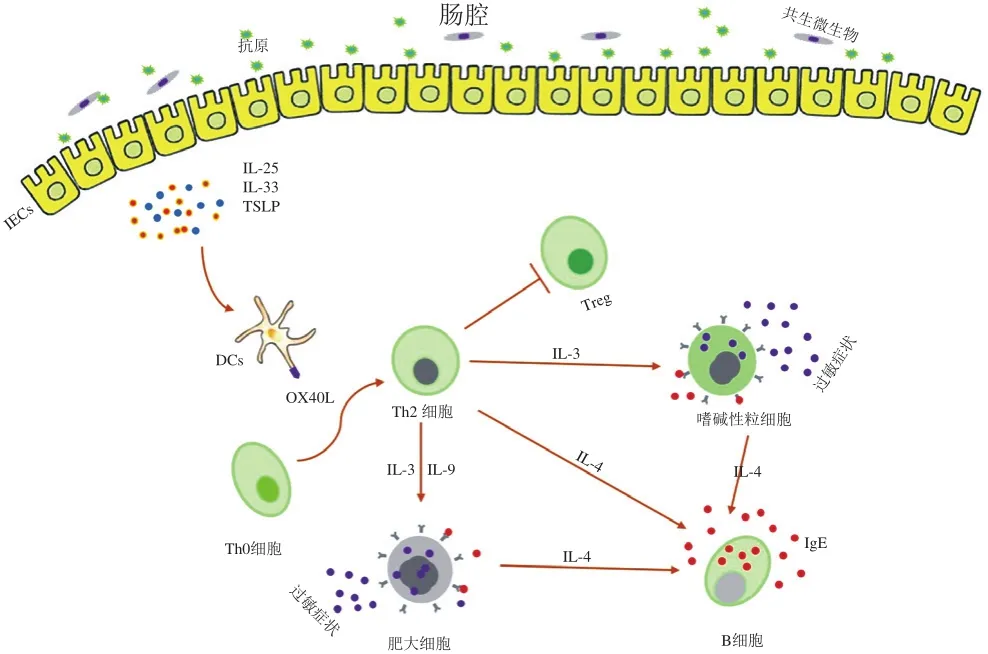
图2 食物致敏的机理Fig. 2 Mechanisms contributing to food sensitization
如图2所示,当肠上皮细胞受损、肠道发生炎症或黏膜佐剂作用时,会增加抗原的渗透,同时肠上皮细胞就会分泌胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)、IL-33和IL-25(主要参与皮肤途径致敏过程),从而上调DCs上OX40配体水平[2,42]。研究表明,这些细胞因子会促进Th2细胞转化,产生Th2型炎症[42]。随之,抗原由DCs等抗原递呈细胞(antigen-presenting cells,APCs)收集并递呈给淋巴结中的Th0细胞,激活的Th0细胞在IL-4的存在下分化为Th2细胞[43]。Th2细胞通过分泌IL-4促进B细胞中Ig发生类型转换,从而产生抗原特异性IgE[2-3]。除此之外,Th2细胞也可通过IL-3、IL-9促进肥大细胞和嗜碱性粒细胞分泌IL-4,从而也可激活B细胞。B细胞分泌的抗原特异性IgE能与抗原穿透部位的肥大细胞所表达的高亲和力FcεRI受体结合,其余的抗体则通过淋巴系统进入人体循环,与血液中的嗜碱性粒细胞和远隔组织中的肥大细胞相结合,使机体致敏[2,44]。当致敏机体再次摄入过敏原后,抗原会迅速与致敏肥大细胞或嗜碱性粒细胞表面的特异性IgE结合,使肥大细胞脱颗粒,释放组胺、白三烯、5-羟色胺、趋化因子等,而嗜碱性粒细胞分泌大量IL-4、IL-13等细胞因子,从而产生过敏反应组织特异性症状[3]。
多项过敏人群研究数据和食物过敏动物模型结果表明,食物过敏的各类症状主要是由于肥大细胞和嗜碱性粒细胞所引起的[2,45-46],正如上所述,肥大细胞脱颗粒,释放组胺、白三烯等,嗜碱性粒细胞分泌大量IL-4、IL-5、IL-13等Th2型细胞因子,从而引发过敏反应多种不良症状[3]。但近些年,有研究发现在花生过敏个体中,骨髓细胞也参与食物过敏的早期,如单核细胞、嗜中性粒细胞等[2,47-48]。Tordesillas等[47]采用质谱流式测定花生过敏患者在短时暴露于花生过敏原后外周血中所有主要类型细胞的激活情况,发现除嗜碱性粒细胞外,单核细胞、DCs、嗜中性粒细胞也被激活。类似的,在鸡蛋过敏患者的外周血单核细胞中也发现Toll样受体(Toll-like receptor,TLR)和单核细胞被激活的现象[49]。很多研究者在不同的过敏原致敏动物模型中发现了不同的现象,因此,对于食物过敏发生机制还没有一个全面的、确切的定论,仍有待进一步研究[2]。
2 肠道菌群(共生菌)调节食物过敏
2.1 肠道菌群与食物过敏之间的联系
食物抗原在肠道内(主要是小肠)被消化吸收,而肠腔中定居着成千上万种微生物,称为共生微生物,且从胃底部的十二指肠到直肠,肠腔内微生物数量逐渐增加,结肠中微生物数量可达1011个/g内容物[50]。大量研究表明,人体肠道中(特别是回肠和结肠)定居的大量微生物在机体肠道黏膜免疫系统中扮演着重要的角色,不仅能促进体内局部区域维持平衡,在黏膜外周也能调节对抗原的免疫应答[51]。但肠道内共生菌种类及数量(统称为菌群结构)并不是一成不变的,它会受外部环境的影响而发生改变。研究表明,膳食结构改变、抗生素的使用、顺产还是剖腹产、母乳喂养、疫苗接种等都会改变肠道菌群结构[52]。多项实验表明肠道菌群结构发生变化会使机体内一些保护体内平衡的信号缺失,破坏Th1/Th2平衡,使其偏向Th2反应,从而诱发过敏及炎症反应[29,53],这也是近些年食物过敏高发的原因之一。
对过敏人群研究数据表明,使用抗生素会提高食物过敏的发病率,即使是幼年时期低剂量抗生素的摄入也会导致一个长期的代谢和免疫应答[54]。如Metsälä等[55]发现母体在怀孕前/中以及孩子出生1 个月内服用抗生素与婴幼儿牛奶过敏发生率增加密切相关。此外,多项动物实验研究也表明利用广谱抗生素消除或减少肠道微生物,可加剧食物过敏反应。如Stefka等[56]在花生过敏模型中,发现用抗生素处理新生小鼠,其体内的花生特异性IgE和IgG1会增加。Cahenzli等[57]利用无菌小鼠构建食物过敏模型,发现其体内含有高水平IgE,且过敏症状更为严重。此外,有文献报道将正常小鼠粪便或肠道微生物接种到无菌小鼠或抗生素处理小鼠体内,可有效减轻食物过敏症状。如接种梭状芽孢杆菌(Clostridia,属于厚壁菌门;16S rRNA测序表明经抗生素处理的小鼠肠道内拟杆菌门和厚壁菌门的细菌数量显著减少)到抗生素处理小鼠肠道内,可防止食物过敏的发生[56];但同时也发现,在花生过敏模型中分别接种单形拟杆菌(典型的拟杆菌)和梭状芽孢杆菌(典型的厚壁菌)到无菌小鼠体内,梭状芽孢杆菌能显著降低花生特异性IgE含量,而单形拟杆菌则无此功效[56]。在食物过敏的小鼠模型中,时常发现同一致敏组中,尽管大部分小鼠都表现出过敏症状,但仍有部分小鼠对于过敏原的摄入无免疫应答,Diesner等[58]发现,无免疫应答小鼠的肠道内有独特的菌群结构,可防止食物过敏。
2.2 肠道菌群调控食物过敏的相关机理
虽然普遍认为食物过敏的产生与肠道菌群的变化有很大关系,但现今对肠道菌群调控食物过敏的确切机理知之甚微、没有明确的结论,这方面的研究仍然处于刚起步的阶段。目前已经发现的肠道微生物调节食物过敏的可能机理见图3,主要包括以下几个方面。
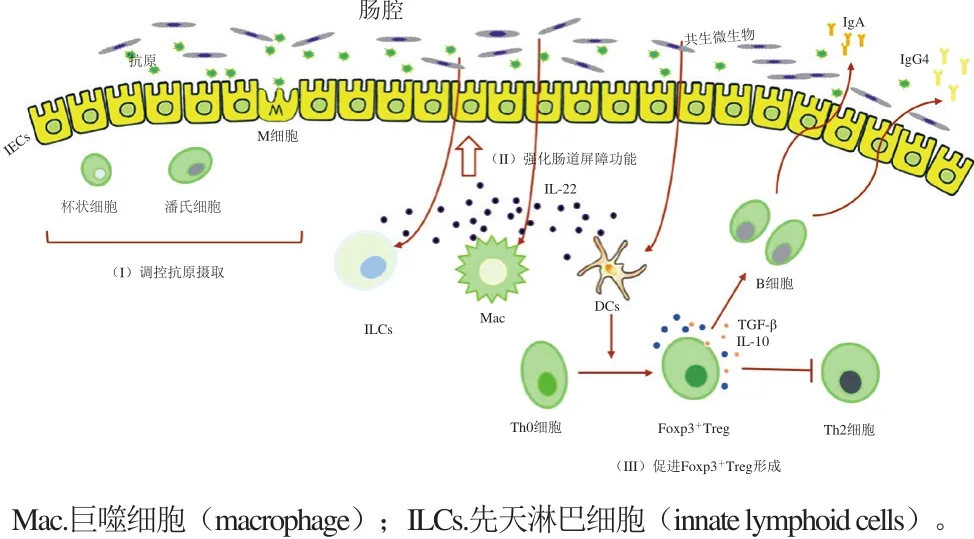
图3 肠道微生物调节食物过敏的潜在机理Fig. 3 Potential mechanisms of action of intestinal microorganisms in regulating food allergy
2.2.1 肠道微生物与IEC旁多种细胞相互作用,调控抗原摄取,维持黏膜免疫平衡
IEC作为肠道屏障的重要组成部分,可通过其紧密连接调控肠腔的食物抗原进入固有层[23]。肠道微生物可直接与IEC作用,促进防御素的产生,从而加强肠道上皮细胞屏障功能[18]。IEC能表达TLR并产生细胞因子以应对肠道内微生物的不断刺激[59]。IEC中的M细胞在微生物信号的刺激下可以递呈抗原给DCs等APCs[29];杯状细胞能够分泌黏液形成一层屏障,阻断大部分的微生物和IEC的直接接触[60];潘氏细胞能够产生抗菌肽,从而调节菌群结构[61]。CX3CR1+细胞(疑似一种巨噬细胞)一般位于肠道固有层,主要参与从肠腔内摄取抗原,但当肠道菌群结构发生变化,它会迁移至其他地方,从而降低抗原摄取影响口服耐受的形成[62]。现有研究也表明CX3CR1+细胞可产生IL-10从而促进固有层中的Treg增殖[63]。
2.2.2 肠道微生物诱导IL-22产生,强化肠道屏障功能,防止食物过敏
IL-22仅能由血细胞产生,但其受体则由非血细胞(特别是黏膜中的肠上皮细胞)产生,在免疫细胞和肠道上皮细胞的交流中扮演着重要角色[64]。肠道微生物可以与DCs、巨噬细胞、先天淋巴细胞相互作用,促进IL-22的产生,加强肠道上皮细胞屏障功能[18]。如1.2.2节所述,CD103+DCs在产生及维持口服耐受中起着至关重要的作用,但研究表明CD103+DCs可接收微生物信号(如鞭毛蛋白)产生IL-23,再诱导其他细胞产生IL-22,影响上皮细胞功能[29]。但也有研究表明,肠道嗜酸性粒细胞可以分泌嗜酸性粒细胞过氧化物酶激活CD103+DCs,使MLN中Th0细胞分化为Th2细胞而不是Treg[65]。ILC有多种类型,ILC2能够产生Th2型细胞因子,加剧食物过敏,而ILC3(特别是RORγt+ILC3)在其他细胞产生的IL-6、IL-23、RA调控下产出IL-22,强化IEC功能,促进抗菌肽(如再生胰岛衍生蛋白3β和黏液)的表达[29]。在稳定状态下,若小鼠缺乏RORγt+ILC3,其肠腔内的微生物将更容易迁移至外周其他器官,但这可通过摄入IL-22改善[66]。
2.2.3 肠道微生物代谢产物可诱导Foxp3+Treg产生,从而促进口服耐受,防止食物过敏
肠道中食物的代谢产物能够向机体传送一些信号,从而调节机体免疫应答。由于不同的膳食结构给微生物提供的营养物质不同,就会产生不同的肠道菌群组成,从而引起不同的免疫应答。如膳食纤维在肠道微生物的作用下可分解为短链脂肪酸(short-chain fatty acids,SCFAs),如乙酸、丙酸、丁酸,从而参与机体各个代谢途径[32]。SCFAs是结肠细胞的能量源泉,不仅可作为组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂通过单羧酸转运蛋白进入细胞,还能通过G蛋白偶联受体(G protein-coupled receptors,GPRs)传递信号[29]。研究表明Treg与GPRs传送的信号、HDAC抑制均有所联系[29]。SCFAs与GPRs结合后不仅可作用于肠上皮细胞激活炎性小体产生IL-18,从而强化肠道完整性、修复上皮细胞损伤[67],还可作用于DCs,从而促进Th0细胞分化为Foxp3+Treg,并且也可直接作用于Foxp3+Treg,促进其自我增殖[24]。研究表明,高膳食纤维饮食或直接口服灌胃乙酸、丙酸、丁酸均能够提高无菌小鼠或抗生素处理小鼠体内Foxp3+Treg的比例[32]。除此之外,也有文献报道,微生物能够直接作用于Th0细胞,促进其分化为Foxp3+Treg[18]。如梭状芽孢杆菌通过在结肠固有层中诱导产生高TGF-β的环境,从而促进Foxp3+Treg分化[56]。形成的Foxp3+Treg细胞可通过TGF-β、IL-10、IL-35抑制炎症反应,维护口服耐受[40]。另外,也有文献报道,肠道微生物诱导形成的Foxp3+Treg能够分泌TGF-β、IL-10,从而促进分泌IgA/IgG4型B细胞产生更多IgA/IgG4进入肠腔,维护免疫耐受[18]。Foxp3+Treg可以抑制Th2细胞,降低Th2型细胞因子和抗原特异性IgE[32]。
虽然肠道共生微生物影响结肠外其他部位的免疫应答能力已在多个实验中得到证实,但结肠(属于大肠)中微生物的信号如何形成对小肠中食物抗原的免疫应答仍然是一个悬而未决的问题。目前对此的解释大体有3种,第1种是通过淋巴细胞的迁移[51]。如图1所示,DCs在CCR6调控下,从远处迁移至M细胞附近,以递呈抗原;MLN中的Treg在归巢受体CCR9和α4β7作用下迁移至小肠;CD4+T细胞在α4β7和GPR15信号作用下会迁移至结肠部位[51]。这表明GALT中的免疫应答虽然是高度分区的,但却不是严格不变的,结肠中淋巴细胞可通过淋巴管网络或体液循环迁移至小肠中,从而影响小肠中对食物抗原的应答[68]。第2种是微生物诱导某些淋巴细胞群产生细胞因子,后者通过多种循环进入其他位置,从而直接参与免疫反应[51]。如2.2.2节所述,结肠中的ILC可通过产生IL-22从而影响小肠中抗原的摄取。结肠中的Foxp3+Treg也能释放抗炎细胞因子,后者在小肠中可促成耐受坏境[51]。第3种就是结肠中微生物代谢产物通过血液循环到达机体其他部位,从而发挥作用,典型代表就是SCFAs[29]。SCFAs参与血液循环,可在门静脉、肝和周围静脉中检测到[69]。正如2.2.3节所述,SCFAs能够促进口服耐受,防止食物过敏。虽然有这3 种解释,但是对于大肠中的微生物信号调控小肠中食物抗原引起的免疫反应的确切机理仍不清楚,需进一步研究。
3 益生菌治疗食物过敏
益生菌是一类对宿主有益的活性微生物,是定植于人体肠道、生殖系统内,能产生确切健康功效从而改善宿主微生态平衡、发挥有益作用的活性有益微生物的总称。2006年,世界卫生组织和联合国粮农组织定义益生菌为“摄入适量且对宿主有益的活性微生物”。有研究报道,当机体中食物过敏风险增加时,益生菌可促进肠内抗原的降解/结构修饰,调节促炎因子的分泌,促使肠道内异常原生微生物菌群正常化,改善肠道屏障功能,从而影响肠道微环境和免疫系统[5]。因此很多研究人员考虑是否可以通过益生菌来调节肠道菌群,从而预防及治疗食物过敏。
3.1 益生菌在治疗食物过敏中的应用
近些年,利用益生菌治疗食物过敏的案例很多,所使用的益生菌种类也有很多,但主要为乳杆菌属和双歧杆菌属,表1列举了一些文献中报道的有治疗食物过敏效果的益生菌。文献研究结果表明,益生菌主要通过调节过敏小鼠体内的细胞平衡(包括Th1/Th2、Th17/Treg)以及Ig(包括IgE、IgG1、IgG2a、IgA)的产生,从细胞因子产出、细胞分化、抗体分泌这几个方面调节食物过敏症状;但益生菌调节食物过敏与肠道菌群结构变化之间的确切关系,益生菌改变菌群结构后向机体传达何种能预防食物过敏的信号,以及整个过程的免疫通路调节机制仍然没有结论,有待进一步研究。
3.2 未来抗过敏益生菌研究的发展方向
虽然大量文献都报道益生菌有预防或治疗食物过敏的潜力,但并不是每一种益生菌都有此功效,因为益生菌对食物过敏的调节作用由菌株种类决定,具有特异性。如2.1节中所述,在花生过敏小鼠模型中分别接种梭状芽孢杆菌和单形拟杆菌,梭状芽孢杆菌能治疗花生过敏,而单形拟杆菌则不能[56]。因此,筛选出具有抗过敏功效的益生菌成为应用益生菌预防及治疗食物过敏的首要问题,但目前对抗过敏益生菌的筛选多是采用动物实验进行摸索,实验周期长、盲目性大,成果甚微,故建立有效、简便的筛选方法可能是抗过敏益生菌研究的一个方向。此外,抗过敏益生菌的研究大多是针对一种益生菌或者两种,多种益生菌组合的研究较少;而单种益生菌抗过敏的作用具有局限性,只能调节部分过敏症状或者只对特定的过敏原才有效果。因此,未来可考虑多种益生菌的协同作用或者益生菌与益生元的结合使用,从而更有效预防及治疗食物过敏。另外,虽然有很多抗过敏益生菌的研究,但目前对益生菌的抗过敏效果仍然有一些争议。有研究表明,虽然益生菌能够降低机体内总IgE水平,减缓过敏特征性症状,但并不能减轻哮喘或呼吸困难的症状[70],而且益生菌治疗食物过敏大多数据均建立于动物实验的基础之上,临床上少量的应用还只局限于观察现象,鲜有研究应用益生菌治愈食物过敏机制的案例。因此,未来抗过敏益生菌的研究应不再局限于动物实验而逐步向临床应用迈进,将益生菌真正应用于治疗食物过敏。
4 结 语
对食物抗原的口服耐受的形成与维持涉及多种物质、组织、细胞之间复杂的相互作用,包括食物抗原、肠道共生微生物、MLN、PP、LP、IECs、APCs、淋巴细胞等,这些相互作用对机体正常的生长发育和内环境稳态至关重要。而口服耐受被打破或者缺失往往会导致食物过敏的发生,使机体多个部位、组织产生不良反应。大量研究表明,肠道菌群在机体免疫系统的形成和功能调节中扮演着不可或缺的角色[6,29,51]。肠道微生物与肠上皮细胞、巨噬细胞、树突状细胞、先天免疫细胞等相互作用,能直接或者通过产生IL-22间接增强肠上皮细胞屏障,控制食物抗原的摄取,并且通过诱导Foxp3+Treg细胞的形成抑制Th2型反应,同时可产生IL-10、TGF-β促进IgA、抗原特异性的IgG4的分泌,从而增强免疫耐受,防止食物过敏的发生。益生菌能够调节肠道菌群结构并且副作用甚小,因此成为近些年预防及治疗食物过敏的热点,但目前对于肠道菌群调节食物过敏的机制以及益生菌缓解食物过敏的研究都处于初步阶段,仍需科研工作者花费大量时间和精力去进一步探索。

