一家族性肥厚型心肌病致病基因的检测及其意义
(上海市儿童医院心内科,上海交通大学附属儿童医院心内科,上海 200062)
肥厚型心肌病(HCM)是一类以左心室肥厚尤其是非对称性室间隔肥厚为特征的心肌病,该病病人年死亡率约为1%[1],是最常见的单基因遗传心血管疾病,主要表现为常染色体显性遗传,是青少年和运动员猝死的首要原因[2-3]。HCM分为肥厚型梗阻性心肌病和肥厚型非梗阻性心肌病。HCM在成人的患病率为0.02%~0.23%[4],我国成年人群发病率约为0.08%[2]。HCM占儿科原发性心肌病的20%~30%,儿童HCM可以累及右心室或者双侧心室,伴有明显的右室流出道梗阻,特别是婴儿病例[5-6]。目前,儿童HCM的发病率暂无统计数据,虽然HCM总的发病率较低,但结合我国庞大的人口基数及其死亡率,推测儿童HCM发病率不容乐观。近5年来,我院每年收治的HCM患儿均超过了100例,因此较早地精准诊断该病的致病原因,显得颇为重要[7]。据统计,40.0%~74.2%的HCM病因并不明确,其中小于1岁的婴儿约占35.8%,而在明确病因的HCM中,以遗传因素为主,包括家族性/肌节蛋白基因缺陷、先天性代谢缺陷等[8]。儿童常见非肌小节HCM包括代谢缺陷、畸形综合征和神经肌肉疾病[9];成人常见非肌小节HCM包括代谢蓄积病,如DANON病(LAMP2基因),FABRY病(GLA基因)、左室肥厚伴WPW综合征(PRKAG2基因)、家族性淀粉样变性(TTR基因)和线粒体心肌病[10]。针对致病基因进行筛查,明确致病突变,有助于HCM病人的诊断和家系成员的早期诊断和排查。最新ACCF/AHA的HCM诊治指南推荐对HCM病人进行全面的致病基因检测[9]。但是由于HCM致病基因多,Sanger测序等传统的筛查方法耗时长、费用昂贵,难以用于快速全面筛查。另外,由于发现的HCM致病突变非常多,遗传异质性导致了目前仍难以明确基因型与表型的关联,限制了基因筛查在判断HCM预后以及危险分层中的应用[11]。因此本研究利用全外显子测序(WES),对一个汉族HCM家系进行全面的致病基因检测,评估WES应用于HCM遗传检测的可行性,并对发现的致病基因突变与其表型的相关性进行分析。
1 对象与方法
1.1 研究对象
本研究对象为一安徽籍家系(图1)。先证者是一位12岁男性患儿(Ⅲ-1)。因体检发现“心动过缓”及心脏杂音来本院就诊,初步诊断为HCM;实验室检查示N末端脑钠肽为933.53 ng/L,既往无高血压、冠心病及糖尿病病史,患儿接受了相关药物治疗。
1.2 研究方法
收集该家系所有成员详细的临床资料,包括体格检查、发病年龄、心电图及超声心动图结果,并根据需要行动态心电图检查。本研究获上海市儿童医院伦理委员会批准(伦理号为:2017R047-E02),所有研究对象签署知情同意书。
1.3 全外显子组测序
采集所有研究对象的外周血2 mL,抽提血液基因组DNA,使用Roche Nimblegen SeqCap EZ Exome V3(罗氏)试剂盒,对患儿样本基因外显子编码区及其上下游20 bp区域进行捕获并扩增,建库,后采用Hiseq 2500高通量测序平台测序,每个样品产生15 bp的配对末端测序数据,样本测序深度平均为100X,核心目标序列区域的测序深度不低于20X。
1.4 生物信息学分析
对测序结果进行图像识别(Base calling),统计测序的Reads长度、数量及数据产量。然后比对参考基因组,获得比对到基因组上的Uniquemapped reads,并对数据进行质控、SNP检测、InDel检测及注释。测序完成后,利用自主开发的软件分析过滤数据,使用BWA-0.7.10软件与人类基因组数据库(GRCh 37 /hg 19)进行比对;再使用GATK软件,识别并过滤单碱基变异和插入缺失变异;利用数据库如千人基因组、ExAC、 gnomAD、HGMD、 ClinVar、 OMIM及本院的370例样本的全外显子测序数据库等进行注释。然后使用SIFT、 Polyphen2、 MutationTaster、MutationAssessor以及HSF等软件对候选基因的致病性进行预测。登录https://www.ncbi.nlm.nih.gov/homologene对突变位点进行氨基酸序列同源性比对。根据数据库注释结果、软件预测结果及其临床表型,对致病突变位点进行筛选过滤。得到候选基因突变列表(Candidates.xlsx),利用ANNOVAR软件预测候选基因突变,并利用GERP 评分表对候选基因的致病性进行排名。对检测到的基因突变,按照美国医学遗传学与基因组学学会遗传变异分类标准的指南解释[12]。
对遗传变异进一步采用如下步骤进行筛选:优先关注公共数据库中收录的可能与疾病相关的遗传变异,如小的插入/缺失(INDEL)、典型的剪切位点改变及错义变异;根据正常人数据库过滤大于5%的SNP突变(已知的 MAF≥5%的致病性变异除外);筛选过滤掉无义突变、移码突变、可变剪切及错义突变等因素;再次与HGMD、ClinVar数据库收录的遗传变异进行比对;根据保守性和软件预测有害性的结果,进行过滤筛选;最后根据临床表型,进一步筛选过滤致病基因突变。
1.5 Sanger测序
对患儿和其父母相关突变所在区域进行PCR扩增,PCR产物送苏州泓迅生物科技有限公司进行一代测序,进一步验证基因突变情况。具体步骤为:从NCBI网站下载MYH7基因DNA全序列(NM_000257.3,Genebank ID:4625);采用Primer 5软件设计聚合酶链式反应引物,由上海生工生物工程有限公司合成;利用PCR试剂盒(天根生化科技有限公司)进行扩增。引物序列:F:5′-CCAGCAGTC-ATCTCTTTACCAA-3′;R:5′-CCCAGTGGCAT-ATATCACCT-3′。反应条件:95 ℃预变性5 min;然后以94 ℃变性25 s,55 ℃退火25 s,72 ℃延伸30 s,35个循环;最后72 ℃延伸5 min。胶回收、纯化,采用正向测序,分析基因序列,然后与标准序列进行比对分析。
2 结 果
2.1 先证者临床表型
先证者(Ⅲ-1)为男性(图1),12岁。心电图提示窦性心动过缓、异常Q波、ST改变(Ⅱ、V5、V6、V7导联ST压低0.5~1.2 mm)、T波改变(各导联T波低钝、倒置);超声心动图检查提示心房增大,左心室舒张末期内径为4.2 cm,左心室收缩末内径为2.6 cm,左心室射血分数为69%,左心室缩短分数为39%。左心室流出道流速快(2.4 m/s),二尖瓣中度反流,三尖瓣前叶脱垂伴轻中度反流(反流压差为38 kPa)。
2.2 致病基因检测
通过WES总共筛查出5个致病基因,分别为MYH7(NM_000257.3)、AGL (NM_000028)、KCNV2 (NM_133497)、ILDR1 (NM_001199799)以及RDX (NM_002906)。见表1。查阅OMIM数据库,根据数据库和临床表型分析,仅MYH7基因突变与临床表型有关联。WES测序发现先证者携带MYH7基因杂合突变c.1210G>A,进一步通过Sanger测序证实其突变(图2),家系遗传筛查,先证者父亲和母亲均无突变。询问家族史,患儿的伯父心源性猝死,未采集到相关血液样本等,故无法推测是否由于家族性HCM诱导的心源性猝死。该突变导致缬氨酸突变为甲硫氨酸,Clustal X分析MYH7基因404 位氨基酸残基的保守性发现,其在不同物种之间具有高度保守性(图3)。
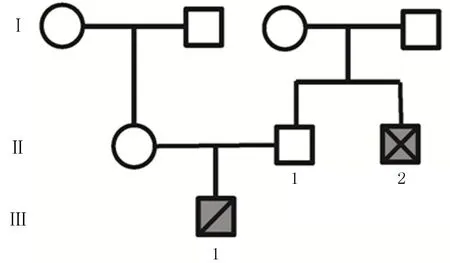
“□”代表正常男性,“○”代表正常女性;Ⅱ-2为患儿伯父,已去世;Ⅲ-1为患儿。
图1HCM家系图
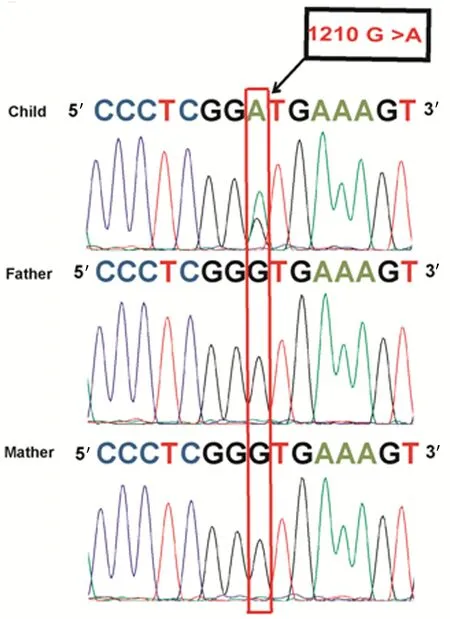
红、绿、蓝、黑四色波峰分别代表胸腺嘧啶脱氧核苷酸、腺嘌呤脱氧核苷酸、胞嘧啶脱氧核苷酸、鸟嘌呤脱氧核苷酸。箭头所指即为突变位点,绿色主峰下出现黑色套峰,表明发生杂合突变。
图2HCM患儿及其家系Sanger测序图

人:NP_000248.2,类人猿:XP_001150786.3,家犬:NP_001107183.1,牛:NP_777152.1,鼠:NP_542766.1,大鼠:NP_058936.1,鸡:NP_001001302.1,斑马鱼:NP_001106204.1。

图3 突变位点在不同物种氨基酸同源序列比对结果
3 讨 论
HCM是主要由编码肌小节蛋白的基因突变所导致的常染色体显性遗传病,其中MYH7基因是HCM的主要致病基因之一,占所有遗传筛查阳性病人的35%~40%[13-14],明确MYH7基因突变所致HCM的临床特点,对于精准判断此类病人的预后并进行危险分层具有重要意义。在本研究中,通过对1个汉族HCM家系进行全面的致病基因筛查,通过生物信息学分析、数据库注释、软件预测和临床表型分析,发现患儿的表型可能由MYH7基因的V404M突变所致,该突变具有较严重的致病性。本研究进一步证实,MYH7基因的V404M突变为有害突变,可能为HCM的致病基因。
HCM是常染色体显性遗传病,较常见的心血管疾病。HCM相关的粗肌丝相关基因MYH7的突变,影响肌纤维产生张力,心肌代偿性增生及肥厚[15],因此,特异性的心肌球蛋白抑制剂可能是此类基因突变疾病的潜在治疗方法[16-18]。β受体阻滞剂可以减轻左心室流出道梗阻的症状。应根据心率、血压、流出道压力阶差水平等调整β受体阻滞剂的使用量,并逐渐增加至最大耐受量,并坚持长期甚至终生服药,避免突然停药[19]。本例患儿给予螺内酯、卡托普利减轻心脏负荷治疗,给予倍他乐克改善心功能,经过精准诊治,患儿情况可,无特殊不适,无胸闷胸痛等。
随着二代测序技术的出现,特别是WES等二代测序能快速准确地了解基因序列信息,可以快速精准地帮助我们了解遗传性疾病,通过对家族相关基因的比对分析,能够较准确地发现致病基因及突变[20]。本研究通过外显子捕获技术富集全基因组DNA,同时应用SIFT、PolyPhen2、HSF软件,预测基因突变的致病性,分析临床表型的同时,能够较准确地找出相关的致病基因。本研究全外显子测序发现了与心肌病紧密相关的MYH7基因突变。本研究通过WES发现了先证者携带的MYH7基因杂合c.1210G>A,进一步通过Sanger测序证实了其突变,家系遗传筛查先证者父亲和母亲均无突变,提示HCM不仅仅是由遗传因素决定,后天的环境因素也可能参与HCM致病调控。该突变导致缬氨酸变为甲硫氨酸,ClustalX分析MYH7基因404位氨基酸残基的保守性发现,其在不同物种之间具有高度保守性,若该位置发生突变,很可能会影响基因和蛋白质的功能。VAN DRIEST等[21]研究显示,综合分析389个HCM病人的基因突变,分析MYH7基因杂合c.1210G>A突变,导致缬氨酸突变为甲硫氨酸,但是没有详细指出该突变的致病性等。
精准医学研究前景广阔,其在心血管领域大有可为[22]。通过WES测序,本研究发现了该家系中MYH7基因的突变位点,并通过各种预测软件如SIFT、Polyphen2、MutationTaster等,预测该突变为致病突变,并且该突变与疾病表型一致,携带该基因突变的病人应考虑安装植入性除颤器,预防猝死。其次,对HCM病人进行致病基因检测,明确疾病的遗传因素,对于家系成员的早期诊断具有重要意义,有助于突变携带者的针对性早期干预和治疗。因此,对于家系中的携带者,可以告知其本人及家属潜在的风险,注重预防并定期随访,以针对心功能出现的异常情况及时给予干预。

