沉默Blimp-1促进IFN-γ表达抑制肝癌细胞的作用研究
邓 浩,彭启旺,李 伟
(武汉市红十字会医院普通外科,武汉 430021)
肝癌是严重威胁人类健康的常见肿瘤,发病率逐年上升[1-3]。肝癌具有初期症状不明显、潜伏期长的特点,多数患者确诊时已是晚期,病情发展迅速,而且预后较差。目前,肝癌的主要治疗方式是手术、肝移植、化疗、分子靶向治疗等,但治疗效果均不理想,预后复发和转移是导致患者死亡率居高不下的主要原因。近年来,通过免疫治疗的方式逐渐应用于临床,其可通过刺激机体免疫系统靶向识别并特异性杀伤肝癌细胞,但对机体自身成分不具有危害性,而且可以产生免疫记忆细胞,防止复发,因此免疫治疗成为肝癌临床治疗的研究热点和重点[4-5]。B淋巴细胞诱导成熟蛋白-1(B-lymphocyte-induced maturation protein-1,Blimp-1),又称为PR结构域蛋白1(positive regulatory domain zinc finger protein 1,PRDM1),在B细胞分化过程中发挥关键作用,其表达量增加可促进细胞产生大量免疫因子,从而调控机体的免疫状态[6-7]。近年来的研究表明,Blimp-1在肿瘤组织的表达量异常,参与肿瘤的发生、发展过程[8-9]。因此本实验通过研究Blimp-1在肝癌细胞中的作用以及作用机制,为肝癌的临床治疗提供实验基础。
1 材料和方法
1.1 实验材料
肝癌SMMC-7721细胞系由本实验室传代、保存,最初购自中科院上海细胞库。
1.2 主要试剂与仪器
RPMI 1640培养基、胎牛血清购自美国Gibco公司;实时荧光定量PCR(RT-PCR)试剂盒购自瑞士Roche公司;TRIzol试剂购自美国Invitrogen公司;CCK-8试剂盒、膜联蛋白V-FITC(annexin V-FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒购自美国Sigma公司;Blimp-1单克隆抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体购自美国Cellular Signaling Technology公司;γ-干扰素(interferon-γ,IFN-γ)、白细胞介素-2(interleukin-2,IL-2)酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自上海森雄生物有限公司;shRNA-NC、shRNA-Blimp1、空载体慢病毒由上海吉玛生物公司合成。酶标仪购自美国赛默飞世尔公司;荧光定量PCR仪购自美国Bio-Rad公司;流式细胞仪购自美国Cell Signaling Technology公司。
1.3 实验方法
1.3.1 细胞的培养和转染
肝癌SMMC-7721细胞置于37℃、5% CO2细胞培养箱,加入RPMI 1640培养基(含1%双抗和10%胎牛血清),倒置显微镜中观察细胞生长状况,隔天更换一次培养基,对数期细胞用于后续实验。细胞转染前一天,更换培养液,以每孔4 × 105个细胞接种于96孔板中。将细胞分为对照组、shRNA-NC组、shRNA-Blimp1(5’-GATCTGACCCGAATCAATG-3’)组,对照组为正常培养的细胞,shRNA-NC组和shRNA-Blimp1组细胞分别转染携带无义序列和Blimp-1序列病毒(10 μL 1 × 1011TU/L),置于细胞培养箱中培养48 h。
1.3.2 实时荧光定量PCR检测细胞中Blimp-1 mRNA的表达量
TRIzol法提取各组细胞中总RNA,采用反转录酶合成cDNA。根据Genebank中Blimp-1 mRNA的序列,使用Primer 5.0软件设计引物,由上海生工合成,引物序列为:Blimp-1上游序列为5’-TGGACATGGAGGATGCGGATATG-3’,下游序列为5’-AGGTCCTTTCCTTTGGAGGAGTTG-3’;GAPDH上游序列为5’-GGGCGCCTGGTCACCAGGGCTG-3’,下游序列为5’-GGGGCCATCCACAGTCTTCTG-3’。反应条件为95℃ 5 min;95℃ 30 s,59℃ 30 s,72℃ 1 min,35个循环;72℃ 5 min。实验重复3次,每组设置5个复孔,采用2-ΔΔCt法计算基因相对转录水平。
1.3.3 蛋白质印迹法(Western blot)检测细胞中Blimp-1蛋白的表达量
收集各组细胞,BCA法定量、稀释,100℃煮沸变性,吸取50 μg蛋白样品进行聚丙烯酰胺凝胶电泳后,将蛋白质转移至PVDF膜中,封闭液封闭1 h,分别加入一抗稀释液,清洗,加入二抗孵育2 h,ECL显色,曝光,显影,与GAPDH灰度值的比值即为目的蛋白的相对量。
1.3.4 CCK-8检测细胞的增殖
以每孔4 × 104个细胞接种于96孔板中,加入培养基至100 μL,放入37℃、5% CO2细胞培养箱培养46 h,每孔加入5 μL CCK-8溶液,振荡混匀,37℃孵育2 h,酶标仪检测波长450 nm下细胞的吸光值(OD值)。
1.3.5 流式细胞仪检测细胞的凋亡
收集各组1 × 106个细胞,采用annexin V-FITC/PI双染法细胞凋亡检测试剂盒,根据其说明书的指示进行下操作,置于流式细胞仪中计算细胞的凋亡率。实验重复3次,每组设置5个复孔。
1.3.6 Transwell法检测细胞的侵袭能力
将已融化的Matrigel胶加入Transwell上室,37℃培养箱中干燥。收集各组细胞,调整为1 × 106/mL,下室加入600 μL完全培养基,37℃培养24 h;PBS液清洗上室,擦去剩余细胞,酒精固定20 min,染色,100倍显微镜计数,取5个视野的平均值,实验重复3次。
1.3.7 ELISA检测细胞培养液上清中IFN-γ、IL-2的表达量
收集各组培养72 h的细胞上清液,采用IFN-γ、IL-2 ELISA检测试剂盒检测IFN-γ、IL-2的水平。
1.4 统计学方法

2 结果
2.1 各组细胞中Blimp-1的表达量
SMMC-7721细胞感染shRNA-NC、shRNA-Blimp1后,RT-PCR和Western blot检测各组细胞中Blimp-1的表达量,结果如表1、图1所示,与对照组相比,shRNA-NC组细胞中Blimp-1 mRNA的表达量无明显变化,shRNA-Blimp1组细胞中Blimp-1 mRNA的表达量较对照组显著降低(P< 0.05);Western blot结果同样显示,与对照组相比,shRNA-NC组细胞中Blimp-1蛋白水平无明显变化,shRNA-Blimp1组细胞中Blimp-1蛋白水平显著降低(P< 0.05)。

图1 Western blot检测各组细胞中Blimp-1蛋白的表达量Figure 1 Protein expression of Blimp-1 in each group of cells detected by Western blot
2.2 沉默Blimp-1对细胞增殖的影响
采用CCK-8法观察各组细胞的增殖状况,结果如表2所示,与对照组相比,shRNA-NC组细胞的增殖能力无明显变化,shRNA-Blimp1组细胞的增殖能力显著下降,差异有显著性(P< 0.05)。

表1 各组细胞中Blimp-1的表达量Table 1 The expression of Blimp-1 in each group of cells
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.

表2 沉默Blimp-1对肝癌细胞增殖的影响Table 2 Effect of silencing Blimp-1 on the proliferation of hepatoma cells
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
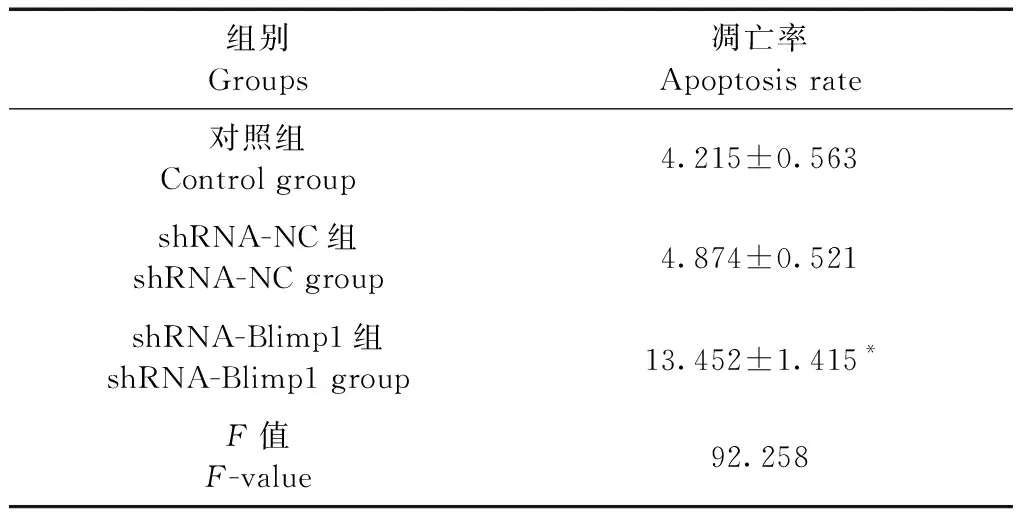
2.3 沉默Blimp-1对细胞凋亡的影响
采用流式细胞仪观察各组细胞的凋亡状况,结果如表3、图2所示,与对照组相比,shRNA-NC组细胞的凋亡率无明显变化,shRNA-Blimp1组细胞的凋亡率显著增加,差异有显著性(P< 0.05)。
2.4 沉默Blimp-1对细胞侵袭能力的影响
采用Transwell法分析各组细胞的侵袭能力变化,结果如表4所示,与对照组相比,shRNA-NC组细胞的侵袭数无明显变化,shRNA-Blimp1组细胞的侵袭数显著降低,差异有显著性(P< 0.05)。

图2 沉默Blimp-1对肝癌细胞凋亡的影响Figure 2 Effect of silencing Blimp-1 on the apoptosis of hepatoma cells
组别Groups凋亡率Apoptosis rate对照组Control group4.215±0.563shRNA-NC组shRNA-NC group4.874±0.521shRNA-Blimp1组shRNA-Blimp1 group13.452±1.415*F值F-value92.258
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.

表4 沉默Blimp-1对细胞侵袭能力的影响Table 4 Effect of silencing Blimp-1 on cell invasion
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
2.5 沉默Blimp-1对细胞培养液上清中IFN-γ、IL-2表达量的影响
采用ELISA法分析各组细胞上清液中IFN-γ、IL-2水平的变化,结果如表5所示,IL-2在各组间的变化差异不明显;与对照组相比,shRNA-NC组IFN-γ蛋白水平无明显变化,shRNA-Blimp1组IFN-γ蛋白水平显著上调,差异有显著性(P< 0.05)。
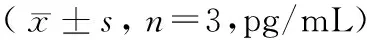
表5 沉默Blimp-1对细胞培养液上清中IFN-γ、IL-2表达量的影响Table 5 Effect of silencing Blimp-1 on the expression of IFN-γ and IL-2 in cell culture supernatant
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
3 讨论
Blimp-1最初被发现在大B细胞淋巴瘤中表达缺失,可能起抑制肿瘤发展的作用[10]。Blimp-1基因位于人常染色体上,具有7个外显子,促进免疫B细胞向浆细胞分化的过程,抑制B细胞增殖相关基因的表达。研究表明,Blimp-1发生突变、转录翻译异常等均可促进大B细胞淋巴瘤的产生,因此推断Blimp-1基因可能具有抑癌基因的作用[11-12]。近年来的研究显示,Blimp-1在肿瘤细胞的生长、分化、以及侵袭、迁移过程中发挥重要作用[13-15]。在肺癌中,采用免疫组织学的方法检测Blimp-1在肺癌组织中的表达量,结果显示,Blimp-1在鳞状细胞肺癌中阳性表达率显著增加,可作为临床诊断的新的标志物和研究治疗靶点[16]。在喉癌组织中,Blimp-1的表达量显著上调,并与患者临床分期和淋巴结转移密切相关,提示Blimp-1基因可作为喉癌早期诊断以及预后判断的重要靶基因[17]。
为探究Blimp-1在肝癌细胞中的作用,本文通过沉默Blimp-1在肝癌SMMC-7721细胞中的表达量,RT-PCR和Western blot检测结果显示,在shRNA-Blimp1组细胞中Blimp-1 mRNA和蛋白较对照组显著降低;CCK-8和流式细胞仪检测细胞的增殖和凋亡,结果显示,与对照组相比,shRNA-Blimp1组细胞的增殖显著降低,凋亡率显著增加;Transwell小室法结果显示,沉默Blimp-1基因显著抑制肝癌SMMC-7721细胞的侵袭能力,表明下调Blimp-1可明显抑制肝癌细胞的增殖,促进其凋亡,抑制细胞的侵袭,从而抑制肝癌进一步的发展,在肝癌中发挥抑癌作用,与上述研究结果相一致。
研究发现,Blimp-1不仅对免疫细胞的终末分化以及细胞内稳态具有调控作用,而且对免疫因子的水平具有重要作用[18-20]。在免疫细胞发育、分化和稳定过程中,Blimp-1可与细胞因子IL-2相互作用从而发挥重要的作用[21]。在癌症的发生、发展中,IL-2的表达量具有重要意义[22]。IFN-γ是机体中重要的免疫调节因子,其表达量的增加可以增强细胞的免疫原性,促进细胞凋亡。为了进一步探究Blimp-1在肝癌细胞中的作用,本研究通过ELISA检测各组细胞中IL-2、IFN-γ的表达量,结果发现,沉默Blimp-1基因对肝癌细胞上清中IL-2的表达量无明显影响,但可明显增加IFN-γ的水平,提示Blimp-1可能通过促进IFN-γ的分泌从而抑制肝癌细胞的增殖,诱导其凋亡。
综上所述,沉默Blimp-1促进IFN-γ的表达,显著抑制肝癌细胞的增殖,促进其凋亡,降低细胞的侵袭能力,从而阻碍肝癌的进一步恶化,为肝癌的临床治疗和诊断提供了实验基础。

