Mitf-M基因突变对猪耳蜗血管纹发育的影响
陈林军 邱士伟 龙熙 陈磊 唐朝颖 塞娜 郭维维 杨仕明 韩维举
1中国人民解放军总医院耳鼻咽喉头颈外科聋病教育部重点实验室聋病防治北京市重点实验室军事声损伤防护实验室(北京100853)
2重庆市畜牧科学院(重庆402460)
根据世界卫生组织调查,目前约有5%的患者有不同形式的听力下降,而大部分是感音神经性耳聋[1],在新生儿中约占1/1000[2],而其中极重度感音神经性耳聋占2%[3],大部分为遗传性耳聋包括Waardenburg综合征。根据临床表现可将Waardenburg综合征分为4型[3,4],而其中由Mitf基因突变引起的为Waardenburg综合征2A型,表现为重度感音神经性耳聋、虹膜异色、白色眼圈等。Mitf是小眼球畸形相关转录因子[2],是胚胎期参与调控黑色素细胞游走的重要因子,在耳蜗中主要调节血管纹中间细胞的生长发育。既往对于Mitf基因突变引起血管纹的变化在小鼠和猪上有报道[5-10],认为Mitf基因突变能引起血管纹中间细胞的减少,从而影响血管纹离子转运功能导致耳蜗内电位的降低而引起耳聋,但对血管纹其他结构的影响并没有进一步的报道。
本研究利用Mitf-M基因突变型猪对耳蜗血管纹的变化进行观察,研究Mitf-M突变型猪是否还出现血管纹毛细血管、血管纹边缘细胞的变化,从而进一步阐述Mitf-M基因突变引起耳蜗功能障碍的致病机制。
1 材料和方法
1.1 实验动物
野生型和Mitf-M突变型猪各12头(由重庆畜牧科学院提供),雌雄不限,饲养环境温湿度适宜,该研究方案得到重庆畜牧科学院动物伦理委员会的批准。
1.2 取材及免疫荧光
取出生后 7d、10d、30d、40d日龄的野生型和Mitf-M突变型猪各2头,用0.1ml/kg速眠新(长春兽医大学军需研究所)以及2%的戊巴比妥钠(北京华业寰宇化工有限公司)1ml/kg肌肉注射麻醉,待动物进入深度麻醉状态(角膜反射减弱或消失,无自主肌肉运动)后,立即断颈处死。取出耳蜗,置于4%多聚甲醛溶液中。撕破圆窗膜、卵圆窗膜,蜗尖钻孔,将标本放于4%多聚甲醛溶液中,于4℃冰箱中过夜。
耳蜗切片:耳蜗标本经固定后,快速分离耳蜗骨壁,取出外侧壁(即螺旋韧带和血管纹),分别放入20%蔗糖溶液、30%蔗糖溶液梯度脱水各2h后,置于灌满OTC胶(SAKURA,日本)的包埋盒中,标记好外侧壁位置,置于-20℃冷冻2h。使用冰冻切片机(Leica CM1900,德国)沿外侧壁长轴切片,厚度选择10μm,切片直接贴于多聚赖氨酸载玻片上。每次两种猪的切片各取2张,PBS冲洗三次,每次5min;0.1%Triton溶液30min,加5%羊血清封闭,置于37℃下作用30min,PBS冲洗三次,每次5min;加入200微升PBS液;4℃冰箱过夜,PBS冲洗三次,每次5min,将标本移入1:200稀释的GS-IB4中(Invitrogen,美国),避光常温孵育60min,PBS清洗后,甩干载玻片,SZX10解剖显微镜(Olympus,日本)下使用含DAPI(ZLI-9557,中衫金桥)荧光染料的甘油封片。应用LSM800型号激光共聚焦显微镜(蔡司,德国)观察血管纹、螺旋韧带结构。
耳蜗铺片:耳蜗标本,经快速分离耳蜗外侧壁,将其分离为若干段。PBS冲洗三次,每次5min;0.1%Triton溶液60min,加5%羊血清封闭,置于37℃下作用60min,PBS冲洗三次,每次5min,后移入1:300稀释的Phalloidin溶液中(ab176756,美国),常温避光孵育60min,PBS清洗后,解剖显微镜下铺片,并使用含DAPI荧光染料的甘油封片。应用激光共聚焦显微镜观察血管纹结构。
1.3 统计学方法
所有的标本经免疫荧光染色后用激光共聚焦显微镜观察,在63倍镜下对不同组别不同时间段的耳蜗底回血管纹进行观察。每组每个耳蜗随机选取3张外侧壁切片,对其血管纹毛细血管进行计数取均值;每组每个耳蜗铺片取三个20μm*20μm的视野进行边缘细胞的计数取均值[16]。
实验数据以均数±标准差()表示,使用SPSS22软件进行统计学分析。采用独立样本t检验,P<0.05具有显著统计学差异。
2 结果
2.1 比较野生型猪与Mitf-M突变型猪的耳蜗外侧壁血管纹毛细血管的变化。
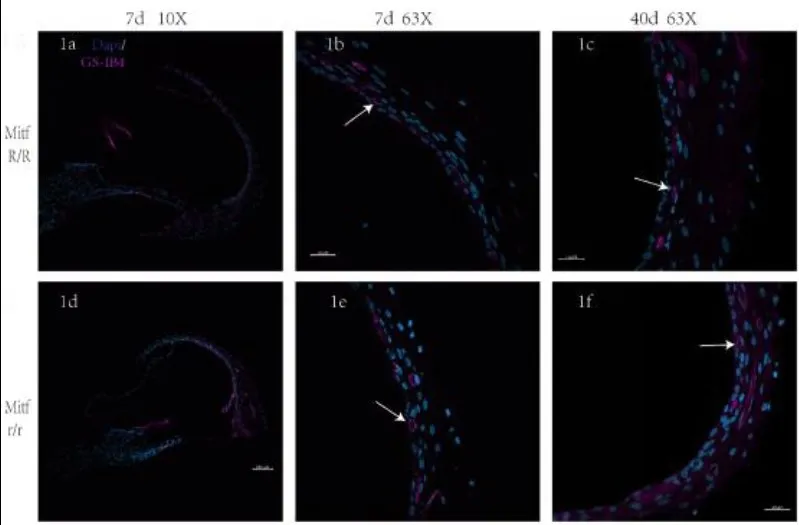
图1 出生后7d与40d的野生型和Mitf-M突变型猪耳蜗的切片,其中1a、1b、1c为野生型猪,1d、1e、1f为Mitf-M突变型猪。1a为7d的野生型猪10X镜下的耳蜗切片图,1b为其对应的63X镜下的图,1c为40d的外侧壁图;1d为7d的Mitf-M突变型猪10X镜下的耳蜗切片图,1e为7d的63X镜下的图,1f为40d的图。Dapi(蓝色)标记细胞核,GS-IB4(紫色)标记毛细血管内皮细胞。图中箭头所指为血管纹的毛细血管。标尺为100μm。Fig.1 sections of the cochlea of wild type and Mitf-M mutant swines at P7,P40.1a,1b,1c are wild type swines,and 1d,1e,1f are Mitf-M mutant swines.1a is cochlear slice of the wild type under 10X microscope at P7,1b is the corresponding lateral wall under 63X microscope,1c is the lateral wall at P40;1d is the cochlear section of the Mitf-M mutant swine at P7 under 10X microscope,1e is the corresponding lateral wall under 63X microscope,and 1f is the lateral wall at P40.Dapi(blue)labels nuclei,GS-IB4(purple)labels capillary endothelial cells.The arrows in the figure refer to the stria capillaries.The scaler is 100 μm.
应用激光共聚焦显微镜对出生后7d、10d、30d、40d的外侧壁标本进行切片观察,在63倍激光共聚焦显微镜下对耳蜗标本进行层扫,扫描结果如图1所示。经过统计,发现在出生后7d、10d及30d,血管纹毛细血管密度没有明显差异,无统计学意义。而在40d的Mitf-M突变型猪的血管纹毛细血管数量出现明显减少,P值=0.005,P值<0.05,有统计学意义(如图2所示)。

图2 血管纹毛细血管密度对比Fig.2 the comparison of stria capillary density
2.2 观察Mitf-M突变型与野生型猪的血管纹边缘细胞形态及数量。

图3 出生后7d与40d的猪的耳蜗血管纹铺片。3a为7d的野生型猪的血管纹铺片,可见边缘细胞形态规则,大小一致,排列紧密,细胞核完整,细胞骨架整齐;3b为7d的Mitf-M突变型猪的血管纹铺片,其边缘细胞形态规则,排列紧密,细胞核完整,细胞骨架整齐,未见破坏。3c为40d的野生型猪的血管纹铺片,结果与3a相近;3d为40d的Mitf-M突变型猪的血管纹铺片,结果类似于3b。Phalloidin(黄色)标记细胞骨架,Dapi(蓝色)标记细胞核。标尺为20μm。Fig.3 the cochlear stria pattern of the swines at P7,P40.3a is the stria pattern of the wild type swines at P7,the shape of the marginal cells is regular,closely arranged,and the size is similar,the marginal nuclei is intact and the cytoskeleton is well-arranged;3b is the stria pattern of Mitf-M mutant swine at P7,the shape of the marginal cells is regular,closely arranged,and the size is similar,the marginal nuclei is intact,the cytoskeleton is neat and without any damage.3c is the stria pattern of the wild type swines at P40,its result is like 3a.3d is the stria pattern of the Mitf-M mutant swines at P40,the result is similar with 3b.Phalloidin(yellow)marks the cytoskeleton and Dapi(blue)marks the nucleus.The ruler is 20μm.
应用激光共聚焦显微镜对出生后7d、40d的外侧壁标本进行铺片观察,在63倍镜下对耳蜗标本进行层扫可见血管纹边缘细胞形态规则,大小一致,排列紧密,细胞核完整,细胞骨架整齐,如图3所示。我们发现在出生后7d、40d的Mitf-M突变型猪的血管纹边缘细胞骨架完整,无明显破坏。经过统计得出在出生后7d、40d的Mitf-M突变型猪相对野生型猪的边缘细胞数量没有差异,P=0.184,P值>0.05,无统计学意义(如图4所示)。
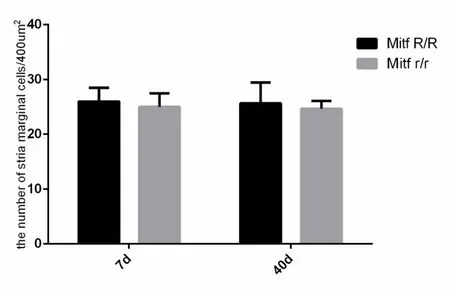
图4 血管纹边缘细胞数的对比Fig.4 the comparison of the number of stria marginal cells
3 讨论
耳蜗外侧壁是由螺旋韧带和血管纹所组成,而血管纹是高度血管化的组织[11,12],由直接接触内淋巴液的边缘细胞、紧邻螺旋韧带的基底细胞及介于两者间的中间细胞和毛细血管网等组成,在调节耳蜗内电位的稳定及离子转运循环中发挥重要作用[13],且对于听觉感觉上皮细胞的存活异常重要。
国外Liu[8]等研究报道由于Mitf突变小鼠可出现血管纹的异常,表现为中间细胞的消失及耳蜗内电位的降低,但未进一步观察血管纹边缘细胞、毛细血管网的变化。结合前期Chen等研究报道[10],Mitf-M型基因突变型猪伴有极重度感音神经性耳聋,检查发现其内耳钾离子浓度极度减低及耳蜗内电位基本消失,推测由于血管纹中间细胞的受损而破坏了耳蜗内电位稳态。根据国外Wangemann[14]研究SLC26A4-/-突变小鼠,由于中间细胞缺乏KCNJ10蛋白,而导致耳蜗内电位的丧失及边缘细胞骨架的坍塌。在我们的研究中通过标记中间细胞的蛋白S100显著减少(该部分数据有待发表),证实Mitf-M突变型猪虽在出生后血管纹中间细胞减少,但并未影响血管纹边缘细胞骨架及边缘细胞数量的变化,且在出生后早期血管纹毛细血管没有明显变化,而从40d开始出现血管纹毛细血管网明显的减少。我们研究表明Mitf-M基因突变引起的血管纹损伤明显不同于SLC26A4-/-突变引起的血管纹的病变。
国外Ingham[15]研究在同样引起EP下降的S1PR2突变小鼠中,从出生后28d开始出现血管纹边缘细胞形态不规则,细胞核大小不一,EP逐渐下降至40mV,且血管纹毛细血管变宽;到P56出现边缘细胞骨架疏松、破坏及血管纹毛细血管肿胀破坏。但在我们实验中发现Mitf-M基因突变并没有引起血管纹边缘细胞骨架的破坏以及血管纹毛细血管肿胀、破坏的现象。对比国外Ohlemiller[16]利用血管纹中间细胞失去分泌黑色素的功能C57BL/6-Tyrc-2J突变小鼠,在24个月后才发现血管纹其厚度变薄,边缘细胞数量轻度的减少,但只出现耳蜗内电位的轻度下降。考虑Tyr作为Mitf[2,17,18]的下游基因,只针对性地影响血管纹中间细胞失去分泌黑色素的作用,而不破坏血管纹调控内淋巴平衡的功能。但在我们的Mitf-M基因突变型猪中发现Mitf-M基因突变导致血管纹厚度的变薄,且耳蜗内电位基本消失,而在早期并没有出现血管纹边缘细胞数量的减少及细胞骨架的破坏,这也让我们进一步明确Waardenburg综合征2A型的病变机制。在发病早期,血管纹由于中间细胞的减少而引起的耳蜗内电位的丧失,但并没有出现血管纹边缘细胞及血管纹毛细血管密度的减少,这也为下一步的基因编辑治疗提供明确的救治时间窗。
前期陈伟[19,20]报道发现猪的内耳和人类相比在功能和形态上极大的相似性,且已建立成熟的内耳手术入路方式。任丽丽等[21]利用从出生前后不同发育阶段的野生型荣昌猪及Mitf-M突变型猪的内耳形态学和听功能的检查比较分析,得出Mitf-M突变型猪的内耳钾离子浓度和耳蜗内电位消失,听功能完全丧失。同时Chen[7]已对突变耳聋猪进行系统的基因分析,明确致病基因为Mitf-M基因突变。即为我们提供了人类Waardenburg综合征2A型的天然大型哺乳动物模型,这也为以后实现基因编辑治疗提供了极佳的临床试验对象。目前基于Cas9的基因治疗已在遗传性耳聋的小鼠中实现听力的部分改善[22,23],而基因编辑技术想应用于治疗人类遗传性疾病的过程中,正缺少合适的大型哺乳动物模型,而该Mitf-M突变型猪正是当前模拟人类疾病进行基因编辑治疗的最佳的动物模型。本研究明确Mitf-M基因突变导致的内耳血管纹等结构的破坏,为实现在该模型中应用基因编辑技术提供了重要的理论基础。

