全脑小胶质细胞分布与 C6 胶质瘤侵袭性研究
孟 锐 蔡思琦 姜春香 隆晓菁 张丽娟
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
1 引 言
小胶质细胞是大脑的常驻免疫细胞,广泛分布于脑和脊髓,约占 10%~20% 胶质细胞[1]。且肿瘤相关的小胶质细胞(Glioma-associated microglias,GAMs)是构成胶质瘤微环境的主要成分之一,对肿瘤的发展产生多重影响[2]。GAMs 在恶性胶质瘤内的密度较其他等级胶质瘤要大,且可影响患者生存期的长短[3]。虽然GAMs 的起源仍然存在争议[3],但有研究表明GAMs 在胶质瘤的影响下,可被募集到胶质瘤微环境中,释放出广泛的生长因子和细胞因子以促进胶质瘤的发生发展[4]。据报道,活化的 GAMs可分泌促进中枢神经系统损伤再生的生长促进因子[5]。Kasahara 等[6]发现小鼠海马脑片培养物中小胶质细胞的异质性随时间的变化而改变,且在中枢神经系统各种疾病中也展现了小胶质细胞的密度有着显著的异质性[7],表明小胶质细胞的异质性随时间、质量和位置的变化而变化。作为胶质瘤微环境的重要组成部分,小胶质细胞与胶质瘤细胞间相互作用,并且这种相互作用可能促进了肿瘤的增殖和侵袭[8]。已有研究表明,胶质瘤细胞会募集和激活小胶质细胞以利于自身的增殖和侵袭[9],而外周的巨噬细胞和原位小胶质细胞构成了主要的胶质瘤浸润细胞[10]。这些研究表明,小胶质细胞是胶质瘤微环境的主要成分之一,并可能对胶质瘤的增值和侵袭具有促进作用,但在影响胶质瘤侵袭的过程中,小胶质细胞的分布状况仍不清楚。因此,本实验旨在通过建立 C6 大鼠模型,以探究全脑小胶质细胞的分布对胶质瘤侵袭性的影响。
2 实验材料与方法
2.1 材料
大鼠神经胶质瘤细胞 C6 购于上海中国科学院细胞库/干细胞库。雌性 SD 大鼠 28 只,鼠龄约为 7 周,质量 250 g 左右,为 SPF 级清洁级动物,购于北京维通利华公司。CO2细胞培养箱(日本 Panasonic 公司),AIRTECH 超净台(苏州安泰空气技术有限公司),脑立体定位仪(深圳市瑞沃德生命科技有限公司),微量注射泵(深圳市瑞沃德生命科技有限公司),10 μL 微量注射器(美国 Hamilton 公司,型号为 701),磷酸盐缓冲生理盐水(PBS,美国 Invitrogen 公司),新生小牛血清(美国 Sigma 公司),DEME 培养基(美国 Invitrogen 公司),青霉素/链霉素双抗(美国 Invitrogen 公司)。西门子 3T 磁共振成像系统(德国 SIEMENS 公司,型号为 Tim Trio),莱卡切片机(德国 Leica 集团)。涉及到动物相关的实验均得到了中国科学院深圳先进技术研究院动物伦理委员会的批准(SIAT-IRB-160506-YGSZHR-A0229)。
2.2 方法
2.2.1 C6 大鼠胶质瘤模型构建
首先,将 10% 水合氯醛(0.3 mL/100 g)于大鼠腹腔内注射 1 mL 麻醉剂后,采用立体定位仪固定大鼠头部,手术暴露颅骨标志。其次,于囟穴(Bregma)点右侧 3 mm、上侧 1 mm 处,以注射器针头钻孔后,使用微量注射器抽取细胞悬液固定于定位仪,沿骨孔缓慢进针至硬脑膜下6 mm,退针 1 mm,以 1 μL/min 的速度注入细胞悬液 10 μL,注射后留针 5 min 再缓慢退针[11]。最后,骨蜡封闭骨窗,缝合头皮切口后消毒皮肤。术后以每笼 3~4 只大鼠进行饲养,成功建立 28 只胶质瘤大鼠模型。
2.2.2 磁共振成像和肿瘤直径测量
分别在种瘤后第 7、9、12、14、16、18、22、23、24 天进行核磁共振 T2 加权成像扫描(T2 Weighted Magnetic Resonance Imaging,T2WI)。具体步骤为:先用 3% 的异氟烷混合氧气吸入诱导麻醉;然后,再将 1.5% 异氟烷通过通气管道让大鼠持续鼻腔吸入进行麻醉;最后,将大鼠门齿固定于小动物线圈进行磁共振成像(MRI)扫描,主要成像参数为重时间 4 000 ms、回波时间 85.7 ms、层数 16、层厚 1.5 mm、FOV=59 mm。最终依据实体瘤的体积评价标准RECIST[12],在肿瘤径线最大的冠状位层面测量其最大直径,同时记录该层面内肿瘤的平均 T2信号强度。
2.2.3 全脑组织病理染色和免疫荧光染色
磁共振成像获取相关数据后,首先,牺牲实验动物并取出 28 只大鼠的大脑进行组织切片苏木精-伊红(Hematoxylin-Eosin,HE)染色(30 μm)和免疫荧光染色。其中,钙离子结合的受体分子(Ionized Calcium-Binding Adapter Molecule,IBA-1)对小胶质细胞进行标记[13],4′, 6-二脒基-2-苯基吲(4′, 6-Diamidino-2-Phenylindole,DAPI)对细胞核进行标记[14]。其次,利用尺度不变特征变换(SIFT)算法[15]检测HE 染色图像与免疫荧光图像中的不变特征,并在两幅图像之间的区域灰度、特征向量空间分布和特征符号描述进行匹配,以进行变换模型参数的估计,包括仿射变换、投影变换和非线性变换。最后,将 HE 染色图像变换到免疫荧光图像的空间域进行图像融合,从而找到 HE 染色图像标注的 9 个与免疫荧光图像对应的感兴趣区域(Regions of Interest,ROI),进而计算 9 个 ROI的小胶质细胞平均荧光强度。并采用线性回归与曲线估算的方法评估小胶质细胞分布的时空特性与胶质瘤进展的关系(SPSS 23.0),其中P<0.01表示有显著统计学意义。实验过程如图 1 所示。
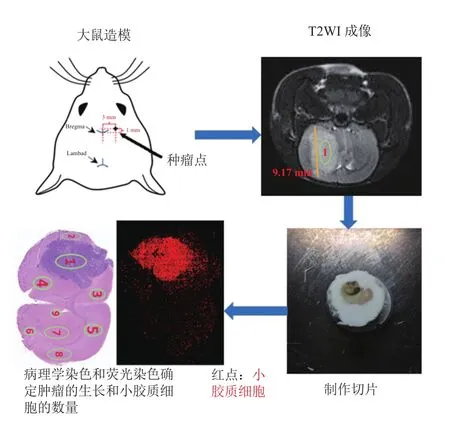
图1 C6 大鼠模型建模示意图以及感兴趣区域的选取Fig. 1 Illustration of the experimental procedures
3 结果
3.1 C6 胶质瘤进程与各感兴趣区域内小胶质细胞密度的测量分析
种瘤 1 周后可在 T2WI 上观察到明显的胶质瘤信号。胶质瘤内部平均荧光强度显著大于其他ROI 的平均荧光强度值(P<0.001),9 个 ROI 的小胶质细胞平均荧光强度测量结果如图 2 所示。随着肿瘤生长,各 ROI 内平均荧光强度与肿瘤直径之间呈显著正相关。当肿瘤直径达到 9 mm时,各 ROI 平均荧光强度之间的差异显著增加(图 3、表 1)。
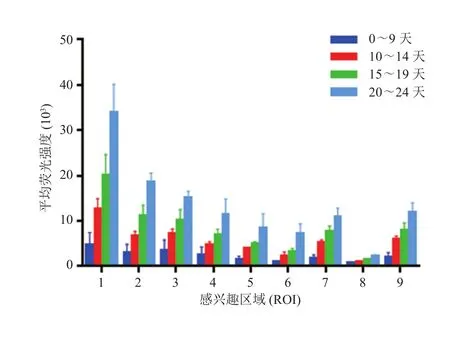
图2 各个成瘤阶段不同 ROI 中的平均荧光强度分布Fig. 2 Summary of the average mean density in the def i ned ROIs according to the staged growth time
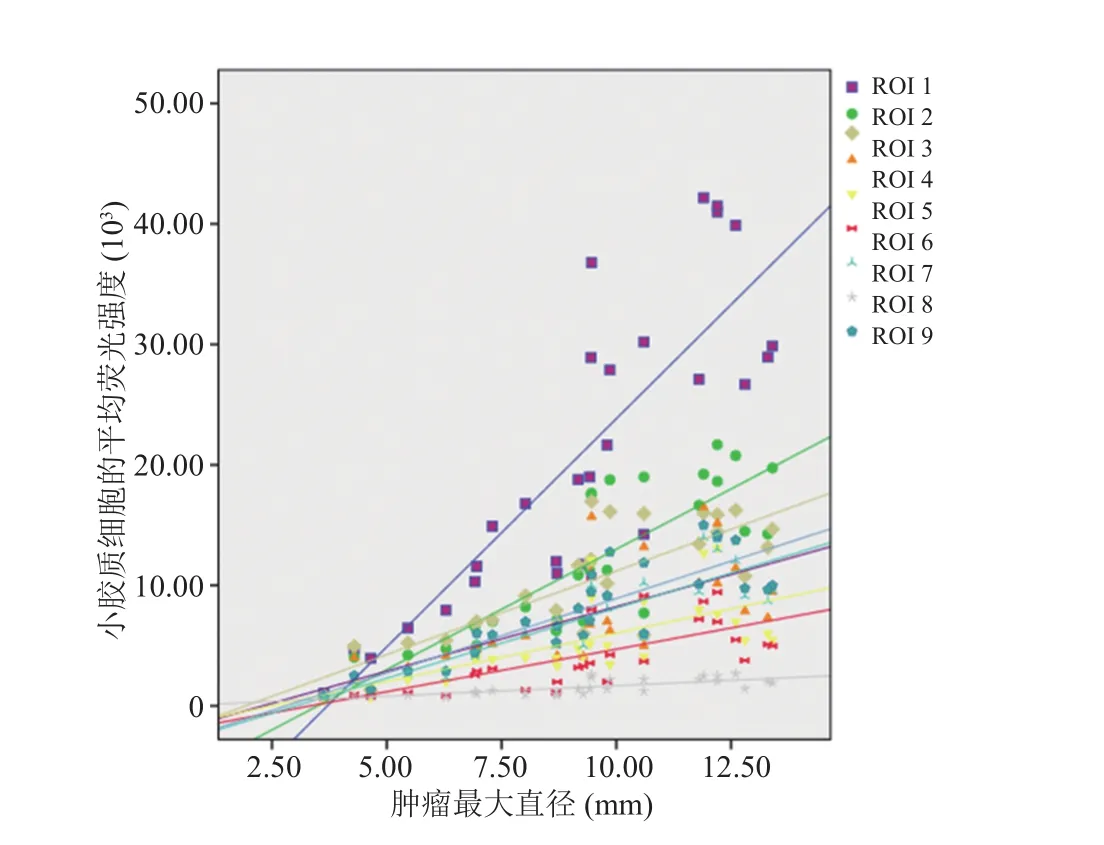
图3 平均荧光强度与胶质瘤最大直径呈线性相关的关系Fig. 3 The relationship between the diameter of glioma and the mean density of microglia for all the ROIs
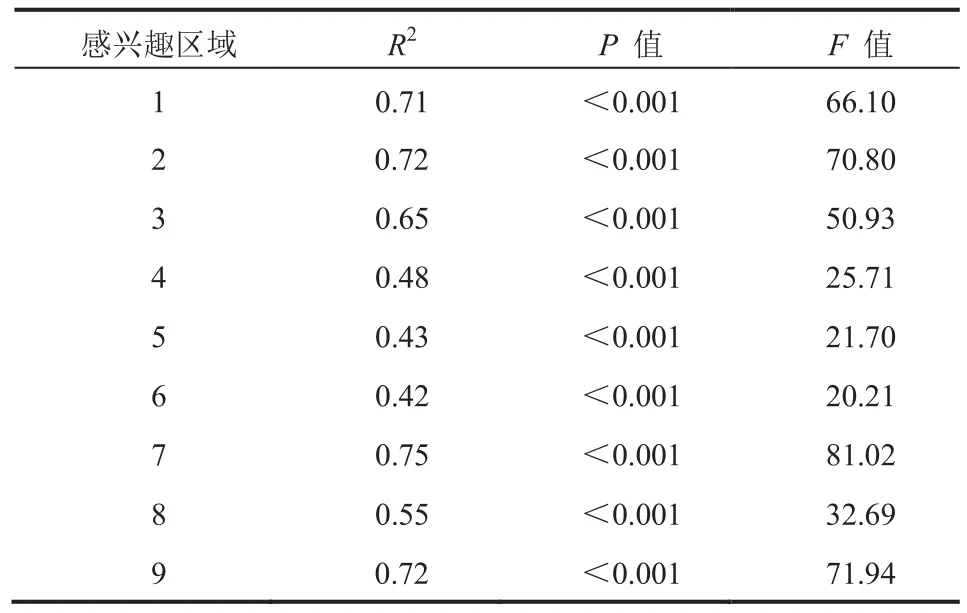
表1 平均荧光强度与胶质瘤最大直径拟合的相关统计学参数Table 1 Summary of the statistical parameters of the linear regressions between mean density and day
3.2 平均荧光强度与成瘤时间的相关性分析
图4中平均荧光强度与成瘤时间的相关性分析显示,肿瘤内部和非肿瘤区域各 ROI 的平均荧光强度随着成瘤时间的增加均呈二次曲线增加(R2=0.91,F=129.49,P<0.001)。肿瘤直径达到 9 mm 所对应的成瘤时间为 16~18 天,在该时间段内,即肿瘤区域平均荧光强度随着成瘤时间的增加而增加,且增加速度显著高于非肿瘤区ROI 。
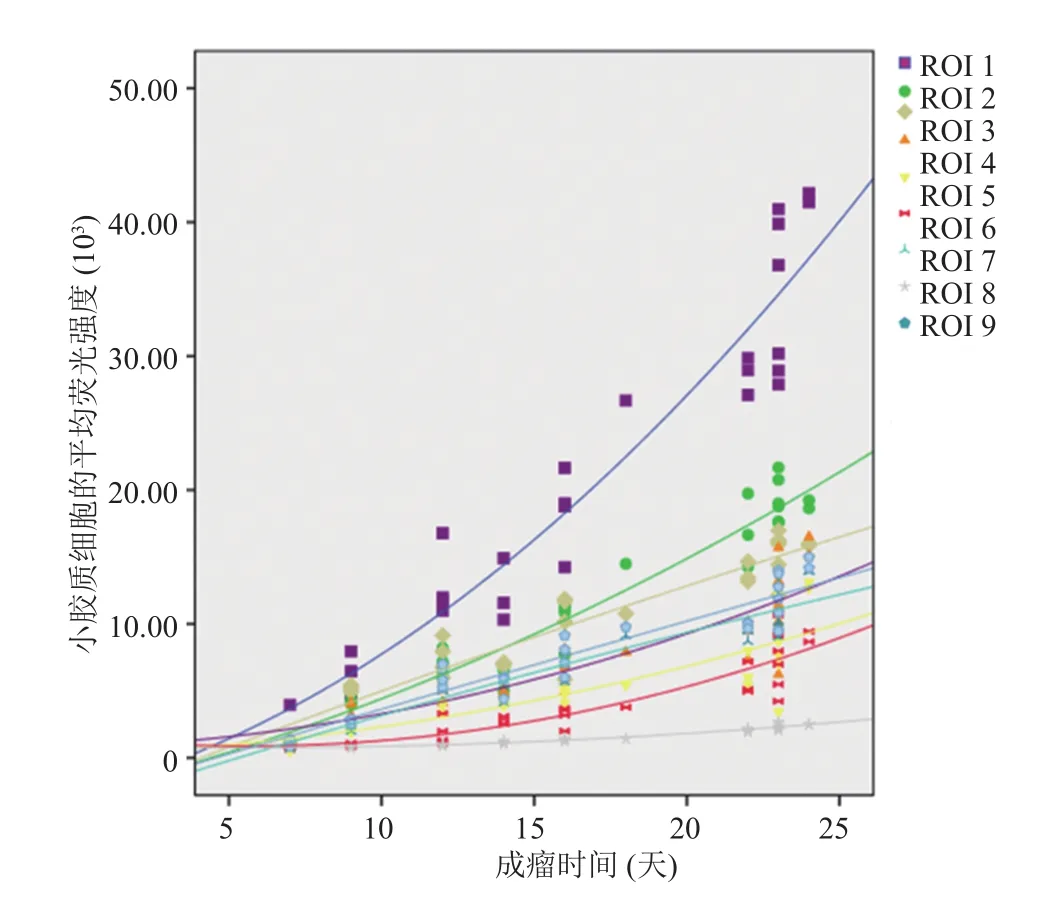
图4 平均荧光强度随着成瘤时间呈二次曲线增加Fig. 4 Mean density increased with time and was best fi tted to binomial functions for all ROIs
3.3 平均荧光强度与 T2WI 平均信号强度的相关性分析
在测量了肿瘤区域的 T2WI 平均信号强度后,通过拟合信号强度与肿瘤区域平均荧光强度的数值发现,信号强度与平均荧光强度呈显著正相关(R2=0.80,F=45.45,P<0.001),结果如图 5所示。
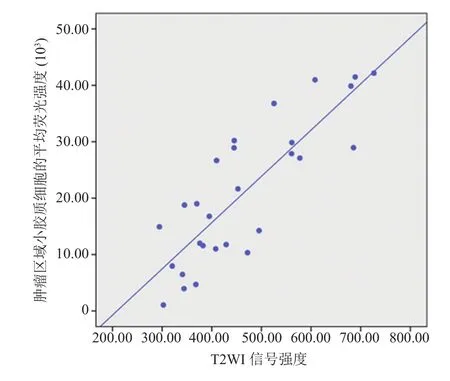
图5 信号强度与平均荧光强度呈正相关关系Fig. 5 Positive correlation between the average signal intensity on T2WI and the mean density of microglia for C6 glioma
3.4 肿瘤最大直径与成瘤时间的相关性分析
图 6 结果显示,肿瘤直径与成瘤时间呈显著正相关(R2=0.72,F=68.36,P<0.001)。当成瘤时间达到 16~18 天时,肿瘤直径的异方差显著增大。
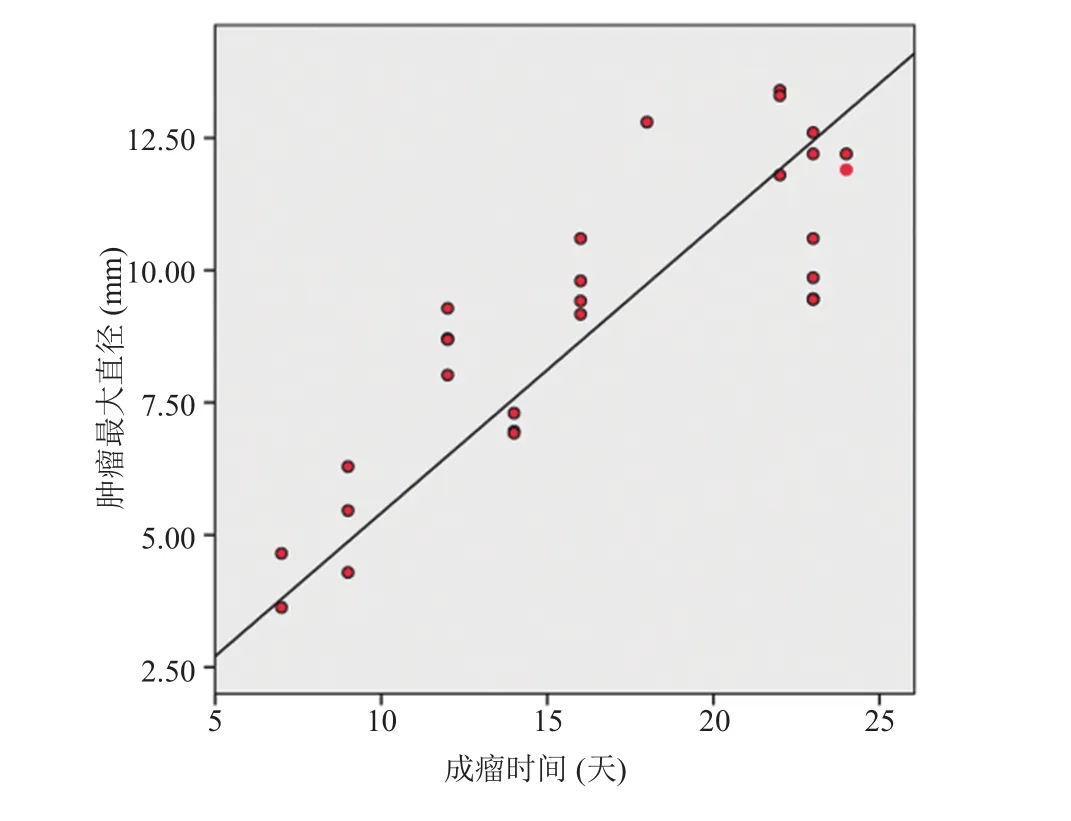
图6 肿瘤直径随着成瘤时间的增加而线性增长Fig. 6 Positive correlation between days after C6 implantation and the tumor diameter
4 讨论分析
本研究表明在肿瘤生长的过程中,肿瘤同侧和对侧的小胶质细胞均参与了胶质瘤的侵袭,并且小胶质细胞的时空异质性随着胶质瘤体积的增大而增加。实验结果和数据分析表明,原位胶质瘤可能触发了全脑小胶质细胞的趋化,而小胶质细胞的时空异质性可能蕴含着胶质瘤的进展机制。
已有动物实验证明,小胶质细胞在 C6 大鼠模型中显示出类似于人脑胶质母细胞瘤的免疫微环境和免疫抑制功能[16]。尽管 C6 胶质瘤在激发同种免疫时有一定的局限性[17],但它对研究低级别胶质瘤的治疗是一个有效的模型[18]。同时,也有报道指出大鼠 C6 胶质瘤模型类似于人类中级(II 级)到高级别(IV 级)的胶质瘤[19,20],在肿瘤发生发展的基因表达方面,C6 大鼠模型与人类胶质母细胞瘤有一定的相似性[21]。因此,采用 C6动物模型研究小胶质细胞对胶质瘤的影响,对人脑胶质瘤的研究具有重要参考意义。
本研究中,肿瘤直径达到 9 mm 后小胶质细胞分布的异质性更加明显。首先,灌流后测得的大鼠大脑的平均横向长度为 14.18 mm(12.9~15.0 mm),说明当肿瘤直径达到 9 mm 时,胶质瘤已经侵入对侧大脑半球,生物侵袭性增加。胶质瘤的加速发展常伴随基因组异质性的增大[22],进而可能导致胶质瘤相关的小胶质细胞趋化并表现出更强的异质性。其次,以往研究发现 C6 胶质瘤发展过程中存在自愈倾向,即部分肿瘤可能发生不同程度的体积缩小或消失倾向,使得肿瘤直径和小胶质细胞测量值的分布进一步复杂化。最后,胶质瘤环境下小胶质细胞趋化特性自身的多样性也可能导致其时空异质性增加。有研究发现,C6 大鼠模型在成瘤 10~20 天时,肿瘤结节内的小胶质细胞密度达到峰值[23]。本研究中,胶质瘤模型直径达到 9 mm 是在种瘤 16~18 天后,在这一时间内,不同肿瘤个体的小胶质细胞浸润达到峰值的时间差异也可能导致小胶质细胞密度异质性的增加。
本研究也具有一定的局限性。如在 C6-SD 大鼠胶质瘤模型中,部分大鼠胶质瘤具有自愈的倾向,因此大鼠模型的实验结果对临床应用还需进一步研究。同时,IBA-1 染色结果中的小胶质细胞有部分是大脑固有小胶质细胞,与胶质瘤促进无关,但数量相对而言较少,对实验结果影响不大。
正常情况下,大鼠脑内小胶质细胞在数量、功能、形态及空间分布上均有一定的异质性。理论上,大鼠大脑中固有的小胶质细胞可能对本实验平均荧光强度的测量有一定的干扰。但在本实验中,全脑范围内的非肿瘤区的小胶质细胞密度与胶质瘤进展显著相关,这一结果更可能源于胶质瘤诱导的小胶质细胞异常定植。Juliano 等[24]研究发现,胶质瘤的进展促进肿瘤浸润边缘的小胶质细胞的活化和定植能力。Engelhorn 等[25]进行的动物实验研究发现,种瘤区域周围确有大量的活化小胶质细胞,在脑外伤动物模型中也检测到病灶以外的大脑微结构异常与小胶质细胞增加密切相关[26]。此外,胶质瘤缺血坏死也是诱发小胶质细胞浸润的重要原因[27]。但本研究的胶质瘤标本 HE 染色光镜下均未见明显坏死区域,肿瘤的 T2WI 信号未见明显不均的高信号。因此,本实验中非肿瘤区域的小胶质细胞定植应为胶质瘤诱导的免疫响应,且胶质瘤进展引发全脑范围内的小胶质细胞定植,其空间异质性与肿瘤的大小以及与肿瘤的距离有关,并随着肿瘤的进展呈加速趋势。同时,小胶质细胞浸润增加了胶质瘤内的细胞含量,并促进了细胞外基质重塑,可能是导致 T2WI 信号随小胶质细胞密度增加而增加的原因。
5 结 论
胶质瘤在发生、发展过程中触发了全脑范围的小胶质细胞定植,其空间异质性与肿瘤的大小及肿瘤的距离有关,并随着肿瘤的进展呈加速趋势。这些发现提示,在预测胶质瘤生物侵袭性、评估治疗响应和靶向微环境治疗胶质瘤的实验研究中,有必要从全脑范围评估小胶质细胞的作用。

